十年间ADR自发报告中467例典型病例风险信号再评价
高 奥,赵鹏芝,郭代红(1.解放军总医院医疗保障中心药剂科,北京 100853;2.解放军药品不良反应监测中心,北京 100853)
近年来,国家药监部门对严重药品不良反应(adverse drug reaction,ADR)报告的重视程度逐年递增。我中心一直重视严重ADR报告的评价、分析、信号筛选与信息反馈,早在2011年11月即开始发布《严重ADR报告月度分析简报》(简称月度简报),该简报通过汇总并定期反馈每月收到的严重ADR报告评价结果及典型案例深度分析报告,及时为各网点医院提供需要关注的用药风险警示信号[1]。目前,月度简报已发布10年,共120期,涉及467例典型病例,现对相关数据进行统计分析,综合把握风险点分布及涉药情况,为持续提升医疗机构风险监测评价能力提供参考。
1 资料与方法
1.1 资料来源
采用回顾性研究方法,收集我中心2011年11月 -2021年10月发布的120期月度简报中467例典型病例报告的相关数据(遴选流程见图1),评价标准参照《药品不良反应术语使用指南》及常见不良事件评价标准(common terminology criteria adverse events,CTCAE)。按照2015版《WHO-ART术语集》中首选术语(preferred term,PT)对涉及ADR的表现进行规范化整理。参照《新编药物学》(第18版)以及《国家2021版医保目录》对涉及药品进行分类。风险类型分为死亡病例、新发严重、集中趋势及加关注4类[1]。其中,同一月度、同一厂家、同一药品导致的相同ADR累计超过2例则为集中趋势;重点监测品种、高风险品种、新药等引起的较有意义的严重ADR予以加关注。
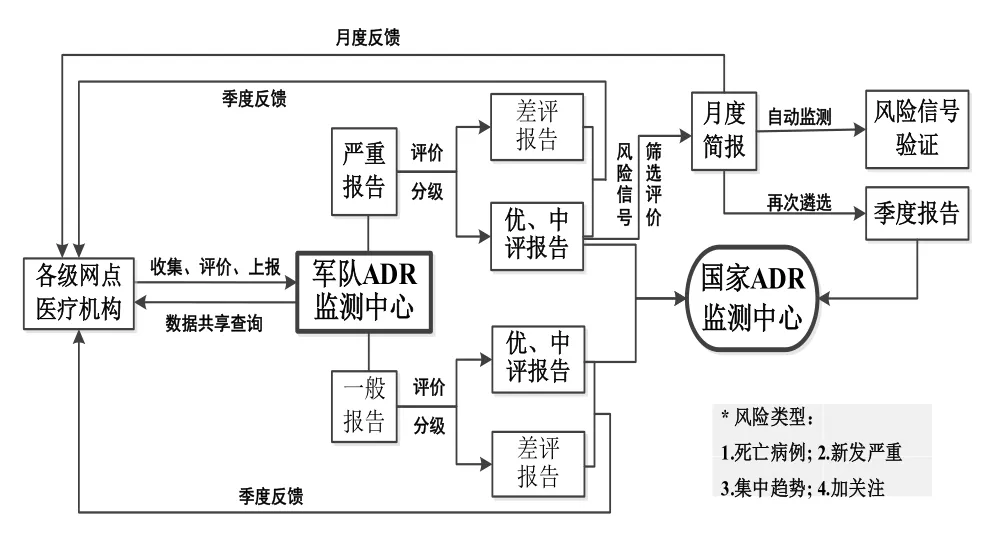
图1 月度简报典型病例遴选流程图Fig 1 Selection flow chart of monthly typical cases
1.2 统计方法
运用Excel 2013及SPSS 26.0对数据进行统计分析,符合或近似符合正态分布的计量资料用均数±标准差表示,偏态分布的计量资料用中位数表示;计数资料用率或%表示。同一病例报告中有累及多个系统/器官的ADR表现,分别计算例次。
2 结果
2.1 风险类型分布概况
经过风险信号筛选确定的典型病例共计467例,遴选自10年间214 463例ADR自发报告中的19 209例严重报告,其中新发严重333例(71.31%)、加关注66例(14.13%)、集中趋势48例(10.28%)、死亡病例20例(4.28%)。20例死亡病例中,17例与化学药品相关,2例与生物制品相关,1例与中药/中成药相关,详见表1。
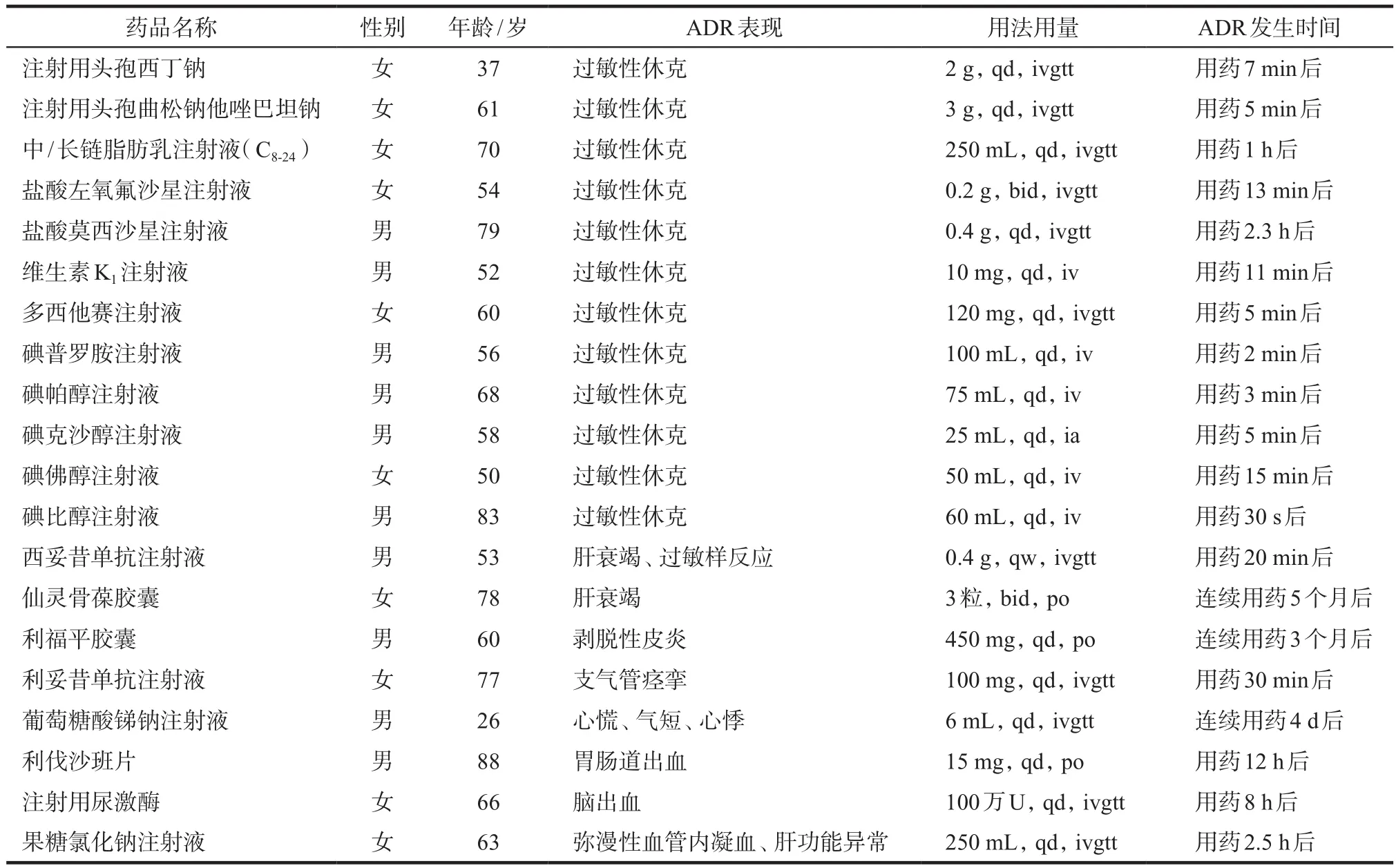
表1 20例死亡病例相关信息Tab 1 Relevant information of 20 death cases
467例报告中有16例与合理用药问题相关,其中7例存在超适应证用药,4例超剂量用药,2例溶媒不适宜,2例药物相互作用,1例用药不适宜。
2.2 患者年龄与性别分布
467例报告中,女性190例,男性277例,男女比例1.46∶1;年龄最小为1岁,最大为88岁,平均(54.26±19.43)岁,其中60 ~ 74岁患者最多(28.69%),详见表2。
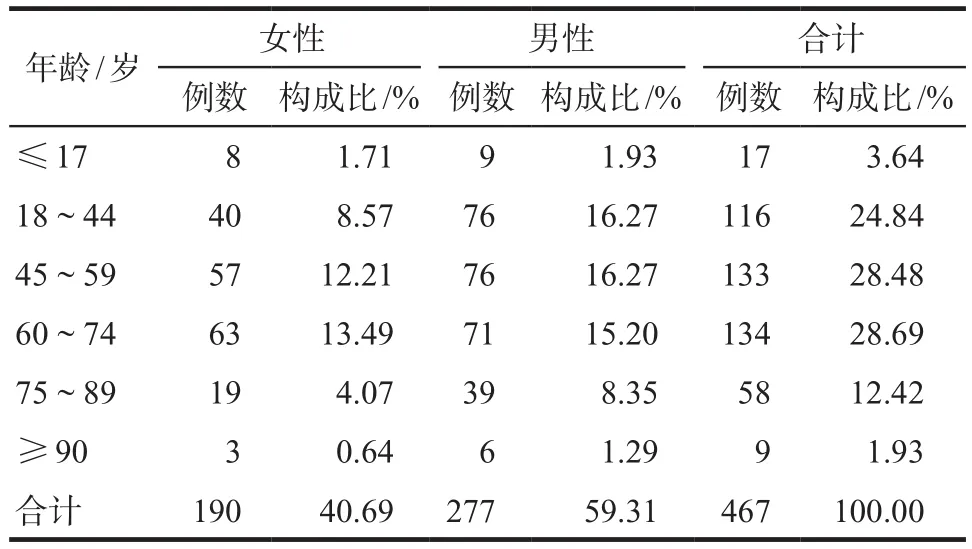
表2 患者年龄和性别分布Tab 2 Age and gender distribution of patients
2.3 用药剂型及给药途径分布
467例报告涉及药品剂型分别为:注射制剂(70.88%)、口服制剂(28.48%)、其他制剂(0.64%)。给药途径分别为:注射给药(静脉注射63.60%,其他注射7.28%),口服给药(28.48%),其他途径(0.64%)。
2.4 涉及药品及其风险类型分布
467例报告涉及药品中,包含化学药354例(75.80%)、中药/中成药88例(18.84%)、生物制品24例(5.14%),保健品1例(0.22%)。详见图2、表3。
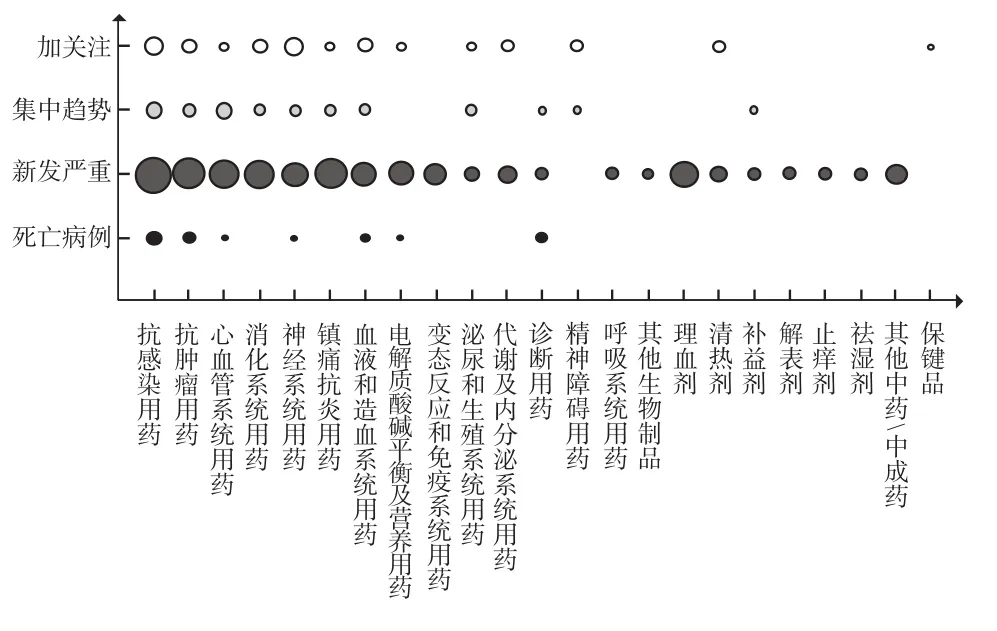
图2 涉及药品分类及风险类型分布Fig 2 Distribution of drug classification and risk type

表3 涉及主要药品及风险类型分布(不含死亡病例)Tab 3 Distribution of drugs and risk types (without death cases)
2.5 ADR累及系统/器官及临床表现
对467例报告涉及ADR的临床表现进行分类汇总,累及系统/器官排名前3位的为免疫系统、肝胆系统及心血管系统;排名前3位的ADR表现为过敏性休克、肝功能异常及高血压,详见表4。

表4 ADR累及系统/器官、临床表现及风险类型分布Tab 4 Systems/organs involved in ADR, clinical manifestations and risk type distribution
3 讨论
3.1 基于自发报告的风险信号筛选
我中心ADR报告数据库现已存储26万余例的报告,本文涉及的467例典型病例遴选自214 463例ADR自发报告中的19 209例严重报告,其中多个信号通过后续的主动监测研究进行了风险信号验证,获得了精准可信的大样本用药人群在真实世界中的ADR发生率。相关研究涉及桂哌齐特、尖吻蝮蛇血凝酶、莫西沙星、头孢哌酮钠/舒巴坦钠、利妥昔单抗、奥美拉唑、氟比洛芬酯等[2-8]。阶段性汇总并开展进一步回顾性再评价分析,可以了解这些重点关注品种和相关ADR的临床特点、涉及药品和风险分布,不仅有助于提升ADR监测工作质量,也强化了监测人员的风险评价能力和科研思维。
3.2 风险类型分布情况分析
依据国家药品评价中心的风险类型归类,中药/中成药相关报告中91%属于新发严重,这与国家药品评价中心的研究结论相吻合,提示中药/中成药的说明书仍然需要继续完善[9]。集中趋势旨在发现聚集性信号,辨别用药质量问题,相关病例多为已知ADR;其中黄体酮注射液致注射部位反应、参麦注射液致过敏性休克及碘普罗胺注射液致过敏性休克等风险信号在国家局发布的安全警示信息中也有相关体现。加关注的风险信号中喜炎平注射液相关过敏反应、单唾液酸四己糖神经节苷脂钠注射剂相关格林-巴利综合征、垂体后叶注射液相关过敏反应等,与国内外发布的安全警示信息呈高度一致性。值得关注的是,死亡病例中90%的患者年龄大于50岁,提示基础疾病、机体代谢能力的衰退对ADR转归的负面作用;70%的死亡病例为用药1 h内发生速发性过敏反应所致,显示速发性过敏反应特别是过敏性休克仍是导致患者死亡的最重要因素[10];因长期口服给药致肝衰竭或剥脱性皮炎导致死亡各有1例,提示应交待患者定期监测相关临床指标,尽早发现ADR并及时防治。
3.3 重点药品风险分析
以药理分类统计,467例典型病例中涉及抗感染药的风险点最多,其次为抗肿瘤药(包括中药/中成药、化学药及生物制品)。抗感染药临床应用广泛,在近年来的《国家药品不良反应监测年度报告》中,其报告数量一直居于首位,是ADR监测工作关注的重点;《抗菌药物临床应用指导原则》也在持续更新与修订,以指导临床合理用药,保障用药安全[2,6,11]。虽然传统的细胞毒性抗肿瘤药因治疗窗窄、选择性低、不良反应较多,但其用于临床治疗的风险/获益评估仍可接受[12]。而随着新型靶向抗肿瘤药的相继推出,免疫检查点抑制剂等临床用药风险受到关注。本研究中涉及单抗类药物相关风险报告8例,有4例为免疫系统相关ADR;其中2例死亡报告,分别为西妥昔单抗致过敏样反应伴肝衰竭、利妥昔单抗致支气管痉挛。有研究指出单抗类药物不良反应与传统化疗药不同,虽然大多可用皮质类固醇和其他免疫抑制剂控制,但也有危及生命和致命事件的报告,提示临床在应用时应重点关注其免疫相关致命性ADR[13-14]。
3.4 ADR临床表现与累及系统/器官
467例典型病例中的ADR累及系统/器官主要为免疫异常及感染、肝胆系统等,临床表现最多见的为过敏性休克、药物性肝损伤等。本研究涉及的过敏性休克病例共118例,多为速发型,其中48%的病例在抢救过程中未使用肾上腺素,这在文献报道中也是普遍存在的现象[10,15]。国内外多家权威机构在免疫反应相关诊断及治疗指南中均指出,及时且正确的抢救对过敏性休克的救治十分关键,肌内注射肾上腺素为首选措施,同时结合患者实际情况给予肾上腺皮质激素、H1受体拮抗剂、补液扩容、吸氧等措施[16-17],提示临床应制定合理的抢救方案,明确肾上腺素在过敏性休克抢救中的首要地位。药物性肝损伤是药品撤市最常见的原因之一,主要防治措施为用药后定期监测肝功能、并在出现异常后及时对症处理;近年来对于特异性肝损伤生物标志物的研究,可用于药物性肝损伤的快速诊断及治疗方案优化[18-20],进而有助于更好的实施药物警戒风险管理。
3.5 风险信号筛选影响因素的控制
由于网点医院ADR评价员更换频繁、交接不完善等原因,导致某些典型病例的再评价过程中,需要进行多次沟通以核实补充相关信息。但月度简报制度执行10年来,其反馈信息增加了报告的数/质量评价情况,典型病例报告的撰写质量及规范性均持续改进提升,经过数据深度挖掘获得了很多值得进一步验证的风险信号。在此期间,我中心通过在常规工作中细化ADR报告的数/质量评价标准、在国家及本中心ADR监测示范单位评选标准中增加了相关项目及比重、制定下发《关于进一步改进ADR报告评价反馈和风险警示信息发布工作的通知》规范ADR报告的格式内容等举措,强化了风险信号筛选相关影响因素的质量控制,巩固了网点医院报告主渠道、提升了典型病例风险警示信息的临床参考度。相关工作不仅显著增加了月度简报的利用价值,对于军队药物警戒系统的运转、各网点医院的合理用药、以及药品说明书的完善等,均具有显著的促进作用。

