人血浆中盐酸依匹斯汀浓度测定及药代动力学、安全性研究
胡岚岚,张 乐,汤建林(陆军军医大学第二附属医院国家药物临床试验机构,重庆 400037)
依匹斯汀(epinastine,EPST)是一种具有非镇静作用的高选择性H1受体拮抗剂。与第一代抗组胺药物相比,盐酸依匹斯汀难以透过血脑屏障,对中枢神经系统副作用较弱[1-2],具有临床应用价值。临床上多用其盐酸盐形式,主要用于抗过敏及哮喘的防治[3-6]。盐酸依匹斯汀主要在肝脏内代谢,但有报道[7]称其代谢程度很低,大部分进入体内的依匹斯汀以原型排出体外。目前国内对盐酸依匹斯汀的药代动力学(pharmacokinetics,PK)研究报道较少,测定体内依匹斯汀血药浓度的方法主要是高效液相色谱-紫外检测法(high performance liquid chromatographyultraviolet,HPLC-UV)[8-12]。近期有国外研究[13-15]分别采用两种分析方法(HPLC-UV和 UPLC-MS/MS)对依匹斯汀的人体药代动力学进行研究,指出两种方法均能满足依匹斯汀的血药浓度测定,实验室可以根据需求选择合适的检测方法。本文以盐酸地芬尼多为内标,采用液液萃取方法处理血浆,建立了HPLCUV分析方法测定人体中盐酸依匹斯汀的血药浓度,以期为临床提供参考。
1 仪器与试药
1.1 仪器
Waters-600E型高效液相色谱系统及Empower色谱管理软件(美国Waters公司);色谱柱:Diamonsil C18柱(150 mm×4.6 mm,5 µm,迪马公司);MC-210S型电子天平(精度0.01 mg,德国Sartorius公司);GL-20G-Ⅱ高速冷冻离心机(上海安亭科学仪器厂);XH-86多用途旋涡混合器(江苏阜宁县罗桥校办工厂);Millipore超纯水系统。
1.2 药品与试剂
盐酸依匹斯汀原料药(含量99.3%,四川科瑞德制药有限公司);内标盐酸地芬尼多对照品(含量≥99.3%,中国药品生物制品检定所);乙醚(AR级,洋州三和化工有限公司);乙腈、甲醇(色谱纯,霍尼韦尔Burdick & Jackson公司);磷酸(分析纯,重庆川东化学试剂厂);磷酸二氢钠(分析纯,重庆北碚化学试剂厂);氢氧化钠(分析纯,北京化工厂);试验用水均为超纯水。
2 方法与结果
2.1 溶液配制
2.2.1 盐酸依匹斯汀对照品溶液精密称取盐酸依匹斯汀对照品5 mg,用少量去离子水溶解后,再定容至50 mL,配成浓度为100 µg·mL-1的盐酸依匹斯汀储备液,取其储备液用去离子水梯度稀释至浓度分别为3.0、2.0、1.6、1.2、0.8、0.4、0.2、0.1 µg·mL-1的标准工作液,冰箱(4 ℃)保存备用。
2.2.2 内标对照品溶液精密称取盐酸地芬尼多对照品5 mg,用少量去离子水溶解后,再定容至50 mL,配成浓度为100 µg·mL-1的盐酸地芬尼多储备液,将盐酸地芬尼多储备液稀释至浓度为10 µg·mL-1的工作液,冰箱(4 ℃)保存备用。
2.2 色谱条件
流动相:乙腈-0.05 mol·L-1磷酸二氢钠(27∶73,pH = 4.5);流速:1.0 mL·min-1;检测波长:210 nm;柱温:30 ℃。
2.3 血浆样品处理
精密移取空白血浆1000 µL,加入内标工作液10 µL,混匀后加入1 mol·L-1的NaOH溶液1000 µL和乙醚5 mL,旋涡提取10 min后,于9000 r·min-1条件下离心10 min,准确吸取有机相于离心管中,室温下氮气吹干。残渣加入流动相200 µL,旋涡振荡10 min,离心后取上清液50 µL进样。
2.4 给药方案及安全性评价
男性受试者20例,年龄18 ~ 28岁,身高160 ~185 cm,BMI 19 ~ 24 kg·m-2,并经血压、心率、肝肾功能、血尿常规和心电图检查证实为健康受试者。合格受试者要求无中枢神经系统、心血管系统、肝肾、消化道、肺及过敏性疾病病史,在试验前1个月内未服用其它药物,试验前3个月内未参加已批准的药物临床试验,试验期间不饮用茶、酒和含咖啡因的饮料且禁止吸烟。受试者入组后根据临床常规用量确定服药剂量为含主药盐酸依匹斯汀40 mg,以温开水200 mL送服。服药前12 h禁食,于次日清晨空腹给药,2 h后可饮水,3.5 h后统一用餐。分别于给药前和给药后0.5、1、1.5、2、3、4、5、6、8、10、12、24、36 h抽取上肢静脉血4 mL,肝素抗凝后分离血浆,于-20 ℃冰箱储存待测。本研究方案经由第三军医大学第二附属医院医学伦理委员会审批同意(临审第2007006号)。
受试者在试验前签署知情同意书,并在试验期间统一进食,清淡饮食,研究医生在给药前后通过询问和受试者主动报告的方式记录不良反应,并于试验结束后对受试者进行常规的体格检查以及实验室检查。
2.5 方法的专属性
在210 nm紫外检测条件下,盐酸依匹斯汀和内标盐酸地芬尼多均有较好的响应,本试验考察了6个不同来源的健康人空白血浆,获得空白血浆样品图谱;将含药血浆按照“2.3”项下操作后进行分析,获得标准含药血浆图谱及受试者口服药物后的含药血浆图谱;比较空白血浆与含药血浆图谱,考察方法的专属性,详见图1,显示待测物盐酸依匹斯汀与内标物盐酸地芬尼多峰形良好,且能够与血浆中内源性杂质分离完全,待测物和内标的保留时间分别为7.4 min和12.3 min。
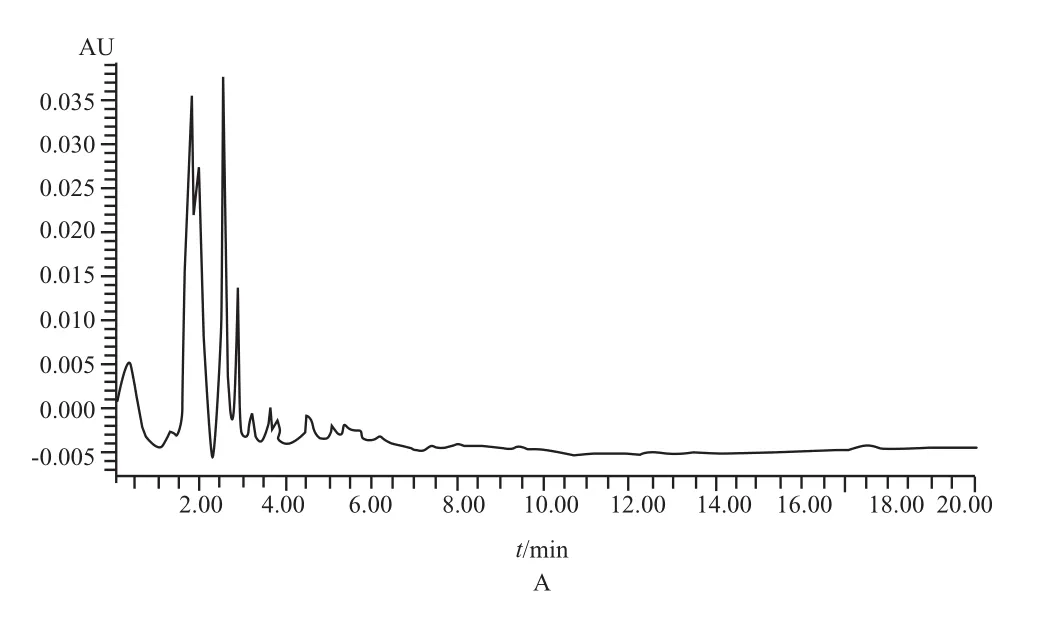

图1 高效液相色图谱A - 空白人血浆,B - 40 ng·mL-1盐酸依匹斯汀血浆样品,C - 服药1.5 h后受试者血浆样品;1 - 盐酸依匹斯汀,2 - 内标盐酸地芬尼多Fig 1 HPLC chromatogramA - blank human plasma, B - blank plasma spiked with EPST at 40 ng·mL-1, C - plasma sample from volunteer 1.5 h after oral administration; 1 - epinastine hydrochloride, 2 - internal standard difenidol hydrochloride
2.6 校准曲线样品制作
取已配制好的盐酸依匹斯汀各浓度标准工作液50 µL,加入950 µL空白血浆,涡旋混匀30 s后按“2.3”项下操作,配制成盐酸依匹斯汀血浆浓度为5、10、20、40、60、80、100、150 ng·mL-1的系列溶液,每个浓度平行2份。记录图谱,以待测物盐酸依匹斯汀与内标峰面积的比值(Y)对药物浓度(X)作线性回归分析,并用最小二乘法计算得到回归方程:Y= 0.012 7X- 0.019 4,r= 0.998 9,线性范围5 ~150 ng·mL-1。
2.7 回收率和精密度
配制低、中、高浓度分别为5、40、100 ng·mL-1的盐酸依匹斯汀质控样品,按“2.3”项下操作,测定峰面积,按回归方程计算浓度,分别于同天不同时间段测定6次,以及每天测定6次连续测定3 d,考察日内、日间精密度和方法回收率。结果见表1,结果显示人血浆中盐酸依匹斯汀的日内精密度RSD < 8.17%,日间精密度RSD < 8.83%,方法回收率在101.4% ~106.2%,均符合试验要求。

表1 盐酸依匹斯汀精密度和回收率. n = 5Tab 1 Precision and recovery rate of epinastine hydrochloride. n = 5
2.8 样本稳定性
笔者分别考察了含药血浆样品在室温放置24 h、待测物和内标储备液4 ℃冰箱放置40 d、-80 ℃冰箱冻存放置29 d、3次冻融循环条件下的稳定性。
储备液稳定性考察是将待测物盐酸依匹斯汀和内标储备液于0、1、2、3、5、7、14、21、40 d从冰箱取出后稀释至0.8 µg·mL-1和1 µg·mL-1待测液测定其峰面积并观察稳定性。含药血浆稳定性考察是将待测物配制成低、中、高浓度的质控样品(5、40、100 ng·mL-1),经过不同条件和时间放置后按照“2.3”项下操作,进样分析。稳定性结果见表2,结果显示待测物盐酸依匹斯汀和内标对照品在4 ℃冰箱至少可放置40 d(RSD <13.7%);血浆样品在室温下至少可放置24 h(RSD <11.5%);-80 ℃冰箱冻存至少可放置30 d(RSD <11.31%);冻融循环三次后仍稳定(RSD < 8.35%)。
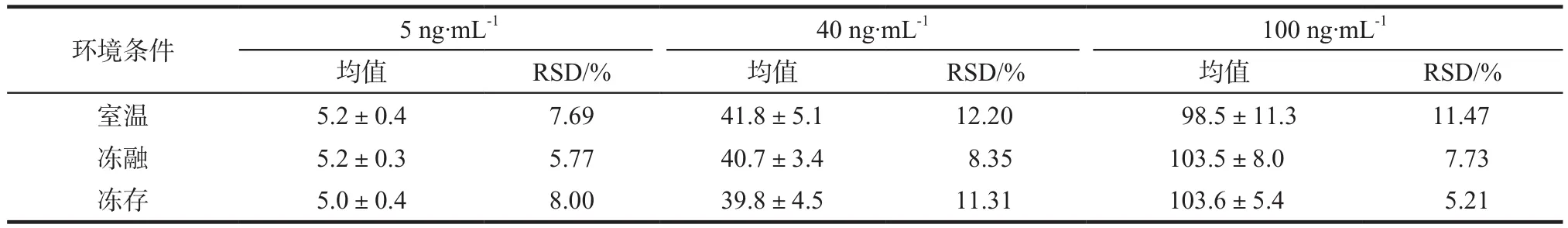
表2 盐酸依匹斯汀稳定性考察. n = 3Tab 2 Stability data of epinastine hydrochloride. n = 3
2.9 药代动力学和安全性评价
20例男性成人健康受试者口服盐酸依匹斯汀分散片40 mg后,采用HPLC-UV法测定人血浆中盐酸依匹斯汀浓度,所得数据经BECS软件(上海宏能软件有限公司)统计分析。人体内平均血药浓度-时间均数曲线见图2,主要药代动力学参数见表3。结果显示,成年人口服盐酸依匹斯汀约(2.18±1.05)h达血药峰值浓度,血浆浓度消除半衰期为(8.77±4.19)h。整个试验阶段在医护人员的监控下进行,受试者在试验期间无退出和脱落病例,依从性较好。未发生不良反应,说明本品在试验剂量下安全性较好。
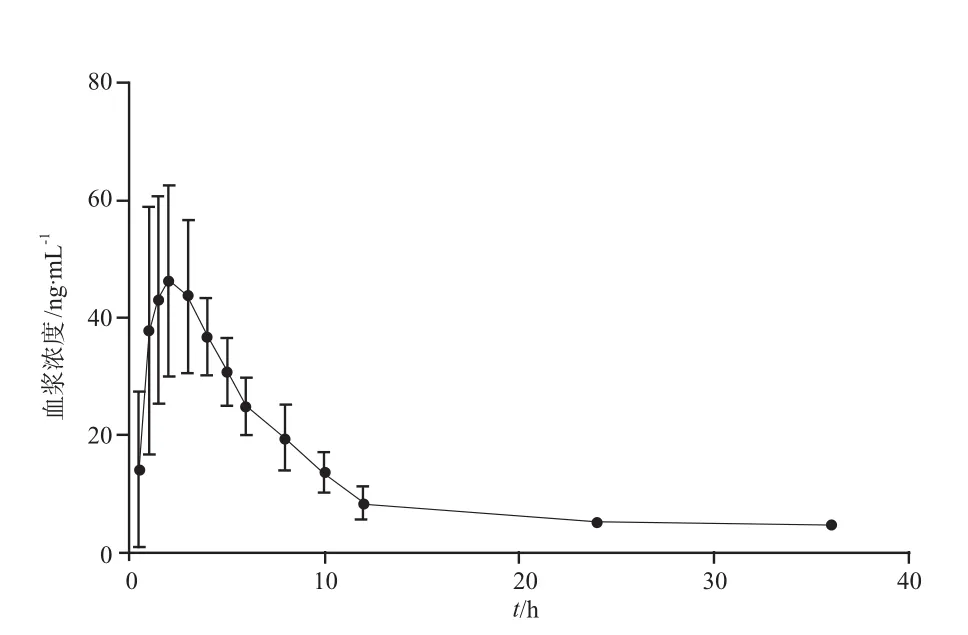
图2 盐酸依匹斯汀血药浓度-时间曲线图. n = 20Fig 2 Blood concentration-time profile of epinastine hydrochloride. n = 20
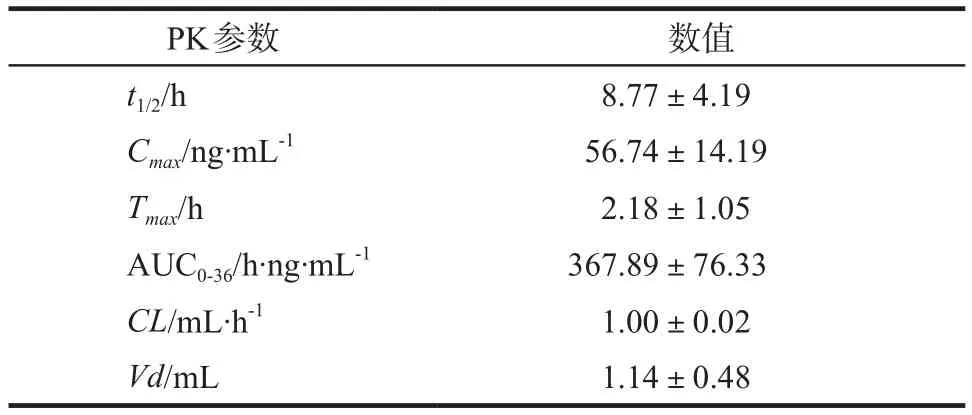
表3 口服盐酸依匹斯汀分散片后主要药代动力学参数. n = 20Tab 3 Pharmacokinetic parameters of epinastine hydrochloride after oral administration. n = 20
3 讨论
3.1 内标物选择
以往多数研究[7,9,10]选择替硝唑为内标,本试验根据内标物选择原则,对多种标准品(含替硝唑)进行了筛选,最后发现盐酸地芬尼多与待测物分离较好,且内标物和待测物均不受血浆内源性物质干扰,满足紫外检测的分离条件。
3.2 流动相的选择
在液相色谱检测时常用的有机流动相体系为甲醇和乙腈,而无机相的选择往往是难点。因盐酸依匹斯汀极性较强,在选择无机相时,笔者首先考虑了去离子水,分别采用乙腈-水体系和甲醇-水体系进样对照,结果显示在乙腈-水体系下柱压较小,而甲醇的柱压较大,在峰型差异较小的情况下,本试验选择了柱压较小的乙腈作为有机流动相。采用纯水作为无机流动相时,峰拖尾严重,且待测物和内标分离效果差,故采用磷酸缓冲液进行试验,首先磷酸在低波长处无吸收,其次缓冲液可以控制流动相pH值,改善分离效果和峰形。考虑到色谱柱的耐酸范围及盐酸依匹斯汀的性质,分别考察了乙腈-0.05 mol·L-1磷酸二氢钠体系在pH为3.5和4.5时分离的效果和峰型,结果显示在pH = 4.5时,待测物和内标的峰型较好,且不受空白血浆的干扰。
3.3 血浆样品的处理
笔者曾尝试用蛋白沉淀法处理血浆样本,由于依匹斯汀在人体内浓度较低,达到纳克级,采用甲醇和乙醚作为蛋白沉淀剂时,待测物定量下限达不到要求。故考虑采用液液萃取的方法进行血浆处理,萃取剂选择了二氯甲烷和乙醚两种有机溶剂,结果发现,使用乙醚液液萃取再浓缩的方法,不仅能满足定量下限的要求,也满足回收率测定。
综上,本文建立了HPLC-UV法测定人血浆中盐酸依匹斯汀浓度,该方法准确、重现性好,适用于临床和实验室对盐酸依匹斯汀的体内血药浓度检测。本临床试验中,20例受试者口服盐酸依匹斯汀分散片40 mg后,达峰浓度Cmax、达峰时间Tmax、半衰期t1/2分别为:(56.74±14.19)ng·mL-1、(2.18±1.05)h、(8.77±4.19)h,这些参数与其他文献报道[1,10](口服40 mg剂量盐酸依匹斯汀)的数据相似。且该药在20例受试者体内安全性和耐受性良好,无不良反应发生。

