肾病综合征患者他克莫司血药浓度影响因素分析
计建军,王长江,查 丽,王小琴,徐佳禛,陶 静 (嘉兴学院附属第二医院药学部,浙江 嘉兴 314000)
自1984年被发现,1989年首次报道其临床应用以来,他克莫司(tacrolimus,FK506)已成为免疫抑制剂方案的中流砥柱[1],其主要通过在T淋巴细胞内与其特异的免疫结合蛋白FKBP结合形成FK506-FKBP复合物,抑制钙调磷酸酶的活性,干扰T细胞的活性和细胞因子的转录,从而发挥免疫抑制作用[2]。近年来有大量研究证明他克莫司治疗肾病综合征有确切的疗效[3-5]。由于他克莫司的治疗窗较窄,不同个体间药效差异大,需根据患者的血药浓度进行剂量调整[6]。本文通过对使用他克莫司治疗肾病综合征患者的血药浓度监测资料等进行整理,分析影响药物血药浓度的因素,以期为临床个体化使用他克莫司提供参考。
1 资料与方法
1.1 资料
回顾性收集我院2017年1月 - 2021年6月使用他克莫司治疗并定期进行血药浓度监测的肾病综合征患者共133例。纳入标准:①患者临床诊断均为肾病综合征并记录一般信息、用药情况、实验室检验结果等详细资料;②患者已服用他克莫司治疗1个月以上,达稳态血药浓度。排除标准:①合并腹泻感染的患者;②使用他克莫司治疗不到1个月以及相关信息记录不全者。
1.2 血药浓度监测方法
他克莫司血药浓度采用均相酶扩大免疫分析法(EMIT)测定。西门子Syva药物浓度分析仪(Viva-E),配套的Emit2000 FK506试剂盒、标准曲线和质控药盒,均为西门子医学诊断产品有限公司提供。
1.3 样品采集
患者服用他克莫司达稳态血药浓度后(至少连续服用3 d以上),在早晨服药前静脉采血2.0 ~ 3.0 mL置于乙二胺四乙酸二钾(EDTA-K2)抗凝管中,严格按照试剂盒说明书,测定他克莫司全血药物谷浓度。
1.4 观察指标
从医院系统调取患者的他克莫司血药浓度数据并记录患者性别、年龄、日服药剂量、合并用药及各项病理生理指标,包括红细胞计数、白细胞计数、血红蛋白、血清白蛋白、尿酸、碱性磷酸酶、葡萄糖、血肌酐、总胆固醇、甘油三酯、总胆汁酸等。
1.5 有效血药浓度范围
肾病综合征患者的他克莫司有效血药浓度(治疗窗)推荐为5 ~ 10 ng·mL-1[7-8]。
1.6 统计学方法
利用Excel软件录入所有数据,整理无误后利用SPSS 22.0软件对数据进行统计分析。计数资料采用例数和百分比表示,计量资料以均数±标准差或中位数表示。两个样本间均数比较采用Mann-Whitney U检验,多组间样本均数比较采用Kruskal-Wallis检验,单因素分析采用χ2检验,多因素分析采用多因素Logistic回归模型,以P< 0.05判定为差异有统计学意义。
2 结果
2.1 患者一般资料
本研究共纳入符合标准的肾病综合征患者133例,其中男性患者79例(59.40%),女性患者54例(40.60%);患者年龄20 ~ 71岁,平均(46.23±15.60)岁。
2.2 他克莫司血药浓度分布情况
在133例患者中有78例血药浓度< 5 ng·mL-1(58.65%);48例血药浓度在治疗窗内(36.09%);7例血药浓度> 10 ng·mL-1(5.26%)。
2.3 日剂量与他克莫司血药浓度的关系
患者每日用药剂量分为≤2.0 mg、2.1 ~ 4.0 mg和> 4.0 mg,对采用不同日剂量的患者的他克莫司血药浓度进行分析,结果显示各剂量组间血药浓度存在显著差异(P< 0.05),详见表1。
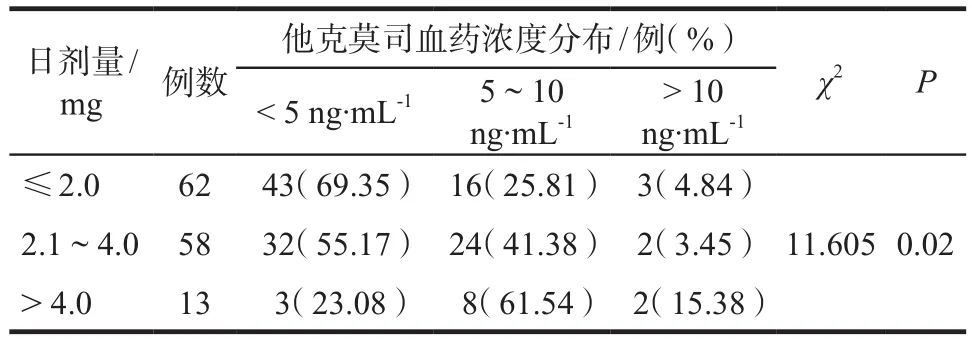
表1 不同剂量组间他克莫司血药浓度分布情况Tab 1 Distribution of tacrolimus plasma concentration among different dosage groups
2.4 患者性别与他克莫司血药浓度的关系
所有研究对象的血药浓度监测结果不服从正态分布,采用Mann-Whitney U检验分析。结果显示,日剂量> 4.0 mg组女性患者平均血药浓度大于男性患者,差异具有统计学意义(P< 0.05),见表2。
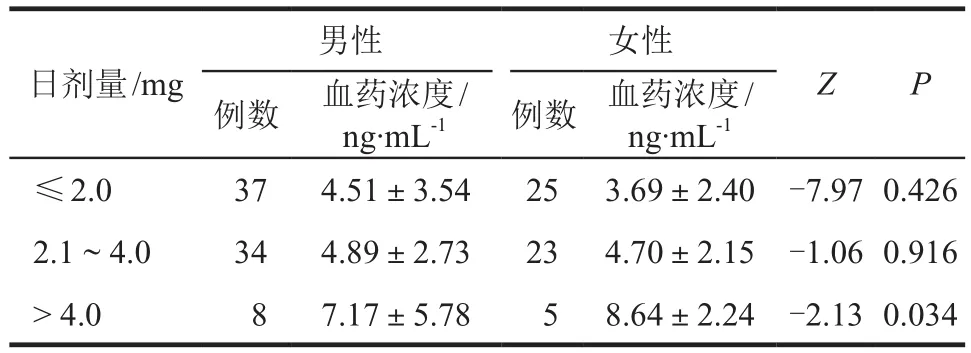
表2 患者性别与他克莫司血药浓度的关系Tab 2 Relationship between patients' gender and tacrolimus plasma concentration
2.5 患者年龄与他克莫司血药浓度的关系
将患者分为青年组(20 ~ 40岁)、中年组(41 ~ 60岁)、老年组(> 60岁)三组,采用Kruskal-Wallis检验对不同年龄组间血药浓度进行分析。结果显示,在日剂量相同的情况下,老年组的平均血药浓度最低,中年组平均血药浓度最高。日剂量≤2.0 mg和2.1 ~ 4.0 mg两组患者各年龄组间血药浓度的差异具有统计学意义(P< 0.05),详见表3。
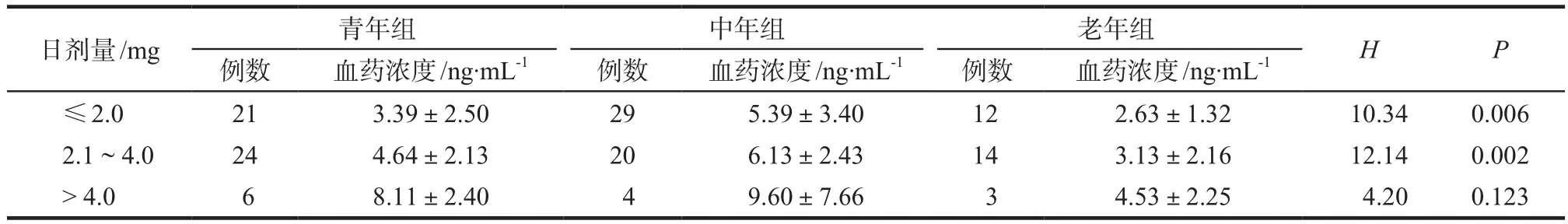
表3 患者年龄与他克莫司血药浓度的关系Tab 3 Relationship between patients' age and tacrolimus plasma concentration
2.6 合并用药与他克莫司血药浓度的关系
根据相关文献[9-10],患者合并使用钙离子通道阻滞剂(地尔硫卓、硝苯地平、氨氯地平)、质子泵抑制剂(奥美拉唑、雷贝拉唑)、复方甘草酸苷、五酯胶囊等会升高他克莫司的血药浓度;而抗酸药(碳酸氢钠)会降低他克莫司血药浓度;钙剂、维生素制剂、骨化三醇等药物对他克莫司血药浓度无影响。采用Kruskal-Wallis检验对日服药剂量≤2.0 mg和2.1~ 4.0 mg两组患者血药浓度进行分析,结果显示,两组间血药浓度均无统计学差异(P= 0.556,P=0.611)。日服药剂量> 4.0 mg组无患者合用可降低血药浓度的药物,采用Mann-Whitney U检验分析,组间血药浓度无统计学差异(P= 0.277),详见表4。
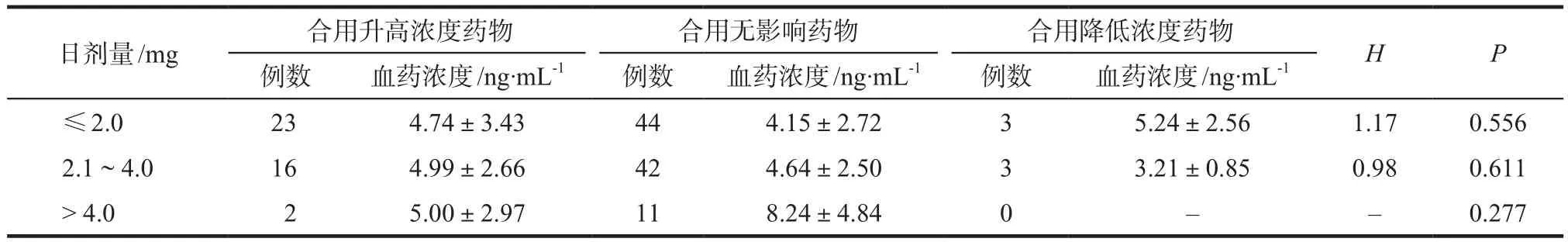
表4 合并用药与他克莫司血药浓度的关系Tab 4 Relationship between combined medication and tacrolimus blood concentration
2.7 影响他克莫司血药浓度的单因素分析
将133例患者的血药浓度监测结果分为< 5.0 ng·mL-1和≥ 5.0 ng·mL-1两组,采用χ2检验对患者的性别、年龄、日剂量、合并用药及各项病理生理指标(包括红细胞计数、白细胞计数、血红蛋白、血肌酐、葡萄糖、总胆汁酸等)进行统计分析。结果显示,两组间在日剂量、碱性磷酸酶、血肌酐水平、葡萄糖、总胆汁酸的血药浓度差异上存在统计学意义(P<0.05),详见表5。
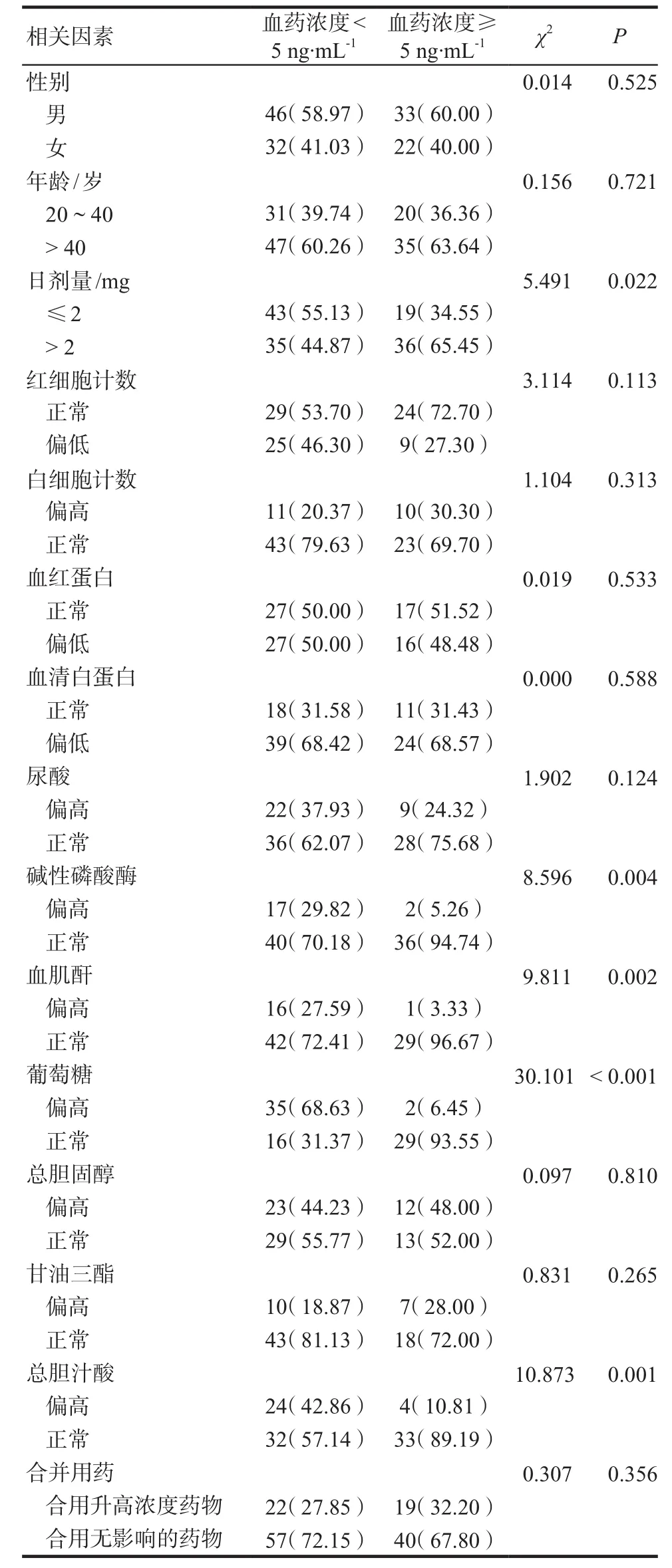
表5 他克莫司血药浓度影响因素的单因素分析.例(%)Tab 5 Univariate analysis of the influencing factors of tacrolimus plasma concentration. case(%)
2.8 影响他克莫司血药浓度的多因素Logistic回归分析
将上述单因素分析中具有统计学差异的因素纳入多因素Logistic回归模型中,以“血药浓度< 5.0 ng·mL-1”组作为对照组进行分析。结果显示,血肌酐水平偏高(OR = 10.077,95%CI:1.109 ~ 91.526)对他克莫司的血药浓度具有显著影响(P< 0.05),见表6。
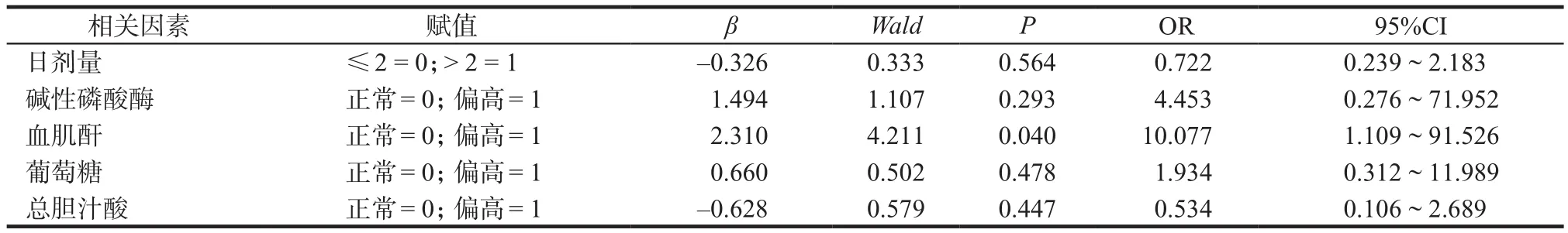
表6 他克莫司血药浓度影响因素的多因素Logistic回归分析Tab 6 Multivariate Logistic regression analysis of influencing factors of tacrolimus plasma concentration
3 讨论
3.1 患者性别、年龄对他克莫司血药浓度的影响
朱旭等[11]研究结果显示性别是影响他克莫司血药浓度的因素之一,为达到有效血药浓度,女性患者给药剂量需显著高于男性患者。本研究结果表明,服用相同剂量时,男性患者平均血药浓度高于女性患者,但无统计学差异,可能由于研究样本量较小及研究对象的个体差异较大所致。本研究结果表明日剂量≤2.0 mg和2.1 ~ 4.0 mg两组患者各年龄组间血药浓度具有统计学差异,这可能与不同年龄段体内他克莫司代谢酶活性有关。他克莫司在体内主要通过CYP450酶代谢[12],随着年龄的增长肝脏代谢能力减弱。但是老年组血药浓度低于青年组,一方面可能因为老年组样本量较少,另一方面老年患者肝药酶活性的个体差异要大于年龄的差异,不能完全按年龄推算肝药酶的活性。
3.2 合并用药对他克莫司血药浓度的影响
国内外均有研究[13-14]表明他克莫司会与许多药物发生相互作用,且影响较大,临床联合用药时需注意合并用药对他克莫司血药浓度的影响。本研究中患者合并使用硝苯地平、氨氯地平等钙离子通道阻滞剂,奥美拉唑、雷贝拉唑等质子泵抑制剂,复方甘草酸苷、五酯胶囊等中成药可升高他克莫司血药浓度,结果显示服药剂量相同情况下合并使用升高他克莫司浓度药物的患者平均血药浓度高于合用无影响药物患者,但无明显统计学差异,说明药物浓度还受其他多种因素的影响。中药对他克莫司的影响目前尚不清楚,且中药药味多,成分复杂,但有研究[15]表明中药中的黄芪会显著降低他克莫司的血药浓度,对于合并服用中药的患者临床也需关注。
3.3 其他影响他克莫司血药浓度的因素
本研究还分析了患者红细胞计数、血红蛋白、血清白蛋白、血肌酐水平、葡萄糖等多项生化指标对他克莫司血药浓度的影响,单因素分析后发现碱性磷酸酶、血肌酐水平、葡萄糖、总胆汁酸的水平高低对血药浓度产生影响,差异有统计学意义,但进一步进行多因素Logistic回归分析后发现仅血肌酐水平对他克莫司血药浓度的影响有显著差异。张鑫等[16]在对肾移植患者他克莫司血药浓度影响因素的研究中也发现血肌酐水平对他克莫司的体内吸收、代谢具有一定的影响。
本研究也存在一定的局限性,仅考虑了非遗传因素对他克莫司血药浓度的影响,而未考虑人体基因多态性的影响。目前已有多项研究[16-17]证明CYP3A系列基因多态性是造成他克莫司个体化差异的重要原因。但从非基因组学角度看,本研究证明患者年龄、血肌酐水平等因素对他克莫司血药浓度的影响仍具有临床参考意义。在用药时需对患者的各项指标、治疗效果、临床表现、不良反应等进行全面分析,及时调整治疗方案以实现个体化用药,达到最佳治疗效果。

