羊源烟曲霉菌的鉴定及致病性研究
唐小凤,邢 柳,向 益,王 利,俄木曲者,魏 勇,孟元华,苗 斌,陈 勇
(1.西南民族大学动物科学国家民委重点实验室,四川 成都 610041;2.四川省畜牧科学研究院,四川 成都 610066;3.四川省凉山州农业科教中心,四川 西昌 625099;4.四川省巴中市南江黄羊科学研究所,四川 南江 635600)
曲霉菌是主要依靠分生孢子经空气传播的一类腐生性真菌,广泛分布于自然界[1],是一种条件致病菌,常分布于土壤、空气、谷物中[2],其主要感染免疫低下患者的肺部[3],当发生深部感染时具有较高的死亡率[4-6].一般健康人群体内的防御系统可以及时有效地将分生孢子清除,只有极少数人群会诱发疾病[7],但有基础疾病或免疫严重缺乏的患者易导致系统感染[8].近几年来,随着接受免疫治疗患者的数量增加,侵袭性曲霉病(Invasive aspergillosis,IA)发病率明显上升[9].临床上,常见具有感染性的曲霉菌有烟曲霉(Aspergillus fumigatus)、黄曲霉(Aspergillus flavus)、黑曲霉(Aspergillus niger)等,其中烟曲霉的致病性较高.据研究,烟曲霉可引起猪食欲下降,呼吸障碍,随后出现肺水肿,严重者因呼吸衰竭死亡,死亡后剖检可见肺水肿和大量胸腔积液[10].此外,烟曲霉毒素极易残留于肝脏,如长期摄入低剂量烟曲霉会导致发生慢性肝脏损伤[10],从而损害免疫系统,导致免疫功能低下,严重者会造成免疫抑制[10].其可通过黏附、定植、逃避宿主补体防御机制、适应内环境、改变营养摄取渠道等方式来逃避宿主的炎症反应,这使得烟曲霉的侵袭性能力更强,是养殖业的重点防控对象[11].可见,烟曲霉不管对人还是动物都存在一定威胁,所以对其研究具有重要意义.本研究通过形态学及分子生物学鉴定了一株烟曲霉,并通过小鼠感染试验探究烟曲霉的致病性,通过耐药试验筛选出耐药药物,旨在为兽医临床烟曲霉的诊断和用药提供科学资料.
1 材料与方法
1.1 材料
1.1.1 病料来源
2020 年7~8 月四川某山羊场多只羊出现食欲不振、精神沉郁、消瘦、皮肤出现瘙痒发红甚至破溃等症状.部分羊只出现腹泻、四肢瘫软无力等症状,怀孕母羊有流产、产弱死胎等症状.无菌采集病死羊肝、肾等组织样本低温保存运输回实验室.
1.1.2 实验动物
6 周龄SPF 健康小鼠30 只,体重为(18 ±2)g,雌雄各15 只,购自达硕试验动物责任有限公司.
1.2 试剂及仪器
苏木素、伊红染液试剂盒购自上海碧云天生物技术有限公司;两性霉素B(9 137)、卡泊芬净(9 165)、伏立康唑(9 168)、伊曲康唑(9 139)药敏纸片购自意大利Liofilchem 公司;恒温培养箱(DHP-9052)购自上海一恒科学仪器有限公司;凝胶成像系统(CL1 000)、PCR 仪(SimpliAmp)购自Thermo Fisher Scientific 公司;石蜡切片机(RM2 235)购自德国Leica 公司;显微镜(UB102i)购自重庆澳浦光电技术有限公司;马铃薯葡萄糖琼脂(PDA)、MH 培养基购自青岛海博生物技术有限公司;真菌DNA 提取试剂盒购自北京索莱宝科技有限公司.
1.3 菌株的分离培养
用无菌镊子夹取组织样本并剪碎,均匀涂布于马铃薯琼脂培养基(PDA),样本与培养基充分贴合.置28 ℃恒温培养箱培养7 d(箱内放置双蒸水,以保持湿度).培养期间观察并记录菌落生长情况.挑取不同形态的菌落接种于新的(PDA)培养基中纯培养三代.
1.4 菌株的鉴定
挑取菌落中心部位菌落,置于载玻片上,加盖玻片后通过显微镜观察霉菌菌丝和孢子形态并拍照记录.用真菌DNA 提取试剂盒提取总DNA,以此为模板,PCR 扩增菌株ITS 基因.(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′).PCR 反应程序:98 ℃预变性2 min,98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸30 s,共35 个循环.PCR 产物经1 %琼脂糖凝胶电泳检测,回收目的条带后对基因组进行测序.引物合成及测序由上海生工生物工程股份有限公司完成.测序结果用BLAST进行比对,并通过Mega 6.0 软件构建ITS 基因系统进化树.
1.5 菌株的毒力基因检测
以1.4 提取得到的菌株总DNA 为模板,PCR 扩增毒力基因(引物序列及退火温度见表1).PCR 扩增菌株毒力基因、反应程序、电泳检测参照向益等[12].

表1 毒力基因引物序列Table 1 Virulence gene primer sequence
1.6 动物感染试验
取10 mL 无菌PBS 缓冲液入1.3 纯培养得到的霉菌培养基中,用枪头反复冲洗,尽可能多的挑取培养基上的孢子,吸取孢子悬液于无菌EP 管中,摇晃混匀,调整浓度至5.8 ×107CFU/mL.30 只小鼠被随机分为试验组和对照组,每组15 只.试验小鼠每日通过腹腔注射一次浓度为5.8 ×107CFU/mL 孢子混悬液0.3 mL;对照组每日通过腹腔注射一次0.3 mL 生理盐水.实验组和对照组均连续注射7 d 后转为观察,实验周期为15 d,期间对实验组小鼠的临床表现及病死情况做好记录.试验结束后,将所有小鼠断颈解剖处理,观察各组织器官病理变化,取心、肝、脾、肺、肾等典型病变部位于4 %多聚甲醛溶液固定保存.
1.7 病理组织切片HE 染色
将步骤1.6 采集的病变组织用流水洗去多余固定液,放入不同浓度的酒精脱水,溶于二甲苯透明,将融化好的石蜡倒入脱水透明后的组织进行包埋,将包埋好的蜡块切片、烤片.HE 染色方法见向益等[12].
1.8 药敏试验
向1.3 纯化培养的产物无菌加入10 mL 生理盐水,洗脱菌落并用枪头刮取并反复吹打,再用多层无菌纱布过滤后收集孢子悬液.用血细胞计数板计数,并将浓度调整为9.5 ×106CFU/mL.取200 μL 孢子悬液涂布于MH 琼脂培养基,尽可能均匀,分别将伏立康唑、两性霉素B、伊曲康唑、卡泊芬净等四种药敏纸片用无菌镊子夹取放置于MH 培养基,并轻轻按压使其与平板完全贴合(一种药敏片三个重复,并以等边三角形放置).正置放置30 min 后,倒置培养于28 ℃真菌培养箱中,24 h 后观察并测量抑菌圈.结果判定参照意大利Liofilchem 公司的真菌药敏纸片判读标准,见表2.

表2 真菌药敏纸片判定标准Table 2 Fungal Sensitivity Paper Determination Criteria
2 结果
2.1 菌株鉴定结果
菌落培养初期整体为白色,中期菌落中心开始变为浅绿色,边缘仍为白色,菌体逐渐变大、变蓬松,后期中间部分向上凸起为白色且颜色暗于边缘部分,菌落整体干燥(图1A).镜检可见,分身孢子头顶囊呈烧瓶状、整体呈圆形、边缘有小刺凸、带蓝绿色,分生孢子梗光滑,带绿色(图1B).
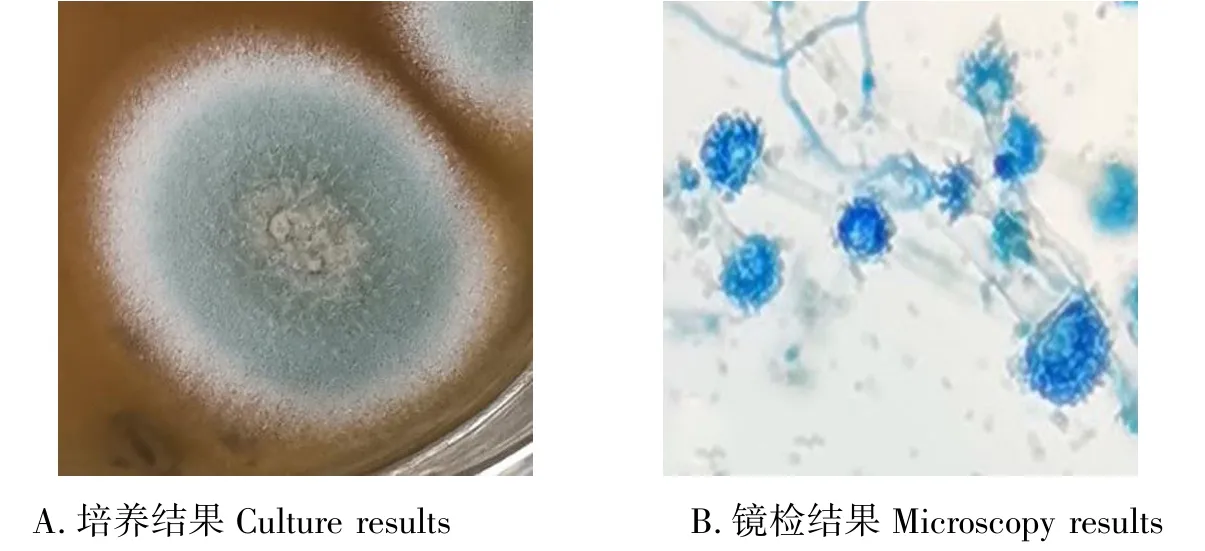
图1 形态学鉴定结果Fig.1 Morphological identification results
该分离株经PCR 扩增ITS 基因得到长度为601 bp 的条带(图2),产物提交至GenBank 获得登录号:MZ150487.经BLAST 比对发现与NR121 481.1(烟曲霉Aspergillus fumigatus)的同源性达100 %(图3).综合鉴定该分离株为烟曲霉,并将其命名为YQM6 株.

图2 ITS 基因扩增Fig.2 ITS gene amplification

图3 系统进化树分析结果Fig.3 Phylogenetic tree analysis results
2.2 菌株毒力基因检测结果
YQM6 菌株毒力基因PCR 扩增结果为:Alb1 阴性,RHO1、PkaR、Cat1、Alp2、AspF1 等五个基因为阳性(图4).

图4 毒力基因检测结果Fig.4 Virulence gene results
2.3 小鼠临床症状及剖检变化
试验组小鼠在孢子悬液注射4 d 后开始出现食欲明显下降、精神沉郁、蜷缩、偶有躁动不安等临床表现,7 d 后小鼠开始死亡,死亡率为35 %.剖检试验组小鼠可见腹腔积液,其颜色为浅黄色伴有轻度腐臭味;部分内脏器官与肠粘连,肾肿大颜色加深,脾肿大有少量出血点;肺略塌陷且表面有大小不一的出血斑,颜色略苍白;小肠黏膜出现灰黄色结节.
2.4 病理组织切片HE 染色结果
实验组小鼠病理组织切片结果显示:心肌血管充血,心肌纤维断裂(图5A);肝中央静脉充血,肝窦扩张,部分肝细胞体积增大伴有水肿,肝索排列紊乱(图5B);脾小体淋巴细胞减少、结构疏松,白髓区内红细胞增多(图5C);肺毛细血管扩张,肺泡壁增厚,管腔狭窄(图5D).
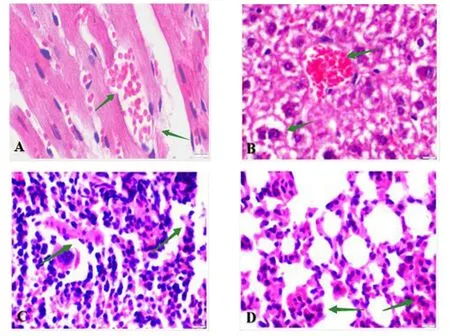
图5 HE 染色结果(40 ×)Fig.5 HE staining results(40 ×)
2.5 药敏试验
结果显示,YQM6 菌株对卡泊芬净耐药,对两性霉素B 中度敏感,对伊曲康唑和伏立康唑敏感,详见表3 和图6.

表3 药敏试验结果Table 3 Drug sensitivity test results

图6 4 种抗真菌药物对YQM6 菌株的敏感性Fig.6 Susceptibility of four antifungal drugs to YQM6 strains
3 讨论
烟曲霉是曲霉属中最为常见的一种,可以根据其形态特征、生长特性做出初步鉴定.苏战强等[13]报导在马铃薯琼脂培养基上培养的烟曲霉菌落培养初期为白色绒毛状,培养中期菌落中心变为绿色;后期菌落颜色变为深绿色,菌落变大且长势蓬松,中部整体向上凸起.高兴娟[14]报导烟曲霉显微镜下呈现:分生孢子穗呈圆筒形,表现不同深浅的绿色;顶囊呈烧瓶状,仅上部分产生孢子;分生孢子梗光滑;分生孢子呈球形、多刺、绿色.本研究YQM6 株在PDA 上的生长特性和镜检形态特征与上述结果基本一致.
内部多种毒力因子的共同作用是曲霉属真菌引起人和动物感染发病的主要原因[15].小G 蛋白(Rho1)主要参与曲霉极性生长、菌丝分支和细胞壁的合成,敲除Rho1 基因后,烟曲霉生长会受到极大抑制[15].蛋白激酶A 调节亚基(PkaR)会影响烟曲霉萌发孢子对氧化损伤的抵抗,并参与烟曲霉萌发孢子ROS 的产生和萌发孢子凋亡的调控[16].过氧化氢酶1(Cat1)可编码去除氧化应激ROS 毒性相关的酶以此来帮助烟曲霉提高入侵宿主的能力,极大增强了抵抗机体免疫系统的杀伤作用[17].碱性蛋白酶(Alp2)在过敏性哮喘患者患病过程中起关键作用,在真菌产生分生孢子中担负重要角色[18].核糖体毒素之一核糖核酸酶(Aspf1),是烟曲霉引起过敏反应和支气管肺炎的主要过敏原[19].基因Aspf1 是烟曲霉引起过敏反应的关键因子,与构巢曲霉和米曲霉相比,更利于附着于组织并抵御宿主炎症反应,从而更适合在宿主体内生长并繁殖[20].Tsai 等[21]从人源烟曲霉菌株中扩增出了Cat1、Rhol、PkaR、AIb1 基因,证实了这些毒力基因是烟曲霉具有侵袭感染的重要因素.Abad 等[22]从人源烟曲霉中扩增出了Cat1、Alp2 基因,并对其在烟曲霉致病机理中的重要作用做出了研究.本研究从YQM6 菌株扩增出RHO1、PkaR、Cat1、Alp2、AspF1 等五个基因,提示该菌株具有较强的致病性.但未能扩增出Alb1 基因,原因可能为菌株的来源不同导致毒力因子有所差异.
Nururrozi 等[23]报导烟曲霉可引起肉鸡肺严重充血并产生大面积结节,还可引起实质性病变甚至坏死;肺组织经HE 染色后在显微镜下可见菌丝和孢子,并伴有肉芽肿性炎症.Knudtson 等[24]报导烟曲霉是引起真菌性胎盘炎常见的病因之一,严重者可导致怀孕母牛流产,且在多个流产病例胎盘组织中分离到菌丝和孢子,证实了烟曲霉和胎盘炎有关.崔蕊[25]报导侵袭性肺曲霉病会引发急性、广泛性、出血性肺炎,并可形成脓肿和由上皮细胞和巨噬细胞组成的肉芽肿;菌丝不断通过肺部侵入血管,从而导致坏死性血管炎,甚至形成血栓.刘倩等[26]报导将烟曲霉感染小鼠,解剖后发现小鼠肺肿大、颜色暗红,有明显的结节及出血灶,肺泡结构消失、大量炎性细胞聚集.本研究中,YQM6 菌株引起的组织病变与上述结果相似,证实了烟曲霉有一定的致病性.
药敏试验对指导临床用药具有重大意义,目前治疗真菌感染的药物按作用靶点可分为麦角甾醇的生物合成抑制剂、影响真菌细胞膜功能的抗真菌药物、影响真菌细胞壁形成的抗真菌药物、抑制鞘磷脂的生物合成、核酸合成的抑制剂、蛋白合成的抑制剂、微管生物合成的抑制剂等7 类[27].临床常用治疗药物有伊曲康唑、酮康唑、氟康唑、伏立康唑、两性霉素B 和卡泊芬净等[28].Gardiner 等[29]报导卡泊芬净体外敏感性降低的发展被认为是不可避免的,并且分离到两株对卡泊芬净敏感性降低的突变烟曲霉.樊虹报导从中国某医院花盆土壤中分离到的烟曲霉对伏立康唑、伊曲康唑存在耐药[30].本试验分离到的羊源烟曲霉产生耐药的结果与Gardiner 等的报导相符,与樊虹的报导结果相反,这说明烟曲霉对伏立康唑、伊曲康唑的耐药性可能与菌株的宿主和来源有关.临床中羊的烟曲霉感染可使用伊曲康唑、伏立康唑药物进行治疗.
4 结论
本研究通过对YQM6 菌株进行形态学及分子生物学鉴定,综合鉴定该菌株为烟曲霉菌.通过扩增毒力基因和小鼠感染试验,表明了该菌株有一定致病性,并通过药敏试验筛选出耐药性药物,为兽医临床烟曲霉菌病的诊断和治疗提供了参考资料.

