人工疏果对‘爱媛28’橘橙果实糖酸含量及代谢基因表达的影响
宋江涛,谌丹丹,公旭晨,商祥明,李春龙,蔡永喜,岳建平,王帅玲,张卜芬,谢宗周,刘继红
人工疏果对‘爱媛28’橘橙果实糖酸含量及代谢基因表达的影响
宋江涛1,谌丹丹2,公旭晨1,商祥明1,李春龙1,蔡永喜3,岳建平3,王帅玲3,张卜芬3,谢宗周1,刘继红1
1华中农业大学/园艺植物学教育部重点实验室,武汉 430070;2宜昌市农业科学研究院,湖北宜昌 443000;3湖北省宜都市果茶服务推广中心,湖北宜都 443300
【背景】‘爱媛28’橘橙是杂交柑橘品种(´),因其优良的果实品质,受到人们的青睐。疏果是农业生产过程中常用的一种提高果实品质的技术,不仅能使果实体积明显增大,而且还能够增加果实可溶性固形物含量。但是,疏果增加果实可溶性固形物含量的具体机制仍然不清楚。【目的】本研究以枳()为基砧、椪柑()为中间砧的4年生‘爱媛28’橘橙作为试验材料,探索疏果影响果实糖酸含量变化的具体机制。【方法】在‘爱媛28’果实幼果期进行疏果,每隔半个月左右测定疏果果实与未疏果果实的横纵茎,采样并测量单果重与糖酸含量,选择糖酸含量差异明显的时期测定糖酸代谢相关酶的活性及其对应编码基因的相对表达量。【结果】疏果显著增加‘爱媛28’果实在生长中后期的横纵茎和单果重,显著加快果实柠檬酸含量的降解速度,但并未影响果实成熟时最终的柠檬酸含量;显著增加了果实的葡萄糖和蔗糖含量,但对果糖含量没有显著影响。疏果显著增强蔗糖代谢过程中的蔗糖合成酶SSⅡ(合成方向)、蔗糖合成酶SSⅠ(分解方向)、蔗糖磷酸合成酶(SPS)和柠檬酸分解代谢过程中的胞质顺乌头酸酶(Cyt-ACO)、胞浆异柠檬酸脱氢酶(ICDH)和谷氨酰胺合成酶(GS)的活性。疏果显著促进蔗糖代谢过程中在早期的相对表达量和在所有时期的相对表达量,以及柠檬酸分解代谢过程中、、、和在早中期的相对表达量。【结论】人工疏果主要通过增强蔗糖合成代谢过程中蔗糖磷酸合成酶的酶活来促进果实可溶性糖的积累,提高柠檬酸分解代谢过程中相关酶的活性和基因表达水平,加快柠檬酸降解,从而在提升果实品质中发挥重要作用。
疏果;‘爱媛28’;果实品质;蔗糖代谢;柠檬酸代谢
0 引言
【研究意义】柑橘是世界第一大栽培果树,同时也是仅次于小麦和玉米之后的世界第三大贸易农产品,其种植面积和产量均位于第一位[1]。柑橘果实不仅拥有极其丰富的营养元素,包括可溶性糖、有机酸、Vc、矿物质等,还拥有化痰止咳、消肿止疼、健胃疏肝等多种保健疗效的功能[2]。伴随民众生活条件的改善,对饮食品质的要求也不断提升,但是由于市场内柑橘果实的品质参差不齐,难以满足人们对高品质的需要,再加上化肥农药的过量使用,进一步降低了果实品质,因此亟需改善柑橘的果实品质。提高果实品质的技术较多,疏果是其中常用的一种。【前人研究进展】研究表明,疏果可以提高果实品质,增加果树产量[3-5]。在形成柑橘果实品质的众多因子中,糖酸含量是决定性因素[6]。柑橘果肉汁胞内决定甜度的糖大多数是葡萄糖、果糖和蔗糖,前两者为单糖,后者为双糖,如果把蔗糖的糖度值定义为1,那么果糖为1.75,而葡萄糖则是0.75[7]。参与糖代谢的酶有蔗糖磷酸合成酶(SPS)、蔗糖合成酶(分解方向SSⅠ和合成方向SSⅡ)、酸性转化酶(AI)和中性/碱性转化酶(NI)。SS既能够参与蔗糖的合成过程,也能够参与蔗糖的分解过程,两过程互为可逆反应[8]。刘翔宇等[9]发现以枳壳作为砧木的砂糖橘果肉中表达量显著增加,蔗糖合成酶(合成方向)活性显著更高,蔗糖含量也更高。SPS主要存在于胞浆中,参与蔗糖的合成代谢,其催化效率和含量决定了植物将同化物转化为蔗糖的能力和最终蔗糖的含量[10]。魏清江等[11]推测与金柑果实中蔗糖含量的上升有密切的联系。参与酸代谢的酶有磷酸烯醇式丙酮酸羧化酶(PEPC)、柠檬酸合成酶(CS)、顺乌头酸酶(ACO)、NADP-异柠檬酸脱氢酶(NADP-IDH)、ATP-柠檬酸裂解酶(ACL)、谷氨酰胺合成酶(GS)和谷氨酸脱羧酶(GAD)等。在线粒体内磷酸烯醇式丙酮酸(PEP)与二氧化碳和水分子结合后在PEPC的作用下转化成草酰乙酸(OAA)与磷酸基团,之后OAA和乙酰辅酶A(Ac-CoA)通过CS转化为柠檬酸[12]。果实柠檬酸降解能够凭借多种途径,如乙酰辅酶A途径或者称ATP-柠檬酸裂解酶(ACL)途径、谷氨酰胺合成酶(GS)途径以及-氨基丁酸(GABA)途径等。Guo等[13]发现‘纽荷尔’脐橙果实中柠檬酸的含量与Cyt-ACO活性的相关性为-0.9224,说明Cyt-ACO参与了柑橘果实柠檬酸的降解。Li等[14]发现CitNAC62和CitWRKY1能够通过调节的表达来影响柠檬酸的积累。Feng等[15]发现杨梅果实发育过程中,柠檬酸含量逐渐降低,而和的表达量则逐渐上升,表明和可能在柠檬酸降解过程中发挥重要作用。Li等[16]发现在椪柑和温州蜜柑果实发育过程中,随着柠檬酸含量的逐渐降低,的表达水平逐渐增加,表明可能是柠檬酸降解的一个靶基因。【本研究切入点】柑橘是湖北省进行商业化栽培的第一大水果,栽培面积与总产量都位于全省所有种植水果的第一位。据统计,2017年湖北省柑橘种植总面积达到21.8万hm2,总产量约为466万t,总产值约130亿元,栽培面积位于全国第6位,总产量名列全国第3位[17]。宜都市是湖北省的主要柑橘产区之一。湖北省宜都市位于亚热带季风性气候区,年均温度高于15℃,10℃及以上的年活动积温超过5 300℃,霜期不到100 d,年平均日照时数超过1 600 h,非常适合宽皮柑橘的栽培种植[18]。‘爱媛28’橘橙(´)是日本学者于1990年以‘天草’为父本、‘南香’为母本,经过杂交育种选育的一个橘橙类杂柑品种,后来被我国引入栽培。其果实成熟时果面呈现出美丽的深红色,所以又被人们称作‘红美人’。因其优良的品质,受到人们的喜欢,在长江三角洲水果市场上的销售价格曾高达40—60元/kg,经济效益十分可观[19]。近年来,‘爱媛28’在湖北省宜都市作为优良新品种进行栽培。但‘爱媛28’结果量大,在正常栽培条件下,每株树结果多,导致果实较小,影响其商品性能。‘爱媛28’易成花,且坐果率较高,为了避免果实品质的降低,需要进行合理的疏花疏果[20]。因此,研发应用‘爱媛28’大果栽培技术,是生产上提升果品质量的迫切需求。【拟解决的关键问题】通过研究疏果对‘爱媛28’柑橘果实糖酸含量、糖酸代谢相关酶活性以及对应编码基因表达水平的影响,探索‘爱媛28’品质提高的技术,并解析其可能机制,为生产上采用疏果调控杂柑果实品质提供理论基础和技术指导。
1 材料与方法
1.1 试材与取样
试验于2020年在湖北省宜昌市宜都市渔洋河生态家庭农场进行。果树露天栽培,果园管理水平中等。试验材料为4年生的‘爱媛28’高接植株,基砧为枳,‘鄂柑一号’椪柑为中间砧。选择生长状况相似的健康树6株,其中3株于7月20号(第二次生理落果结束后)进行疏果,另外3株不疏果作为对照(每株为1次重复,共3个重复)。疏果时,主要疏除病果、小果、朝天果等,密集果三去二,留下生长良好的果实,同一枝条上保持果距在15 cm左右,使最终叶果比达到45﹕1(对照约为30﹕1)。每株树在东、西、南、北、中不同方向分别选择3个果实,总共15个果实挂牌标记。分别于7月20日、8月3日、8月17日、9月1日、9月14日、9月31日、10月16日、11月3日(对应盛花期后87、101、115、130、143、159、175和193 d)测量挂牌果实的纵横径。同时,在每个时间点,每株树采6个果实带回实验室拍照,并测量果实单果重(除去盛花期后87 d)。每果用刀切成两半后,呈三角取三瓣的汁胞于液氮中研磨成细粉于-80℃留样保存,用于测量可溶性糖和柠檬酸含量及分析糖酸代谢相关酶活性和基因表达量。
1.2 果实品质的测定
使用数显游标卡尺测量果实大小;使用百分之一电子天平称量果实重量。
1.3 果实糖酸含量测定
葡萄糖:称取约0.1 g组织,加入1 mL蒸馏水,研磨成匀浆,95℃水浴10 min(盖紧,防止水分散失),冷却后,8 000×,25℃离心10 min,取上清液备用。
果糖、蔗糖:称取约0.1 g组织,加入1 mL提取液,研磨成匀浆,80℃水浴10 min(盖紧,防止水分散失),振荡3—5次,冷却后4 000×,25℃离心10 min,取上清;加入约2 mg活性炭,80℃脱色30 min(盖紧,以防止水分散失);再加入1 mL提取液,4 000×,25℃离心10 min,取上清液测定。
柠檬酸:称取约0.1 g组织,加入1 mL提取液,冰浴匀浆。11 000×,4℃离心10 min,取上清液置冰上待测。
分光光度法测定,试剂盒来自苏州科铭生物技术有限公司,详细操作见说明书,每个样本3次重复。
1.4 果实酶活性测定
分光光度法测定,试剂盒来自苏州科铭生物技术有限公司,选择盛花期后101、130、159和193 d四个时期的样本测定可溶性酸性转化酶(S-AI)、蔗糖合成酶(合成方向SSⅡ和分解方向SSⅠ)、蔗糖磷酸合成酶(SPS)、磷酸烯醇式丙酮酸羧化酶(PEPC)、柠檬酸合成酶(CS)、胞质顺乌头酸酶(Cyt-ACO)、胞质异柠檬酸脱氢酶(ICDH)、ATP-柠檬酸裂解酶(ACL)、谷氨酸脱羧酶(GAD)和谷氨酰胺合成酶(GS)的活性,操作见说明书,每个样本3次重复。
1.5 总RNA提取及荧光定量PCR
用PLANT pure植物总RNA快速提取试剂盒(TaKaRa公司)提取植物总RNA。利用诺唯赞反转录试剂盒合成cDNA,然后使用Nanodrop 1000紫外分光光度计(Thermo Scientific)测定浓度,稀释到200 ng·μL-1后用于基因表达分析。利用诺唯赞qPCR试剂盒和Applied Biosystems Quant Studio 7 Flex Real-Time PCR System(ABI,USA)进行荧光定量PCR。反应体系共10 μL,反应程序为95℃预变性5 min,95℃变性10 s,60℃退火15 s,60℃延伸15 s,40个循环[21]。蔗糖代谢相关基因的qPCR引物见表1。柠檬酸代谢相关基因的qPCR引物参考Guo等[22]。
1.6 数据处理
运用Excel 2019软件对试验结果进行整理分析,并绘制图表,并用SPSS 16.0进行差异显著性及相关性分析。

表1 实时定量PCR引物
2 结果
2.1 疏果对‘爱媛28’果实品质的影响
果实的大小会随着细胞的分裂分化而逐渐增大。如图1所示,随着果实的发育,‘爱媛28’果实的纵横径和单果重都逐渐上升;且花后159 d,疏果的果实纵横径和单果重显著大于对照,与对照相比,疏果组的横径、纵径和单果重分别增加了5.97%、13.45%和16.61%。果实在159 d转黄,在193 d变为红色。
2.2 疏果对‘爱媛28’果实糖酸含量的影响
果实可溶性糖含量和组成与甜度密切相关,是柑橘果实品质的决定因素之一,会随着果实的发育成熟而逐渐上升。根据图2,随着果实的发育,可溶性糖含量总体呈上升的趋势。在‘爱媛28’果实成熟期,蔗糖含量最高。其中,疏果果实的蔗糖含量在101、130、175和193 d显著高于对照,而159 d显著低于对照;疏果果实的葡萄糖含量在101、130、159和193 d显著高于对照。两处理间果糖含量无显著差异。除了可溶性糖,果实有机酸也是决定果实品质的关键因素之一。柠檬酸是柑橘果实含量最多的有机酸。柑橘果实有机酸含量的变化主要与柠檬酸含量的变化有关。本试验发现,果实柠檬酸含量随果实发育而逐渐下降,且疏果果实的柠檬酸含量显著低于对照,但在成熟期没有显著差异(图2-D)。因糖、酸含量主要在花后101、130、159和193 d存在显著差异,所以选择这4个时期的果实进行酶活性测定和基因表达分析。
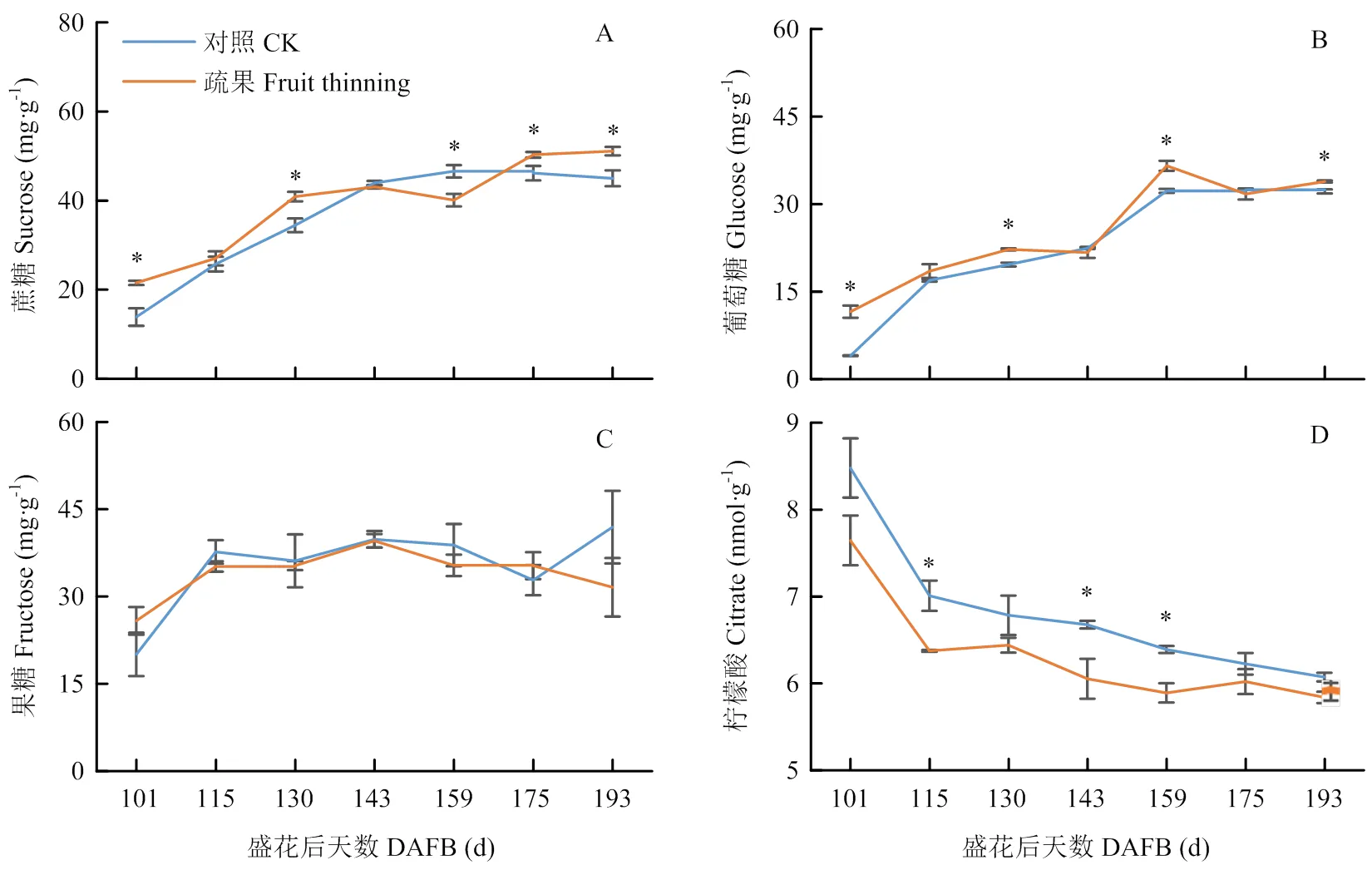
图2 疏果对果实蔗糖(A)、葡萄糖(B)、果糖(C)和柠檬酸(D)含量的影响
2.3 疏果对‘爱媛28’果实蔗糖代谢相关酶的影响
果实可溶性糖含量与蔗糖代谢过程密切相关。参与蔗糖代谢的酶主要有转化酶、蔗糖合成酶和蔗糖磷酸合成酶。转化酶S-AI参与了蔗糖的分解,活性在130 d达到最高,随后迅速下降,在成熟期略有上升,且所有时期均无显著差异。蔗糖合成酶有合成(SSⅡ)和分解(SSⅠ)两种,两者互为可逆反应。结果表明,SSⅠ和SSⅡ活性都随着果实的发育逐渐上升,但成熟期SSⅠ活性下降,且疏果显著增强二者的活性。蔗糖磷酸合成酶(SPS)是蔗糖合成的关键酶,活性也随着果实发育逐渐升高,且疏果显著增强SPS活性(图3)。

图3 疏果对果实S-AI(A)、SS I(B)、SS II(C)和SPS(D)活性的影响
2.4 疏果对‘爱媛28’果实柠檬酸代谢相关酶的影响
柠檬酸代谢过程分为合成和分解两个部分。合成过程发生在线粒体中,分解过程于细胞质中完成。合成过程中,随着果实的发育,PEPC的活性逐渐降低,且两处理间无显著差异(图4-A),CS活性逐渐降低,且除了在130 d疏果组的活性显著低于对照外,其他时期两处理间无显著差异(图4-B)。分解过程中,ICDH的活性随果实的发育逐渐上升,但在成熟期有所下降,且疏果显著增强ICDH活性(图4-C)。Cyt-ACO的活性也逐渐上升,并且疏果的果实在果实膨大期活性显著高于对照(图4-D)。GAD和ACL的活性均随果实的发育而逐渐降低,并且两处理间无显著性差异(图4-E和4-G)。GS的活性于130 d降至最低,而后逐渐上升,且在130 d后,疏果的果实活性显著高于对照(图4-F)。
2.5 疏果对‘爱媛28’果实蔗糖代谢相关基因表达的影响
在4个蔗糖合成酶基因中,疏果显著促进在130 d的表达量,增强在101 d和130 d的表达量,诱导在130 d的表达量,但降低在101 d与159 d的表达量,对的表达量无显著影响。蔗糖磷酸合成酶基因中,的表达量均随果实的发育而逐渐上升,且疏果显著促进的表达量。转化酶基因中,疏果组液泡转化酶基因的表达量在159 d最低,且与对照无显著差异,但显著诱导其他时期的表达。胞浆转化酶基因的表达量无显著变化(图5)。
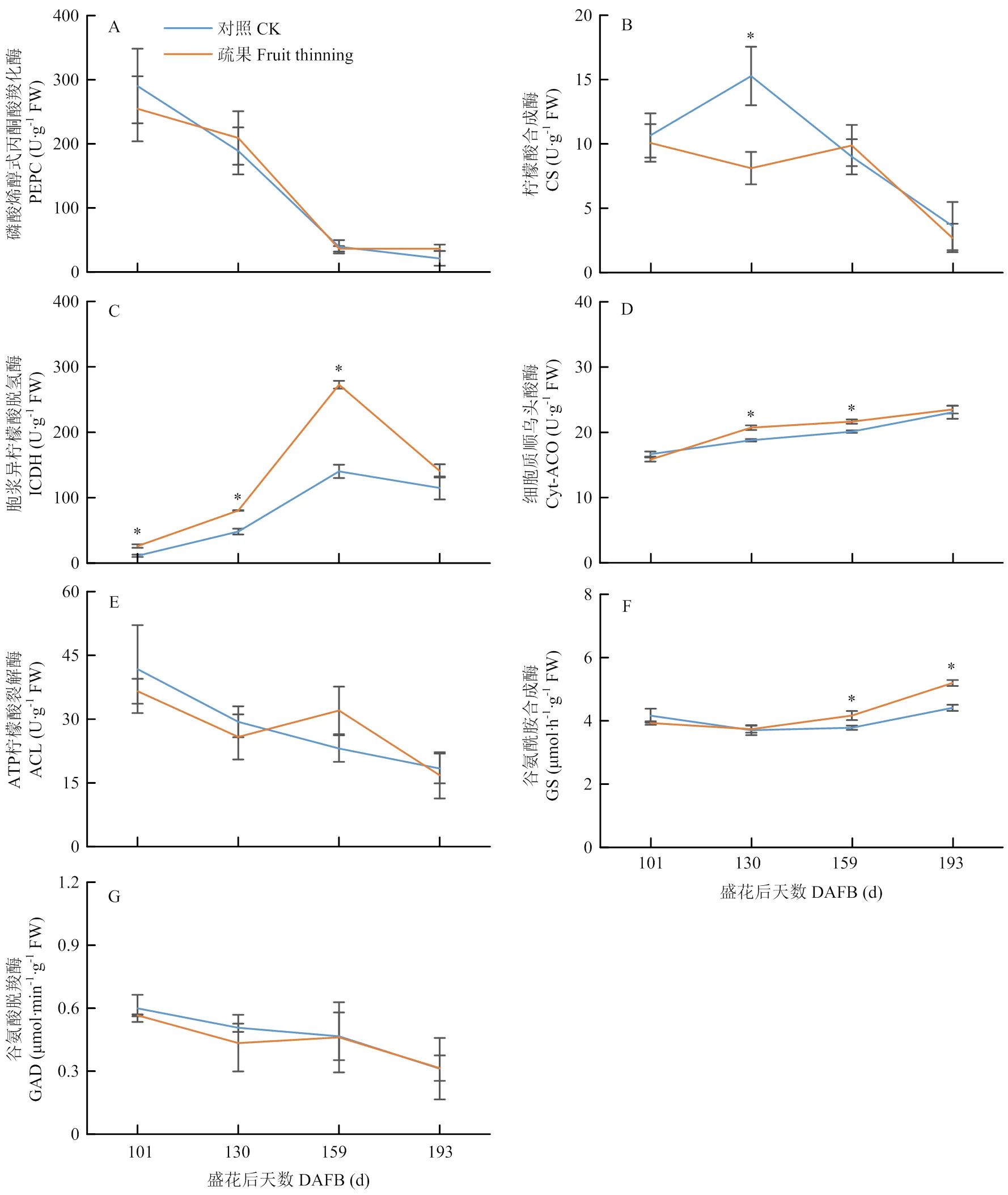
图4 疏果对果实PEPC(A)、CS(B)、ICDH(C)、Cyt-ACO(D)、ACL(E)、GS(F)和GAD(G)活性的影响
2.6 疏果对‘爱媛28’果实柠檬酸合成相关基因表达的影响
在柠檬酸合成相关基因中,疏果并未影响的表达量,但显著增加和在101 d和130 d的表达量。的表达量在101 d时显著低于对照,在130 d显著高于对照;的表达量在101 d和193 d显著低于对照,而在130 d时显著高于对照(图6)。
2.7 疏果对‘爱媛28’果实柠檬酸降解相关基因表达的影响
柠檬酸分解基因中,疏果不影响的表达水平,但显著增加在130 d和在101 d的表达量,显著降低在101 d和在193 d的表达量。的表达量随果实发育逐渐升高,且在101 d疏果组的表达量显著高于对照;疏果显著增加在130 d的表达量,但显著降低其在101 d的表达量;疏果不影响的表达量。ATP-柠檬酸裂解酶基因中,疏果显著增加在130 d和159 d的表达量;疏果组的表达量在101 d显著低于对照,而在130 d显著高于对照;的表达量渐渐提高,且130 d和159 d疏果组的表达量显著高于对照。谷氨酰胺合成酶基因中,疏果显著增加在101 d和130 d的表达量。谷氨酸脱羧酶基因中,疏果显著增加在101 d和130 d的表达量;的表达量随果实发育逐渐升高,且所有时期疏果组的表达量显著低于对照(图7)。
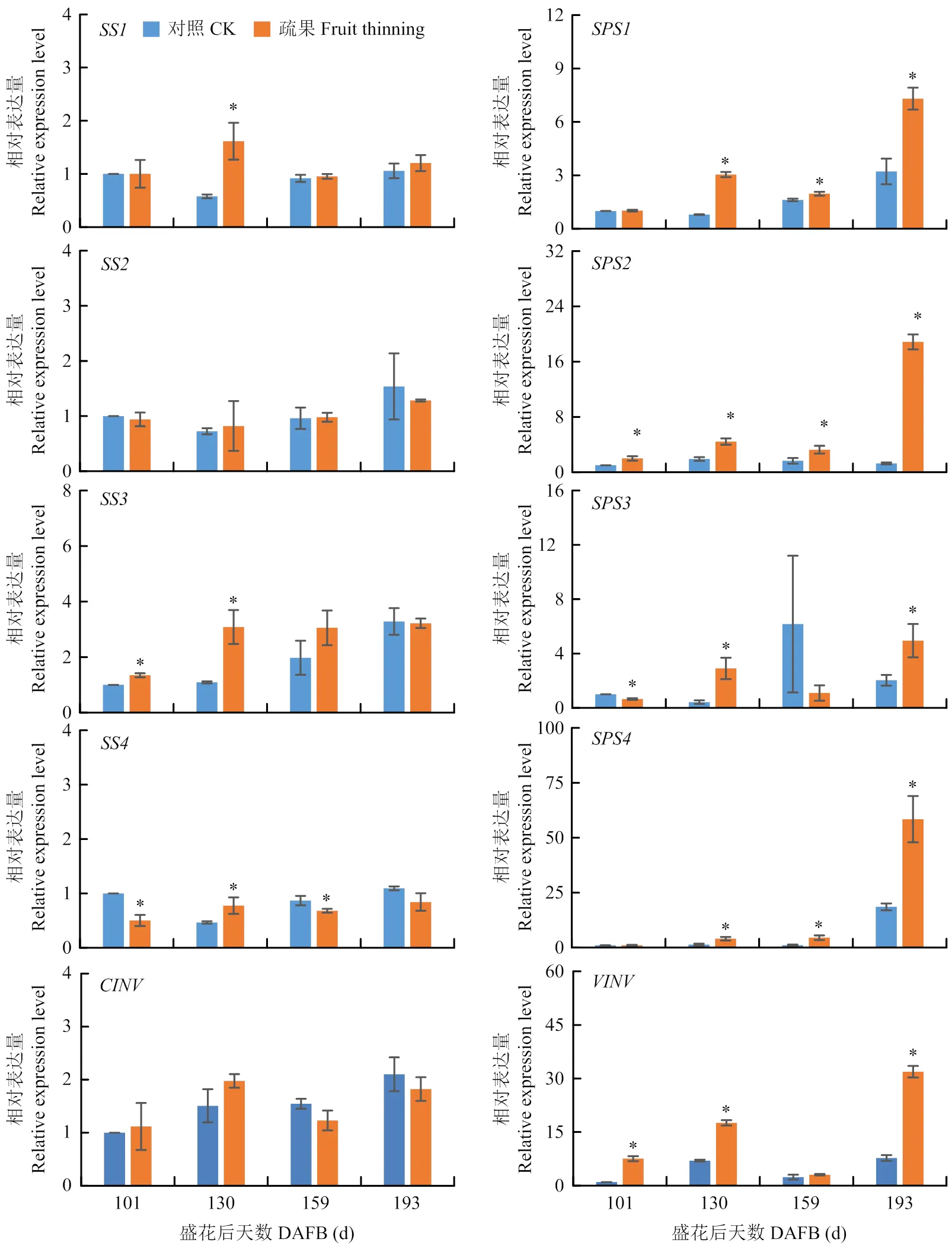
图5 疏果对果实蔗糖代谢相关基因SSs、SPSs和VINV表达的影响
<
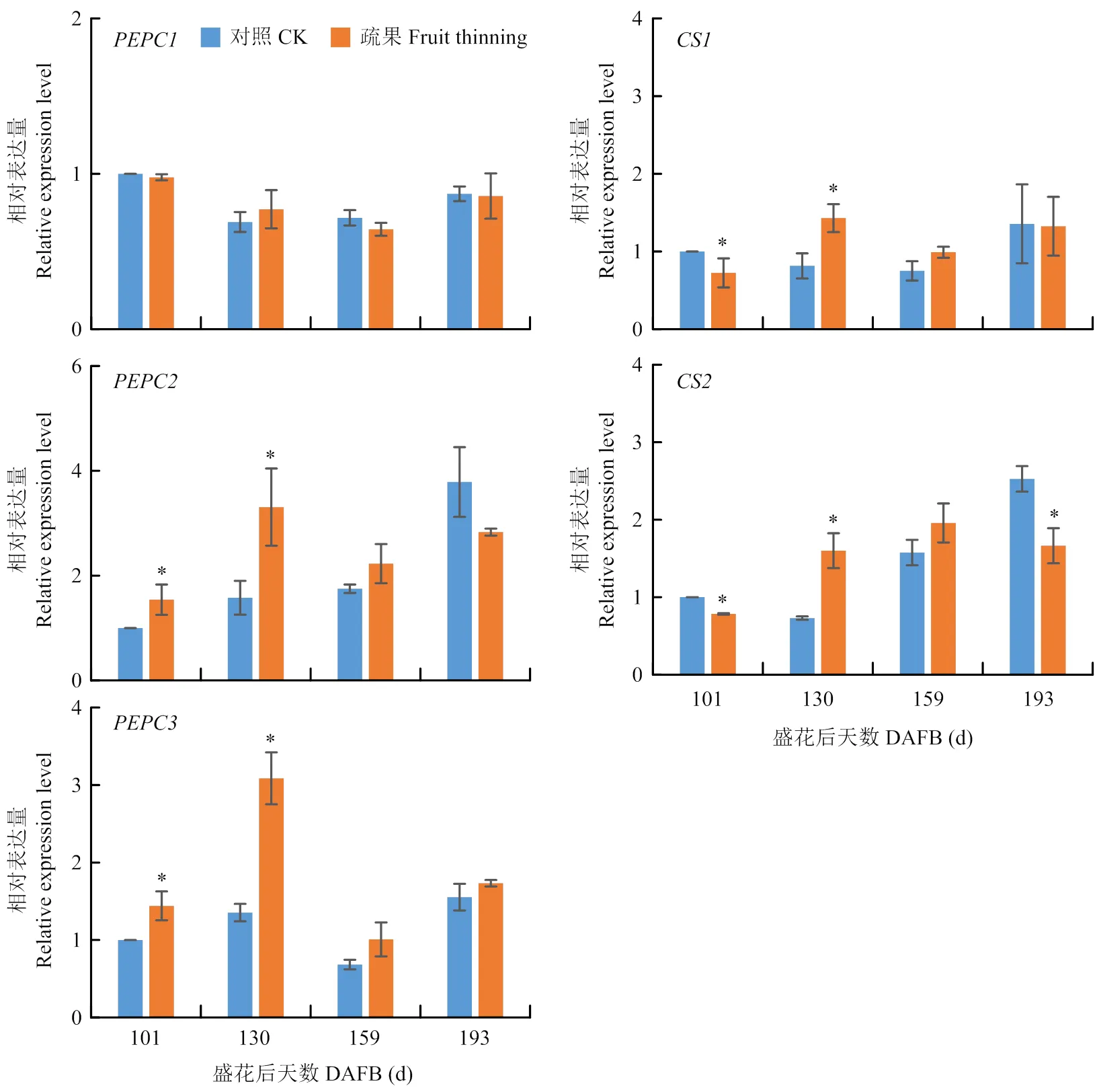
图6 疏果对果实柠檬酸合成相关基因和表达的影响
Fig. 6 Effects of fruit thinning on the expression ofandrelated to citric acid synthesis
2.8 相关性分析
糖代谢中,对照组蔗糖含量与S-AI、SPS、SS I和SS II的活性都呈正相关,但均未表现出显著的相关性;疏果后蔗糖含量与SPS的活性表现出极显著的正相关性,与SS II的活性表现出显著正相关,与SS I的活性并未表现出相关性。酸代谢中,对照组柠檬酸含量与CS、ACL、GAD和PEPC的活性都呈正相关,与GS无相关性,与ACO和NADP-IDH的活性表现出负相关,且其中只有ACL的活性与柠檬酸含量存在极显著相关性;疏果显著增加了柠檬酸含量与ACO活性的相关性,但显著降低了与ACL活性的相关性,且与GS的活性呈负相关(表2)。
糖代谢基因中,蔗糖含量与对照组、和呈正相关,且均无显著相关性,与无相关性;疏果增加了蔗糖含量与、和的相关性,且其中与达到显著正相关。柠檬酸合成基因中,柠檬酸含量与对照组呈正相关,而与和呈负相关,但均未表现出显著的相关性;柠檬酸分解基因中,柠檬酸水平与呈正相关,与、、、和均呈负相关,但其中只有表现出极显著负相关。疏果后,柠檬酸含量与无相关性,而与的相关性增加,且与呈现出显著的负相关,与表现出正相关,且与的相关性显著降低,但和表现出极显著负相关(表3)。
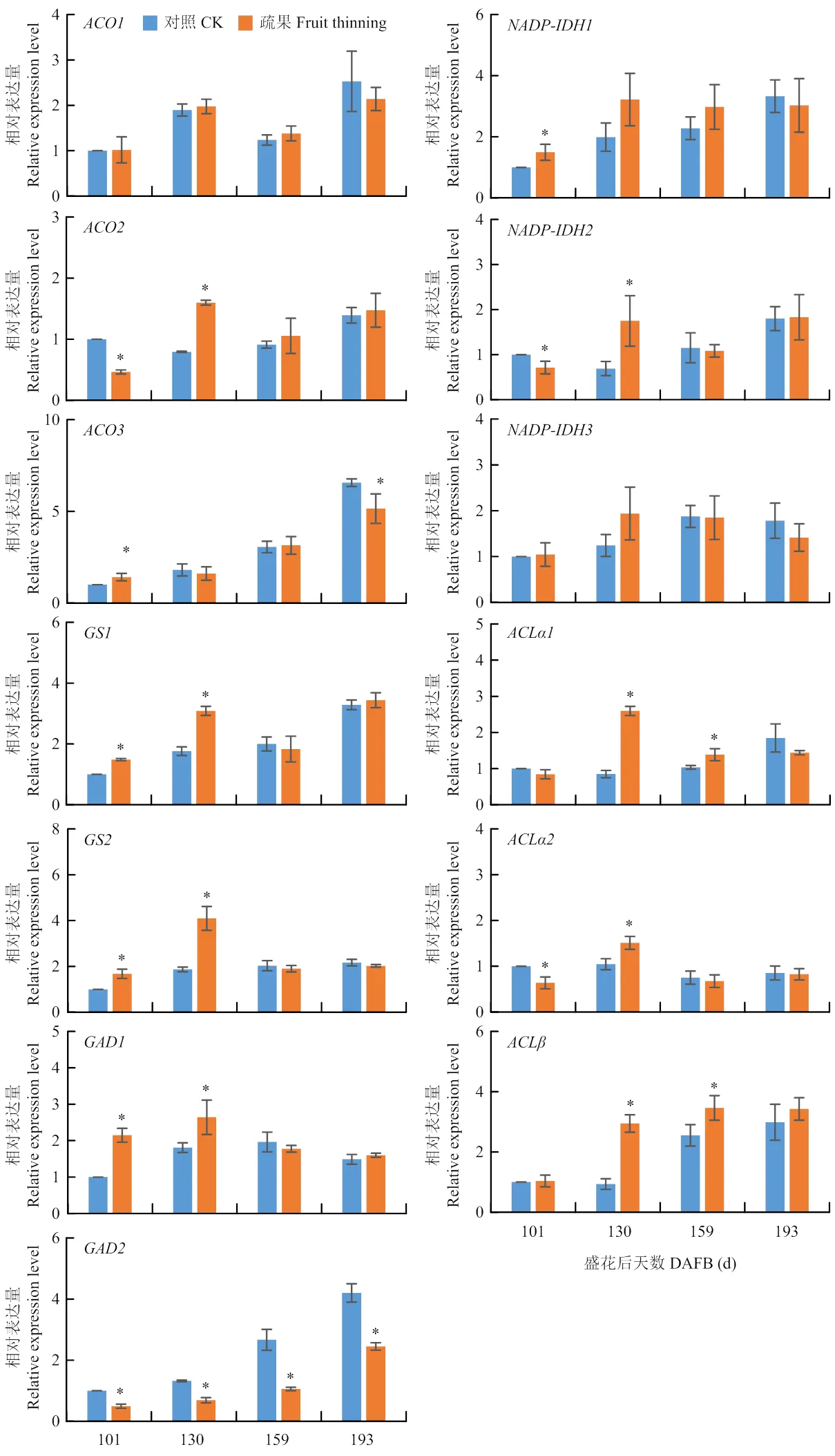
图7 疏果对果实柠檬酸降解相关基因ACOs、NADP-IDHs、ACLs、GSs和GADs表达的影响

表2 疏果对蔗糖和柠檬酸含量与其对应代谢相关酶相关系数的影响
*和**分别表示显著相关和极显著相关。下同
*: Correlation is significant at 0.05 level; **: Correlation is significant at 0.01 level. The same as below
3 讨论
3.1 疏果显著提高果实大小和可溶性糖含量
疏果通过降低营养竞争来促进果实的膨大。与吴黎明等[23]结果一致,本研究发现疏果显著增加柑橘果实纵横径和单果重。糖酸含量是影响柑橘果实内在品质和风味的重要因素。本研究发现,随着果实的发育,可溶性糖含量总体呈上升趋势,并且成熟期时蔗糖含量最高,但低于果糖和葡萄糖含量之和,这与林媚和吴韶辉[24]的研究结果一致,说明‘爱媛28’主要积累还原糖。此外,疏果显著增加蔗糖和葡萄糖含量,这与秦伟等[25]发现重度疏果的‘红富士’苹果糖含量在成熟期均高于对照的结果相一致,说明疏果确实能促进柑橘果实可溶性糖含量的积累。此外,随着果实的发育,柠檬酸含量逐渐减少,这与Li等[26]发现柑橘果实柠檬酸含量先上升后减少的变化不完全一致,可能原因是第一次采样前柠檬酸含量就已经到达最高值或者最高值处于第一、二次采样之间。并且,疏果虽然显著加快了柠檬酸的减少速度,但成熟期的含量与对照相比无显著差异,说明疏果只影响柠檬酸含量的减少速度,但不影响其最终的含量,这与吴黎明等[23]发现疏果不影响桃叶橙果实酸含量的结果一致。
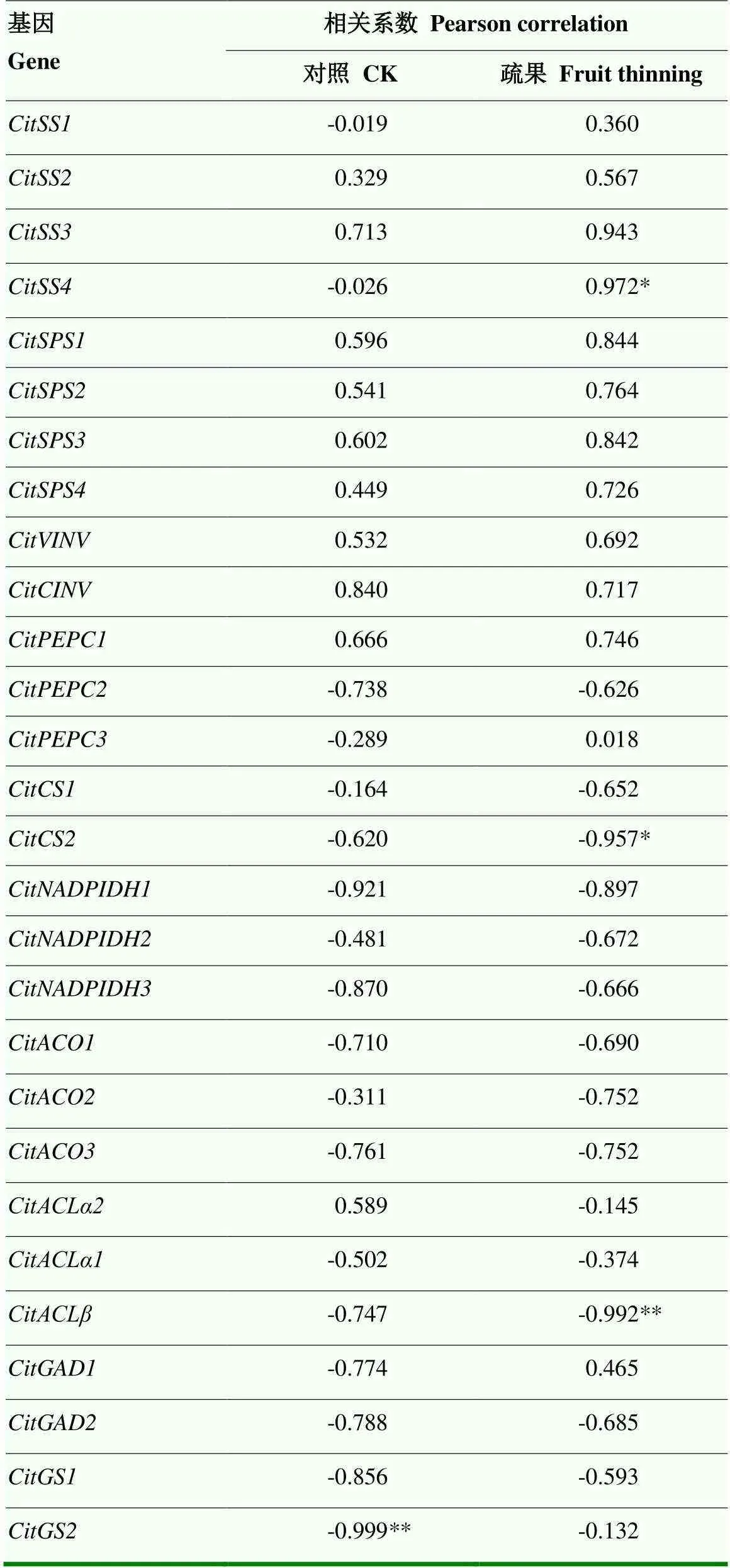
表3 疏果对蔗糖和柠檬酸含量与其对应代谢相关基因相关系数的影响
3.2 疏果调控果实蔗糖代谢
果实糖代谢需要一些酶的参与,如INV、SS和SPS等。INV可以将蔗糖转化为果糖与葡萄糖。本研究发现,S-AI的活性在130 d达到最高,表明其主要在果实膨大期发挥作用。但疏果并未影响其活性,说明其不是造成疏果果实葡萄糖含量显著增加的原因。对的表达水平进行分析,发现其变化趋势与其活性相似,且疏果显著增加其表达量,这与龚荣高和张光伦[27]发现酸性转化酶不是蔗糖积累关键原因的结论一致。除了转化酶外,SS也拥有分解蔗糖的作用。本研究发现,随着果实的发育,SS I的活性逐渐升高,且疏果显著增强其活性,这可能是疏果的果实葡萄糖含量显著高于对照的原因。SS II的活性也随着果实的发育而逐渐上升,并且疏果显著增加其活性以及与蔗糖含量的相关性,这与Kubo等[28]发现负载量低温州蜜柑果实SSⅡ的活性明显高于对照的结果相一致。分析表达变化,发现疏果显著增强果实膨大期的表达量,且其与蔗糖的相关系数达到0.943,说明可能参与了蔗糖的积累。SPS与蔗糖的生成有关,其活性越强,蔗糖含量往往也越高。本研究中,随果实的发育,SPS的活性渐渐上升,蔗糖含量也逐渐升高,并且疏果显著增强其活性,这与疏果的果实蔗糖含量显著高于对照相一致。疏果显著提高的表达量,说明疏果通过促进的表达来增强其活性,从而利于蔗糖的积累。
3.3 疏果调控果实柠檬酸代谢
果实柠檬酸是由PEPC和CS在线粒体内催化合成而来。本研究发现,随着果实的发育,PEPC的活性逐渐降低,这与柠檬酸的变化趋势相一致,说明PEPC的活性与柠檬酸的含量相关,这与张长明[29]的结果一致。但是疏果并未影响其活性。分析其编码基因,发现疏果显著增加了在果实膨大期的表达量,这与疏果果实柠檬酸含量显著低于对照的结果不相符,说明PEPC不是果实柠檬酸积累的关键酶,这与文涛等[30]的结果一致。疏果对CS活性影响不大,在130 d时对照酶活显著高于对照,但和表达量则表现出相反趋势,可能和并不是决定CS活性的关键基因,并且和与柠檬酸含量表现出负相关性(表3),这与其参与柠檬酸的合成相矛盾,说明CS不是果实柠檬酸积累的关键酶。
随着柠檬酸含量的下降,Cyt-ACO的活性逐渐升高,说明Cyt-ACO与柠檬酸的降解相关,这与Guo等[13]的发现一致。且疏果显著提高了其活性,这与疏果的果实TA和柠檬酸含量显著低于对照相一致。对其基因表达进行分析,发现疏果显著增加了在果实膨大期的表达量,其中的表达趋势与其活性变化几乎一致,且与柠檬酸含量的负相关性最高,说明主要是在柠檬酸降解中起着重要作用。此外,ICDH的活性与柠檬酸的相关性达到-0.860,说明其参与了柠檬酸的降解,且疏果显著增加了其活性。疏果也增强了在果实膨大期的表达,说明疏果通过促进的表达来提高其活性,从而加快柠檬酸的降解。进一步分析柠檬酸降解途径发现,疏果对乙酰辅酶A途径的ACL活性没有显著影响,但显著增加的表达;疏果也未影响-氨基丁酸途径的GAD活性,但显著促进的表达,降低的表达;疏果显著增加了谷氨酰胺途径中的GS的活性,且显著促进的表达,说明疏果通过影响谷氨酰胺途径来影响柠檬酸的降解,这与Feng等[15]发现GS可能在柠檬酸降解过程中发挥重要作用的结果一致。
4 结论
研究结果证明疏果能够有效增加‘爱媛28’果实的大小与质量,通过增强蔗糖代谢过程中的SS和SPS的活性及柠檬酸代谢过程中的Cyt-ACO、ICDH和GS的活性以及对应编码基因的表达,从而增加果实可溶性糖含量和加快柠檬酸的降解速度。
[1] 陈仕俏, 赵文红, 白卫东. 我国柑橘的发展现状与展望. 农产品加工(学刊), 2008(3): 21-24, 32.
CHEN S Q, ZHAO W H, BAI W D. The current situation and prospect of the development ofin China. Academic Periodical of Farm Products Processing, 2008(3): 21-24, 32. (in Chinese)
[2] 吴晓红, 陈宝宏, 李小华. 柑橘类水果中总酸与总糖的测定. 食品研究与开发, 2012, 33(9): 144-146.
WU X H, CHEN B H, LI X H. Determination of total acids and total sugar infruits. Food Research and Development, 2012, 33(9): 144-146. (in Chinese)
[3] 卢美英, 卢红, 卢日林, 潘朝邦, 徐炯志, 黄桂香, 欧世金, 薛进军, 陈香玲, 黄永敬, 何全光. 龙眼疏果方法研究. 广西农业生物科学, 2003, 22(1): 21-24, 31.
LU M Y, LU H, LU R L, PAN C B, XU J Z, HUANG G X, OU S J, XUE J J, CHEN X L, HUANG Y J, HE Q G. A study of the method of longan fruit panicle thinning. Journal of Guangxi Agricultural and Biological Science, 2003, 22(1): 21-24, 31. (in Chinese)
[4] CANO-LAMADRID M, GALINDO A, COLLADO-GONZÁLEZ J, RODRÍGUEZ P, CRUZ Z N, LEGUA P, BURLÓ F, MORALES D, CARBONELL-BARRACHINA Á A, HERNÁNDEZ F. Influence of deficit irrigation and crop load on the yield and fruit quality in wonderful and mollar de Elche pomegranates. Journal of the Science of Food and Agriculture, 2018, 98(8): 3098-3108. doi: 10.1002/jsfa. 8810.
[5] 李创, 张伟, 陈代全, 马松明, 马辉, 秦燕, 刘军. 不同疏果处理对中国樱桃果实品质的影响. 南方农业, 2020, 14(25): 28-30.
LI C, ZHANG W, CHEN D Q, MA S M, MA H, QIN Y, LIU J. Effects of different fruit thinning treatments on fruit quality of Chinese cherry. South China Agriculture, 2020, 14(25): 28-30. (in Chinese)
[6] 顾建芹. 暗柳橙及其突变体红暗柳橙果实发育过程中糖酸组分的变化[D]. 武汉: 华中农业大学, 2007.
GU J Q. Changing of sugar and acid contents of Anliu sweet orange and its mutant red Anliu sweet orange during fruit development [D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[7] 白蓓蓓, 王佳, 叶秀旭, 刘咲頔, 陈华蕊, 陈业渊. 杧果成熟过程中果肉可溶性糖组分分析. 分子植物育种, 2020, 18(13): 4457-4463.
BAI B B, WANG J, YE X X, LIU X D, CHEN H R, CHEN Y Y. Analysis of soluble sugar components in mango flesh during ripening. Molecular Plant Breeding, 2020, 18(13): 4457-4463. (in Chinese)
[8] 房经贵, 朱旭东, 贾海锋,王晨.植物蔗糖合酶生理功能研究进展.南京农业大学学报, 2017, 40(5): 759-768.
Fang J G, Zhu X D, Jia H F, Wang C. Research progress on physiological function of plant sucrose synthase. Journal of Nanjing Agricultural University, 2017, 40(5): 759-768. (in Chinese)
[9] 刘翔宇, 李娟, 黄敏, 梁春辉, 陈杰忠. 柑橘砧木对砂糖橘果实糖积累的影响. 中国农业科学, 2015, 48(11): 2217-2228.
LIU X Y, LI J, HUANG M, LIANG C H, CHEN J Z. Research on influences of rootstock on sugar accumulation in ‘Shatangju’ tangerine fruits. Scientia Agricultura Sinica, 2015, 48(11): 2217-2228. (in Chinese)
[10] Li Y Y, Yao Y, Yang G S, Tang J, Ayala G J, Li X M, Zhang W L, Han Q Y, Yang T, Wang H, Mayo K H, Su J Y. Co-crystal structure ofsucrose phosphate synthase with UDP and sucrose-6-phosphate provides insight into its mechanism of action involving an oxocarbenium ion and the glycosidic bond. Front Microbiology, 2020, 11: 1050.
[11] 魏清江, 马张正, 勒思, 雷常玉, 马巧利, 辜青青. 柑橘磷酸蔗糖合酶基因CsSPS的鉴定和表达. 园艺学报, 2020, 47(2): 334-344.
WEI Q J, MA Z Z, LE S, LEI C Y, MA Q L, GU Q Q. Identification and expression analysis of sucrose-phosphate synthase(SPS) genes in. Acta Horticulturae Sinica, 2020, 47(2): 334-344. (in Chinese)
[12] 欧金梅, 杨许, 单春苗, 张声祥, 施圆圆, 吴家文, 黄璐琦, 王瑞. 榔梅果实转录组分析及其柠檬酸生物合成途径关键酶基因结构与功能预测. 中国中药杂志, 2020, 45(19): 4606-4616. doi: 10.19540/ j.cnki.cjcmm.20200627.102.
OU J M, YANG X, SHAN C M, ZHANG S X, SHI Y Y, WU J W, HUANG L Q, WANG R. Transcriptome analysis of ‘Langmei’ fruits and key enzyme genes structure and function prediction involved in citric acid biosynthesis. China Journal of Chinese Materia Medica, 2020, 45(19): 4606-4616. doi: 10.19540/j.cnki.cjcmm.20200627.102. (in Chinese)
[13] Guo L X, Liu Y Z, Luo L J, Hussain S B, Bai Y X, Alam S M. Comparative metabolites and citric acid-degrading enzymes activities in citrus fruits reveal the role of balance between ACL and Cyt-ACO in metabolite conversions. Plants, 2020, 9(3): 350.
[14] LI S J, YIN X R, WANG W L, LIU X F, ZHANG B, CHEN K S.CitNAC62 cooperates withCitWRKYto participate in citric acid degradation via up-regulation of. Journal of Experimental Botany, 2017, 68(13): 3419-3426. doi: 10.1093/jxb/ erx187.
[15] FENG C, CHEN M, XU C J, BAI L, YIN X R, LI X, ALLAN A C, FERGUSON I B, CHEN K S. Transcriptomic analysis of Chinese bayberry () fruit development and ripening using RNA-Seq. BMC Genomics, 2012, 13: 19. doi: 10.1186/1471-2164- 13-19.
[16] LI S J, WANG W L, MA Y C, LIU S C, GRIERSON D, YIN X R, CHEN K S. CitrusCitERFcontributes to citric acid degradationupregulation of, encoding ATP-citrate lyase subunit Α. Journal of Agricultural and Food Chemistry, 2020, 68(37): 10081- 10087. doi: 10.1021/acs.jafc.0c03669.
[17] 王志静, 吴黎明, 何利刚, 宋放, 蒋迎春. 湖北柑橘主产区主要病虫害种类及发生期调查. 湖北农业科学, 2019, 58(S2): 295-297.
Wang Z j, Wu l m, He L g, Song F, Jiang Y c. Investigation on the species and occurrence period of major diseases and pests in the main citrus producing areas in Hubei. Hubei Agricultural Science, 2019, 58 (S2): 295-297. (in Chinese)
[18] 易青, 蔡永喜, 王血红. 湖北省宜都市柑橘产业现状与发展对策. 中国果树, 2009(6): 67-69.
YI Q, CAI Y X, WANG X H. Current situation and development countermeasures of citrus industry in Yidu city, Hubei province. China Fruits, 2009(6): 67-69. (in Chinese)
[19] 姜翔鹤, 杨波, 王登亮, 吴雪珍, 卢志成, 刘春荣. 预防杂柑品种红美人早衰栽培技术. 果树实用技术与信息, 2018(1): 29-32.
JIANG X H, YANG B, WANG D L, WU X Z, LU Z C, LIU C R. Cultivation techniques for preventing premature senescence of hybrid citrus varieties Hongmeiren. Practical Technology and Information of Fruit Trees, 2018(1): 29-32. (in Chinese)
[20] 马监生, 周志虎, 向进, 宋文化, 向舜德. ‘爱媛28’在秭归县的引种表现及栽培技术要点. 中国园艺文摘, 2017(4): 203-204.
MA J S, ZHOU Z H, XIANG J, SONG W H, XIANG S D. Introduction performance and cultivation techniques of ‘Ehime 28’ in Zigui county. Chinese Horticulture Abstracts, 2017(4): 203-204. (in Chinese)
[21] 邓晓东, 焦国柱, 刘聪, 韦同路, 郭大勇, 谢宗周, 刘继红. 亚精胺在椪柑果实留树保鲜中的作用及其对离层形成的影响. 园艺学报, 2018, 45(4): 669-677.
DENG X D, JIAO G Z, LIU C, WEI T L, GUO D Y, XIE Z Z, LIU J H. Role of exogenous spermidine in keeping on-tree ponkan fruits fresh and its effect on formation of abscission zone. Acta Horticulturae Sinica, 2018, 45(4): 669-677. (in Chinese)
[22] GUO L X, SHI C Y, LIU X, NING D Y, JING L F, YANG H, LIU Y Z. Citrate accumulation-related gene expression and/or enzyme activity analysis combined with metabolomics provide a novel insight for an orange mutant. Scientific Reports, 2016, 6: 29343. doi: 10.1038/ srep29343.
[23] 吴黎明, 蒋迎春, 何利刚, 王志静, 仝铸, 吴述勇, 廖胜才, 王菊平. 疏果对桃叶橙果实品质的影响及效益分析. 中国南方果树, 2015, 44(6): 34-34, 37.
WU L M, JIANG Y C, HE L G, WANG Z J, TONG Z, WU S Y, LIAO S C, WANG J P. Effect of fruit thinning on fruit quality and benefit analysis of ‘Taoye Cheng’. South China Fruits, 2015, 44(6): 34-34, 37. (in Chinese)
[24] 林媚, 吴韶辉. 浙江省12个柑橘品种果实品质分析与评价. 浙江农业科学, 2019, 60(6): 963-966.
LIN M, WU S H. Analysis and evaluation on fruit quality of 12 citrus varieties. Journal of Zhejiang Agricultural Sciences, 20199, 60(6): 963-966. (in Chinese)
[25] 秦伟, 刘立强, 司宏章, 杨新峰, 李建贵. 疏果摘叶对红富士苹果果实发育及其品质的影响. 新疆农业科学, 2015, 52(8): 1419-1431.
QIN W, LIU L Q, SI H Z, YANG X F, LI J G. Effects of fruit thinning and leaves priming on the fruit growth and qualities of red Fuji apple. Xinjiang Agricultural Sciences, 2015, 52(8): 1419-1431. (in Chinese)
[26] Li S J, Liu X J, Xie X L, Sun C D, Grierson D, Yin X R, Chen K S., a PH-like gene, contributes to citric acid accumulation in citrus fruit. Scientia Horticulturae, 2015, 197: 212-217.
[27] 龚荣高, 张光伦. 柑橘果实糖代谢的研究进展. 四川农业大学学报, 2003, 21(4): 343-346.
GONG R G, ZHANG G L. Advances in research on sugar metabolism infruit. Journal of Sichuan Agricultural University, 2003, 21(4): 343-346. (in Chinese)
[28] Kubo T, Hohjo I, Hiratsuka S. Sucrose accumulation and its related enzyme activities in the juice sacs of satsuma mandarin fruit from trees with different crop loads. Scientia Horticulturae, 2001, 91(3/4): 215-225.
[29] 张长明. 不同施肥处理对秭归脐橙土壤和叶片养分及柠檬酸代谢的影响[D]. 华中农业大学, 2013.
ZHANG C M. The effects of different fertilization treatments on the soil and leaf nutrients and the metabolism of citric acid of navel orange in Zigui[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[30] 文涛, 熊庆娥, 曾伟光, 刘远鹏. 脐橙果实有机酸代谢调控措施的初步研究. 四川农业大学学报, 2001, 19(2): 144-147.
WEN T, XIONG Q E, ZENG W G, LIU Y P. Study on the regulation of organic acid synthesize during fruit development of navel orange (sinesis osbeck). Journal of Sichuan Agricultural University, 2001, 19(2): 144-147. (in Chinese)
Effects of Artificial Fruit Thinning on Sugar and Acid Content and Expression of Metabolism-Related Genes in Fruit of Beni-Madonna Tangor
SONG JiangTao1, SHEN DanDan2, GONG XuChen1, SHANG XiangMing1, LI ChunLong1, CAI YongXi3, YUE JianPing3, WANG ShuaiLing3, ZHANG PuFen3, XIE ZongZhou1, LIU JiHong1
1Key Laboratory of Horticulture and Botany, Ministry of Education, Huazhong Agricultural University, Wuhan 430070;2Yichang Academy of Agricultural Sciences, Yichang 443000, Hubei;3Service and Extension Centre of Fruit Trees and Tea in Yidu City, Yidu 443300, Hubei
【Background】Beni-Madonna tangor (´), a hybrid cultivar of citrus, is favored by consumers because of its excellent quality. Fruit thinning is a technique commonly used to improve fruit quality in the process of agricultural production. It can not only significantly increase the fruit volume, but also increase the content of soluble solids in the fruit. However, the specific mechanism of fruit thinning to increase the content of soluble solids in the fruit of Beni-Madonna is still unclear. 【Objective】 In this study, four-year-old Beni-Madonna tangor plants, with trifoliate orange () as a base rootstock and Ponkan as an intermediate stock, were used as experimental materials to explore the specific mechanism of fruit thinning on affecting the change of sugar and acid content in fruit. 【Method】Fruit thinning was carried out at the young fruit stage of Beni-Madonna fruit. The horizontal and vertical stems of fruit thinning and non-fruit thinning were measured every half a month or so. The samples were taken back and the single fruit weight and sugar and acid content were measured. The activities of sugar and acid metabolism related enzymes and the relative expression of their corresponding coding genes were measured when the sugar and acid content were significantly different. 【Result】The fruit thinning significantly increased the horizontal and vertical stems and single fruit weight of Beni-Madonna fruit in the middle and late stages of fruit growth, significantly accelerated the degradation rate of citrate content, but did not affect the final citrate content at fruit maturity, significantly increased the fruit glucose and sucrose content, but had no significant effect on fructose content. The fruit thinning significantly increased the activities of sucrose synthase SSⅡ (synthesis direction), sucrose synthase SSⅠ (decomposition direction), sucrose phosphate synthase (SPS) in sucrose metabolism and cytosolic aconitase (Cyt-ACO), cytoplasmic isocitrate dehydrogenase (ICDH) and glutamine synthetase (GS) implicated in citric acid catabolism. In addition, fruit thinning significantly promoted the early relative expression ofand the relative expression ofs at all stages in the process of sucrose metabolism, and the relative expression of,,,ands in the process of citric acid metabolism in the early and middle stages. 【Conclusion】The artificial fruit thinning mainly promoted the accumulation of soluble sugar in fruit by enhancing the enzyme activity of sucrose phosphate synthase in the process of sucrose anabolism, improved the activity and gene expression level of related enzymes in the process of citric acid catabolism, and accelerated citric acid degradation, thus playing an important role in improving fruit quality.
fruit thinning; Beni-Madonna; fruit quality; sucrose metabolism; citric acid metabolism

10.3864/j.issn.0578-1752.2022.23.010
2022-02-28;
2022-06-15
国家重点研发计划(2019YFD1001402)、湖北省重点研发计划(2020BBA036,2022BBA0073)、湖北省农业创新行动计划
宋江涛,E-mail:912104398@qq.com。通信作者刘继红,E-mail:liujihong@mail.hzau.edu.cn
(责任编辑 赵伶俐)

