二花脸公猪不同耐冻性精子的蛋白质组学分析
童世锋,任智彬,林斐,葛雨竹,陶景丽,刘杨
二花脸公猪不同耐冻性精子的蛋白质组学分析

1南京农业大学动物科技学院动物遗传育种系,南京 210095;2江苏省常熟市牧工商有限公司,江苏常熟 215500
【目的】二花脸猪是我国优良的地方猪种之一,冷冻精液可提高二花脸公猪的利用率,并加强其种质资源保护,但目前生产的二花脸猪冷冻精液基本不能满足生产需要。研究通过分析二花脸公猪不同耐冻性精子的蛋白质组学,以促进二花脸公猪精子耐冻性蛋白质标志物的筛选,从遗传水平分析精子耐冻性的影响因素,为提高精子耐冻性提供参考依据。【方法】通过冻存14头二花脸种公猪的精液,再对冷冻精液的冻后质量进行分析,根据精子冻后活率和冻后活力的高低筛选出耐冻性好和差(good freezability ejaculates, GFE和poor freezability ejaculates, PFE)的公猪各3头,利用串联质谱标记(tandem mass tag, TMT)技术对GFE组和PFE组的精子蛋白进行定量蛋白质组学分析,鉴定出GFE组和PFE组精子中的差异蛋白(differentially abundant proteins, DAPs)。利用GO富集分析对差异蛋白的功能进行注释,利用 KEGG富集分析对差异蛋白的生物通路进行注释,通过STRING蛋白质互作数据库进行差异蛋白的互作网络分析并利用Cytoscape软件构建蛋白质-蛋白质相互作用(PPI)网络。【结果】研究发现GFE组和PFE组间共存在138个差异蛋白,PFE组与GFE组相比,有109个DAPs上调,29个DAPs下调。GO富集分析表明,共124个DAPs富集到47个GO term,主要富集到“细胞进程”“单有机体过程”“分子结合”“细胞”“细胞组分”等GO term。KEGG富集分析表明,DAPs主要富集到“肾素-血管紧张素系统”“补体和凝血级联”“血小板活化”等通路。从PPI网络可见53个节点和69 条连接边线,有8个具有强互作关系的蛋白ALB、ACRBP、ACR、ZAN、ZPBP2、HSPA5、FGB、FGG,这些蛋白质的功能主要富集于“单受精”“有性生殖”“精细胞发育”等与动物生殖生理以及精子发生密切相关的功能。进一步分析表明,GFE组和PFE组间的DAPs主要包括氧化还原相关蛋白(GSTM3、PRDX5、ALB、PDIA1、PDIA4等)、精子发生与功能相关蛋白(HSPA5、MFGE8、DNAH1、DNAH7、CUL3等)、能量相关蛋白(HK1、PGM1等)以及凋亡与炎症相关蛋白(THBS1、ELSPBP1、CP等);PPI网络图分析可知3个DAPs(MME、ANPEP和PRCP)在肾素-血管紧张素系统(RAS)中相互作用。【结论】二花脸公猪不同耐冻性精子的蛋白质组分存在明显差异,可能对精子的冷冻性能产生影响,这些DAPs可作为精子耐冻性的候选蛋白标志物。
二花脸公猪;精子耐冻性;TMT;差异蛋白
0 引言
【研究意义】二花脸猪是我国的著名优良地方猪种之一,其以高繁殖力闻名于世,经产母猪窝均总仔数高达15.93头,窝产活仔数可达14头以上,加强二花脸猪的保护和利用有利于我国猪业和种业的发展[1]。精液冷冻保存可以扩大二花脸公猪精液使用的时间和空间范围,能提高二花脸公猪的利用率,加快品种改良,更有利于种质资源保护[2]。但因猪的精子质膜结构组成(磷脂和胆固醇比例及磷脂和蛋白质比例)较其他物种的差异性,导致猪精子冷冻过程中对冷应激的敏感度更强,低温更易对猪精子造成不可逆的损伤,致使精子冻后活力低、受精率低[3]。因此,提高猪冷冻精液的冻后质量对二花脸公猪发挥其良种优势具有十分重要的意义。【前人研究进展】为了提高猪冻精的冻后质量,先前研究多集中在猪精液冷冻程序及冷冻稀释液的改良上,但近年来未取得突破性进展。早已有研究表明,精液的冻后质量存在个体差异[4]。因此,根据个体差异鉴定精子耐冻性的遗传标记,用于在冻前预测精子的耐冻性,为提高公猪冷冻精液的冻后质量提供了另一思路。近年来越来越多研究利用组学技术从不同水平分析不同耐冻性公猪精子的遗传差异,主要包括DNA水平[5]和RNA水平[6-7],这些遗传差异都会对精子的耐冻性产生不同程度的影响,是预测精子耐冻性的良好标志物。此外,在不同耐冻性的公猪精子中也发现了许多蛋白质差异,如 HSP90AA1[8]、AQP3、AQP7[9]、GSTM3[10]以及部分精子质膜蛋白[11]都被鉴定为预测精子耐冻性的蛋白质标志物。【本研究切入点】蛋白质组学技术能够更全面、更深入地分析蛋白质的特征,已在揭示动植物生命规律的研究中得到广泛应用[12-13]。但目前少有研究从蛋白质组学水平上系统分析不同耐冻性公猪精子的遗传差异。利用蛋白质组学技术研究公牛精子的蛋白质组分与精子冷冻性能的关系,表明不同耐冻性公牛精子中存在大量DAPs,这些DAPs与精子的冷冻性能相关联,且部分DAPs可作为预测精子耐冻性的标志物[14]。因此,利用蛋白质组学技术对不同耐冻性公猪精子的全蛋白质组分进行比较分析,筛选出关键差异蛋白,这对研究公猪精子蛋白质组与精子冷冻性能的相关关系具有十分重要的意义。【拟解决的关键问题】本研究拟首次利用TMT技术分析二花脸公猪不同耐冻性精子的蛋白质组学,从蛋白质水平分析不同耐冻性精子的遗传差异,为鉴定出预测精子耐冻性的蛋白质标志物提供科学依据,从遗传水平分析影响二花脸公猪精液冻后质量的关键因子。
1 材料与方法
试验于2020年9月至2021年8月在江苏省常熟市牧工商有限公司和南京农业大学动物实验中心完成。
1.1 试验材料
研究所用精液采自江苏省常熟市牧工商有限公司的14头二花脸种公猪,所有公猪在同一环境条件下饲养管理,均已达体成熟年龄。
1.2 精液的采集与检测
采用手握法对二花脸公猪进行精液采集,采集的精液与37℃预热的原精稀释剂按照1﹕1的体积比混匀,混匀后置于17℃恒温箱中在2 h内运回实验室。到达实验室后,对精子活力和畸形率进行检测,将活力大于75%,畸形率小于15%的精液用于后续试验。
1.3 精液的冻存与解冻
按照商业冻精生产试剂套装(北京田园奥瑞生物科技有限公司)的使用说明进行精液的冻存。精液用试剂盒处理完成后,灌装至0.5 mL冻精细管,随即放入程序冷冻仪(Ice Cube)中进行冷冻,冷冻程序见表1。最后将冻精细管放入液氮中冻存。
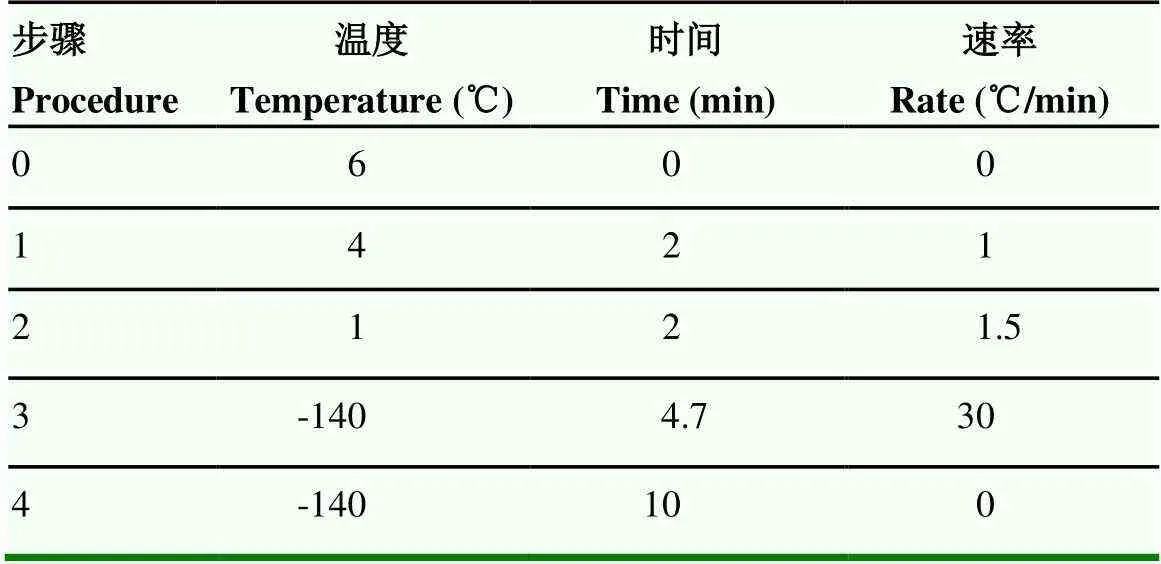
表 1 程序冷冻仪的(Ice Cube)0.5 mL细管冷冻程序
解冻时,将每个样本取3根细管在60℃解冻12 s,精液与解冻液按照1﹕9的体积比稀释,在30℃的条件下孵育20 min后,对精子的质量进行评估。
1.4 精液质量评估
通过计算机辅助精液分析(computer-assisted sperm analysis, CASA )系统对精子的运动特性进行测定,本研究中主要记录精子的活率(motility,MOT)和活力(progressive motility,PMOT)进行后续分析,选择冻后活率和活力最高和最低的3头公猪精液分别设置为GFE组和PFE组。精子质膜完整性(plasma membrane integrity,PMI)通过精子尾部低渗肿胀法(hypo-osmotic Swelling Test,HOST)进行检测[15]。按照线粒体膜电位检测试剂盒(JC-1;索莱宝生物科技有限公司)的使用说明对精子的线粒体膜电位(mitochondrial membrane potential,MMP)进行检测。
1.5 精子蛋白质组学分析
采用TMT定量蛋白质组学技术对精子蛋白质组学进行分析[16]。主要步骤为蛋白质的提取和酶解、TMT标记、高PH 反相分离、nano-HPLC-MS/MS分析,最后进行数据库搜索。本研究采用Ensembl数据库(Sus scrofa 11.1)进行搜索,肽段经过1% FDR和1 unique peptide质控过滤,筛选差异倍数1.2倍以上,FDR≤0.05的蛋白质作为DAPs。
1.6 生物信息学分析
通过GO数据库(http://www.geneontology.org/)对DAPs进行GO富集,通过KEGG数据库(Kanehisa,2008)对DAPs的生物通路(Pathway)进行注释,以FDR≤0.05为阈值,满足此条件的GO term/pathway定义为在DAPs中显著富集的GO term/pathway。利用STRING蛋白质互作数据库(http://string-db.org)进行DAPs的互作网络分析并利用Cytoscape软件构建互作关系网络图。
1.7 数据分析
统计分析主要采用SPSS Statistics 20软件进行独立样本t检验或单因素方差分析。<0.05被认为存在显著差异,结果用Mean±SEM表示。
2 结果
2.1 二花脸公猪精子耐冻性的个体差异
通过对14头公猪冷冻精液解冻后的活率和活力进行对比分析,选择冻后活率、活力最高和最低的3头分别设置为GFE组和PFE组。如图 1所示,GFE组和PFE组的冻前活率和活力不存在显著差异(>0.05),但GFE组的冻后活率和活力显著高于PFE组(<0.001)。此外,通过对解冻后精子的质膜完整性和线粒体膜电位进行对比分析,发现两者在GFE组和PFE组中均存在显著差异(<0.01),进一步证实GFE组和PFE组精子的冻后质量存在显著差异。
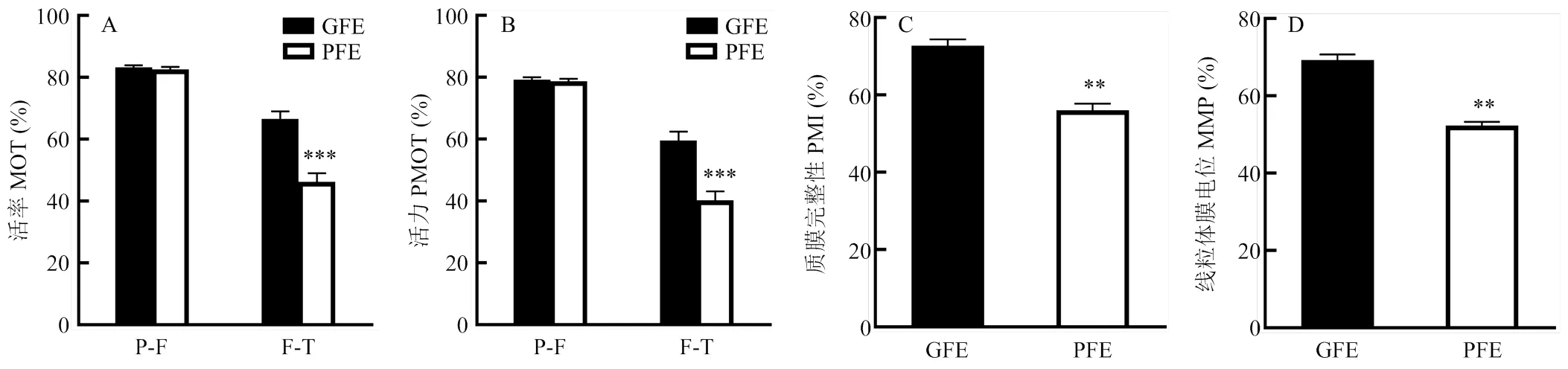
A:精子冻前活率(P-F MOT),冻后活率差异(F-T MOT);B:精子冻前活力(P-F PMOT),冻后活力(F-T PMOT)差异;C:精子冻后质膜完整性(PMI)差异;D:精子冻后线粒体膜电位(MMP)差异。数据以Mean±SEM表示(n=3),***代表p<0.001,**代表p<0.01
2.2 精子蛋白质的鉴定与分析
通过TMT蛋白质组学分析,对检测的肽段结果进行质控过滤,在GFE组和PFE组精子蛋白质中共鉴定出3 767种蛋白质(FDR≤1%,unique petide≥1, 图2-A)。基于GFE组和PFE组精子蛋白质表达量信息,进行主成分分析(principal component analysis, PCA),GFE组和PFE组蛋白质被分成两个不同的簇(图2-B),这表明两个比较组间蛋白质丰度存在差异。在鉴定出的蛋白质中,共筛选出138个DAPs(差异倍数≥1.2,FDR≤0.05),与GFE组相比,PFE组有109个DAPs显著上调,29个DAPs显著下调(图 2-C,D)。
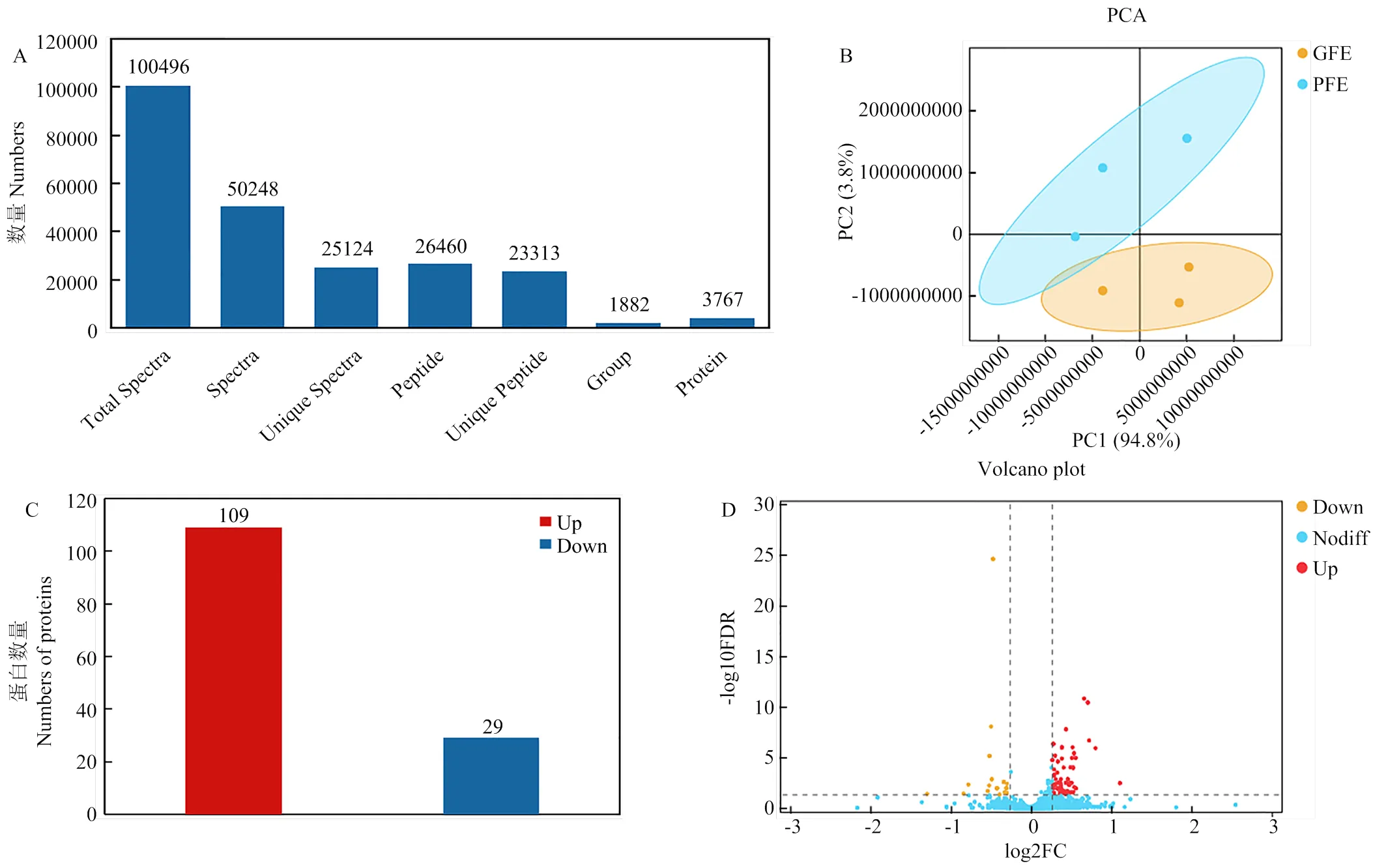
A:总蛋白及肽段鉴定结果;B:GFE组和PFE组PCA分析结果(橙点代表GFE,蓝点代表PFE);C和D:差异蛋白鉴定结果(C:红色柱子代表上调蛋白,蓝色柱子代表下调蛋白;D:红点代表上调蛋白,蓝点代表无差异蛋白,橙点代表下调蛋白)
2.3 DAPs的功能注释
通过对DAPs进行 GO富集分析,结果表明,共124个DAPs富集到47个GO term,在生物进程(BP)方面,主要富集到“cellular process” “single-organism process”“metabolic process”“biological regulation”“regulation of biological process”等 GO term;在分子功能(MF)方面,主要富集到“binding”“catalytic activity”等 GO term;在细胞成分(CC)方面,主要富集到“cell”“cell part”“organelle”“membrane”“extracellular region”等GO term。前20个GO term如图3-A。
通过对DAPs进行 KEGG富集分析,结果表明,DAPs主要富集到“Renin-angiotensin system” “Complement and coagulation cascades”“Platelet activation”等pathway(图3-B)。
2.4 DAPs的互作网络分析
通过对DAPs的string分析,并利用Cytoscape 7.1软件构建蛋白质-蛋白质相互作用网络(图 4-A),可以更加清晰的阐明DAPs之间的相互作用。PPI网络中共有53 nodes和69 edges。其中有8个具有强互作关系的蛋白ALB、ACRBP、ACR、ZAN、ZPBP2、HSPA5、FGB、FGG。此外,通过MCODE插件检测PPI网络中的重叠子网,发现4个主要的重叠子网。重叠子网(图4-B)中的蛋白质ACRBP、ELSPBP1、ZAN、ZPBP和ACR主要富集于single fertilization、sexual reproduction、spermatid development等与动物生殖生理以及精子发生密切相关的功能。其中一个重叠子网(图4-C)的FGA、FGB、FGG则富集于补体和凝血级联中相互作用,另一重叠子网(图4-D)的PRCP、ANPEP、MME在肾素-血管紧张素系统通路中相互作用。
3 讨论
鉴于二花脸猪的优良特性以及加强种业资源保护与利用等方面的需要,提高二花脸猪冷冻精液的质量具有十分重大的意义。不同耐冻性的猪精子间存在遗传差异,且无论从基因、转录本,还是蛋白质的角度,越来越多的精子耐冻性标志物被发现[5-11]。蛋白质作为生命活动的主要承担者,蛋白质的差异能够产生最直接的影响。因此,为筛选出影响二花脸公猪精子耐冻性的关键蛋白质,对不同耐冻性的精子蛋白质组进行了比较分析,结果共检测到3 767个蛋白质,其中138个DAPs符合筛选标准,相较于GFE组,109个DAPs在PFF组中表达上调,29个DAPs在PFF组中表达下调。
3.1 公猪精子耐冻性与氧化还原蛋白的相关性
研究结果中大量氧化还原蛋白在两组间表达差异显著。猪精液冷冻过程中发生的氧化还原反应容易引起精液中活性氧(ROS)的动态平衡被打破,且由于猪精子质膜上多不饱和脂肪酸的含量高于其他物种,导致猪精子质膜更容易受到ROS的攻击而引发氧化损伤[2,17]。因此冷冻过程中的氧化还原反应对精子的冻后质量具有重要影响。GSTM3是一种重要的抗氧化酶,参与细胞的保护使其免受氧化应激的损伤,提高精子的功能和受精能力。近期研究表明GSTs与哺乳动物精子线粒体功能、质膜稳定性密切相关,并维持精子内的ROS平衡,调节线粒体Ca2+的动态平衡,从而维持精子的活力[18]。与LLAVANERA等[10]的研究结果一致,GSTM3在低耐冻性的皮特兰公猪精子中表达显著上调,且GSTM3被认为可作为精子耐冻性的蛋白标志物。PRDX5也是一种细胞保护性抗氧化酶,和GSTM3一样在PFE组精子呈现高表达,PRDX5可抵御内源性或外源性过氧化物攻击,在精子中保护精子免受ROS诱导的氧化损伤,分析牛精清蛋白对精子冻后活力的影响也表明PRDX5与精子冻后活力呈负相关[19]。对于抗氧化蛋白在低耐冻性精子中高表达的原因,有推测说抗氧化蛋白过高表达是ROS释放增加的反应,过高的ROS水平对精子产生氧化损伤,又或说精子过高的抗氧化蛋白导致ROS浓度低于正常水平,而正常浓度的ROS是启动获能和顶体反应所必需的[19-20]。
此外,部分在GFE组高表达的抗氧化蛋白可以在精子的冷冻过程中发挥对精子的保护作用,正如先前的研究中表明,HSP90是一种普遍存在的分子伴侣,可抵抗细胞的氧化应激和凋亡,其在高耐冻性精子的表达显著高于低耐冻性精子,保护精子在冷冻过程中免受ROS的损伤[21]。在笔者的研究中也发现了大量相关蛋白(ALB、PDIA1、PDIA4等)。ALB具有抗氧化性,可以结合包括自由基在内的多种配体,保护精子免受脂质过氧化,其含量可以作为精子内的抗氧化指标,在研究公牛精子及精浆蛋白质的抗氧化性中被广泛论证[22]。PDI家族蛋白(PDIA1、PDIA4)作为内质网的氧化还原折叠催化剂,在内质网蛋白质折叠过程中催化硫醇氧化、还原或异构化,通过协调细胞内的氧化还原状态调节生理和病理效应[23]。综上所述,氧化还原相关蛋白在精子的冷冻过程中可能发挥重要作用,但其机制有待进一步研究。
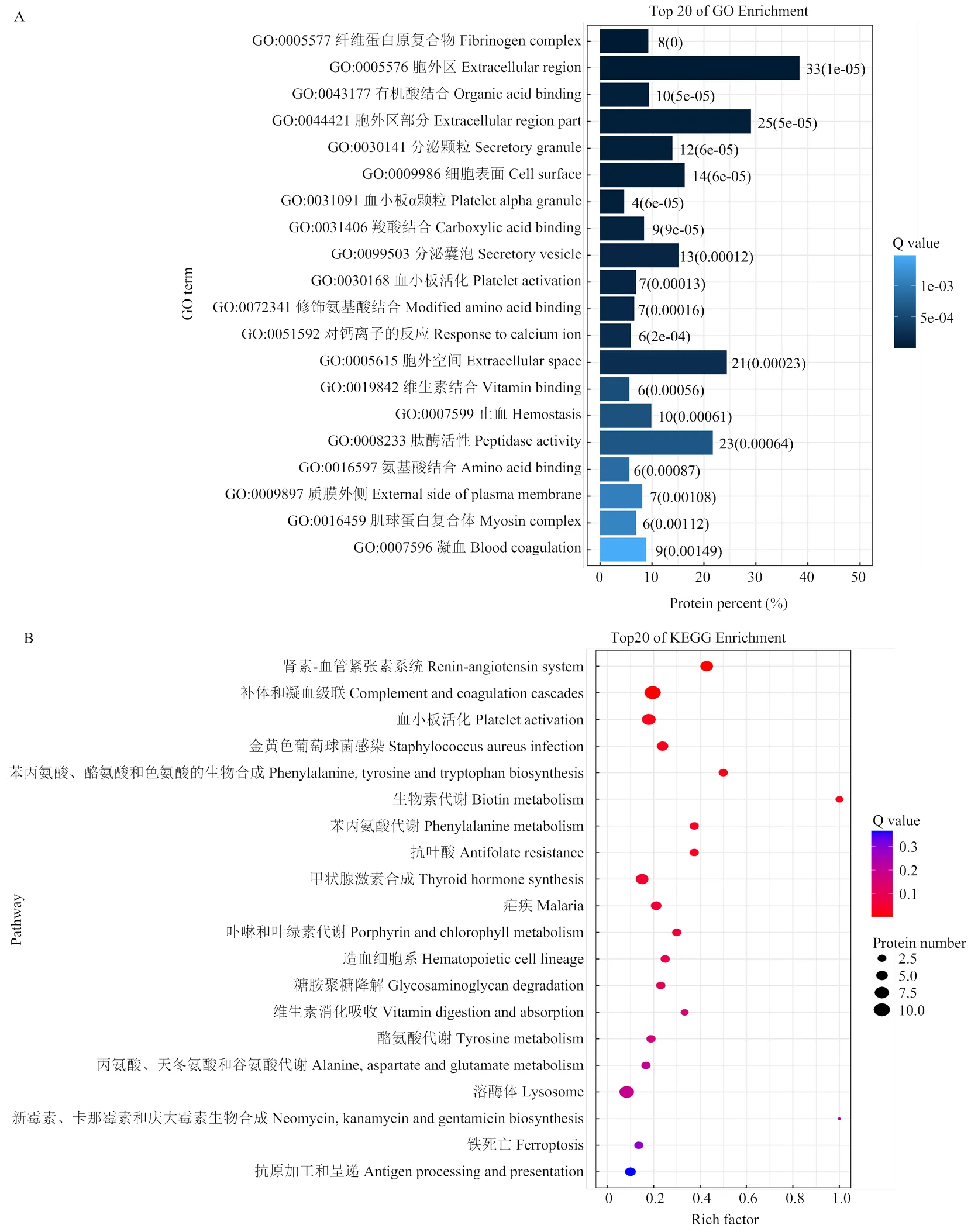
A:GO富集分析前20 GO term结果(Y轴:GO term,X轴:蛋白占比,颜色变化代表q值);B:KEGG富集分析前20 pathway结果(Y轴:通路名称,X轴:富集指数,圆圈大小代表蛋白数量,颜色变化代表q值)
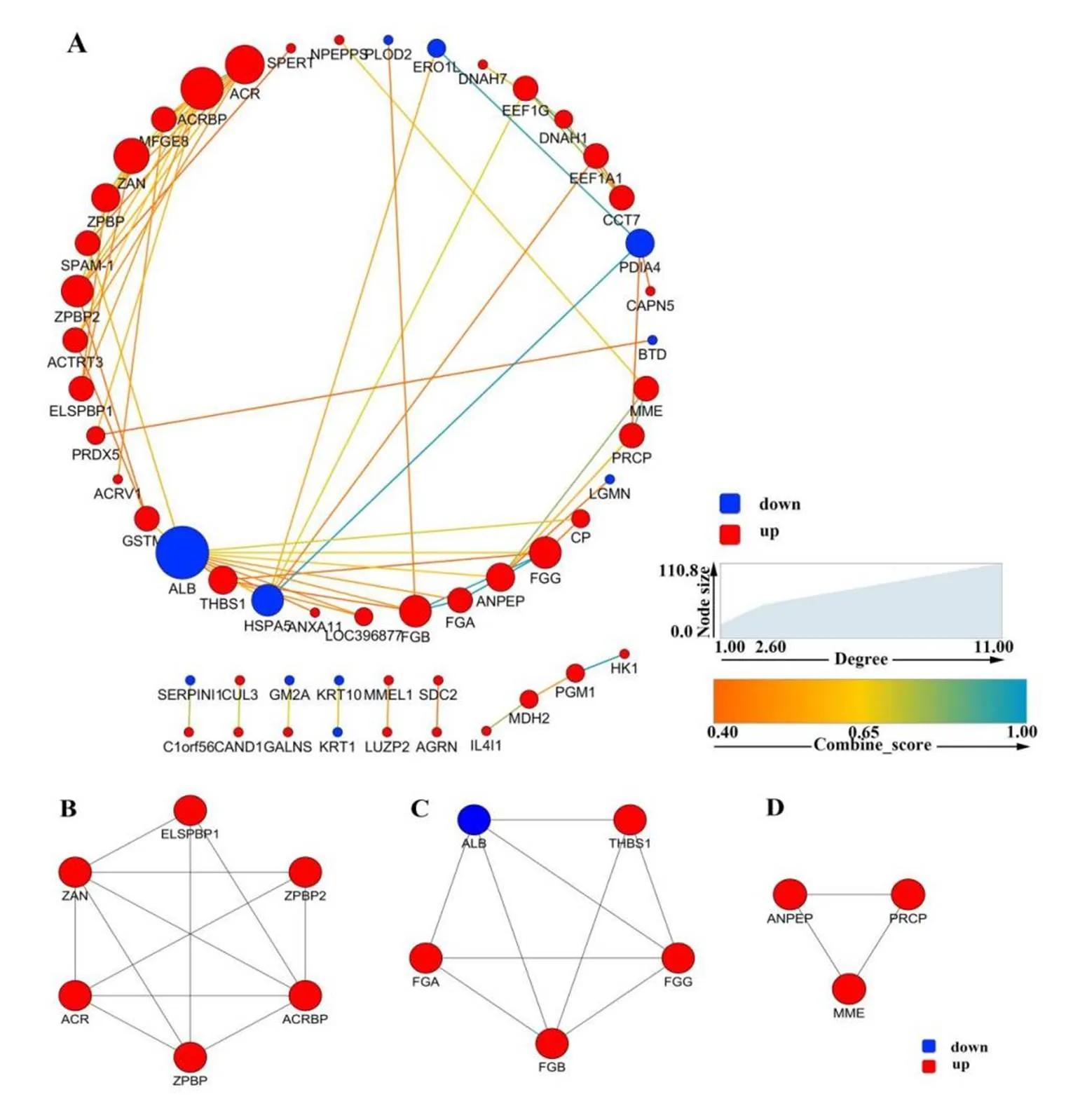
A:所有DAPs的string分析的PPI网络图(蓝色圆圈代表下调蛋白,红色圆圈代表上调蛋白,圆圈大小代表互作级别,线条颜色蛋白互作强弱);B、C和D:PPI网络中的重叠子网(蓝色圆圈代表下调蛋白,红色圆圈代表上调蛋白)
3.2 公猪精子耐冻性与精子发生和功能蛋白的相关性
本研究中,还分析得到大量与精子发生和功能相关的蛋白质存在差异。GFE组中高表达的HSPA5是HSP70家族的成员之一,具有调节精子活力和凋亡的作用,在德州驴的GFE组精清中也发现其高表达[24]。HSPA5的表达差异与先前研究中HSP90AA1[8]和HSP90[21]分别在不同耐冻性的公猪和公牛精子中表达一致,且HSP90AA1和HSP90被认为可作为预测精子耐冻性的标志物。MFGE8在促进精子与卵子透明带的黏附中发挥关键作用,已有研究表明MFGE8对猪精子的冷冻保存产生负面影响,其推测MFGE8在射精过程中与精子结合,冷冻过程中精子长期暴露于MFGE8中,而MFGE8与其他蛋白相互作用对精子产生毒害作用,从而使精子的活力降低[11]。笔者的研究结果也发现MFGE8在PFE中表达上调。此外还有大量与精子顶体反应、透明带结合等受精相关的蛋白(ACR、ZAN、ZPBP等)在PFE组中的表达较GFE组上调,但当前尚未有研究阐述这些蛋白与精子冷冻性能的关系。
研究表明DNAH1的基因突变是引起精子鞭毛异常的主导遗传因素,由DNAH1突变引起的鞭毛异常的发生率为24.6%,小鼠的同源DNAH1基因纯合敲除,精子速度和活力显著降低,导致不育症[25]。鞭毛与精子运动和结构密切相关,精子的活力高低依赖于鞭毛的结构完整性,在精子获能过程中,精子会产生不对称的鞭毛跳动,称为过度活化,是获能的一个重要环节[26]。PFE组中高表达的DNAH1可能对鞭毛的运动功能有促进作用,容易促使精子发生过度活化,从而引起精子在冷冻过程中过早获能,过早获能的精子对冷冻损伤的敏感性增强,从而引起精子的冻后活力下降[27]。除了DNAH1,还鉴定到与精子鞭毛相关的DNAH7和CUL3在PFE中的表达也显著高于GFE组。
3.3 公猪精子耐冻性与能量蛋白的相关性
研究中还发现部分能量相关的蛋白质在PFE组精子中的表达高于GFE组。Pedrosa等[7]同样发现猪精子和精浆中能量相关的miRNA在耐冻性差的精子和精浆中高表达,可见能量相关蛋白可能与精子耐冻性相互关联。在精子中,糖酵解是精子中产生ATP的主要代谢途径之一,ATP是维持精子活力和精子获能所必需的能量来源,当精子中缺失糖酵解的相关酶,会明显影响精子的超激活运动并引起多种信号和代谢缺陷,这些缺陷可能是导致雄性不育的原因[28]。本研究PFE组高表达的HK1、PGM1是糖酵解相关蛋白,且HK1为糖酵解的关键酶,两者高表达可能促进ATP的过量产生,使精子在冻融过程中或冻融后提前获能,最终导致精子死亡,这与VILAGRAN等[29]的研究结果相似,其确定在PFE中高表达的TPI是糖酵解途径中的一种酶,可作为预测精子耐冻性的指标。
3.4 公猪精子耐冻性与炎症和凋亡蛋白的相关性
Fraser等[6]在不同耐冻性猪精子RNA-Seq转录组分析中发现,许多与炎症和凋亡相关的基因在低耐冻性猪精子中表达显著上调,这些基因的表达与精子的耐冻力呈负相关,可能触发精子在冷冻过程中的凋亡样变化机制,导致冷冻损伤的增加。笔者的研究结果中也观察到了这一现象,THBS1、ELSPBP1和CP等与凋亡和炎症相关的蛋白在PFE组中的表达显著上调。研究表明THBS1以剂量依赖的方式直接诱导颗粒细胞凋亡,其可能是原始生殖细胞(PGCs)中的促凋亡因子[30]。且THBS1的功能富集于MAPK通路的激活(GO:0000187),MAPK通路可调节细胞的增殖和凋亡,此外MAPK通路的激活还与精子中酪氨酸磷酸化水平的增加有关,冷冻过程中精子蛋白磷酸化与猪精子获能样变化有关,这些都有可能导致精子冻后活力的降低[6]。ELSPBP1在附睾头部和附睾体高表达,与公牛的生育能力呈负相关,研究表明ELSPBP1可能作为附睾液中促凋亡配体的下游成分,而具有与死亡精子结合的特异性[31]。CP则是一种炎症相关蛋白,在炎症、感染和创伤期间的血清浓度升高,且炎症可以导致肝脏CP mRNA的含量迅速增加[32]。
3.5 公猪精子耐冻性与肾素-血管紧张素系统(RAS)通路蛋白的相关性
通过蛋白STRING分析,PPI网络中一个重叠子网的三个蛋白MME、ANPEP和PRCP在肾素-血管紧张素系统(RAS)通路中相互作用。一些组织和细胞具有固有的RAS,这种RAS通过不同的旁分泌和自分泌机制在局部发挥作用,在睾丸、附睾、输精管、前列腺、精浆和精子中都发现了RAS的成分,已有证据表明RAS在雄性生殖中参与肾小管收缩、精子发生、精子成熟、获能、顶体胞吐和受精等方面[33]。RAS是由多条轴组成的复杂系统,局部RAS对睾丸和精子功能以及精子生理过程的作用都涉及到四条关键轴,MME作用于ACE2/Ang (1-7)/ MasR轴,该轴在调节类固醇发生和精子发生中起着关键作用,ANPEP作用于Ang IV/AT4R-IRAP轴,该轴与抑制睾丸睾酮的产生有关,进而调节精子的发生,且MME和ANPEP的表达都与精子活力呈负相关[34]。可见RAS在雄性生殖系统中发挥着至关重要的作用,在PFE组中高表达的MME、ANPEP和PRCP在RAS中相互作用,可能对精子的生成和功能产生影响,但其导致精子产生低耐冻性的机制有待进一步研究。
4 结论
本研究利用TMT技术对二花脸公猪不同耐冻性精子进行了蛋白质组学分析,共鉴定出138个DAPs。通过对DAPs的生物信息学分析,发现DAPs主要集中于氧化还原相关蛋白(GSTM3、PRDX5、ALB、PDIA1、PDIA4等),精子发生与功能相关蛋白(HSPA5、MFGE8、DNAH1、DNAH7、CUL3等),能量相关蛋白(HK1、PGM1等)以及凋亡与炎症相关蛋白(THBS1、ELSPBP1、CP等),有3个DAPs(MME、ANPEP和PRCP)在肾素-血管紧张素系统(RAS)中相互作用。总之,研究结果表明二花脸公猪不同耐冻性的精子蛋白质组成存在显著差异,这些DAPs可作为预测精子耐冻性的候选蛋白,但其对精子耐冻性的影响机制还有待进一步研究。
[1] 刘鑫, 李振, 邓世阳, 顾岳清, 黄媛, 刘杨, 李东锋, 卢元鹏, 韦伟, 陈杰, 张立凡. 二花脸猪种质特性的分子基础研究进展. 畜牧与兽医, 2016, 48(12): 109-113.
LIU X, LI Z, DENG S Y, GU Y Q, HUANG Y, LIU Y, LI D F, LU Y P, WEI W, CHEN J, ZHANG L F. Research Progress on molecular basis of Erhualian pig germplasm characteristics. Animal Husbandry & Veterinary Medicine, 2016, 48(12): 109-113. (in Chinese)
[2] 吴梦, 刘雪芹, 刘子嘉, 肖普英, 丁玉春, 刘作华, 葛良鹏. 猪精液超低温冷冻保存研究进展. 中国畜牧杂志, 2019, 55(7): 35-40. doi:10.19556/j.0258-7033.2019-07-035.
WU M, LIU X Q, LIU Z J, XIAO P Y, DING Y C, LIU Z H, GE L P. Research progress on cryopreservation of boar semen. Chinese Journal of Animal Science, 2019, 55(7): 35-40. doi:10.19556/j.0258- 7033.2019-07-035. (in Chinese)
[3] YESTE M. Sperm cryopreservation update: Cryodamage, markers, and factors affecting the sperm freezability in pigs. Theriogenology, 2016, 85(1): 47-64. doi:10.1016/j.theriogenology.2015.09.047.
[4] WATSON P F. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reproduction, Fertility, and Development, 1995, 7(4): 871-891. doi:10.1071/rd9950871.
[5] MAŃKOWSKA A, BRYM P, PAUKSZTO Ł, JASTRZĘBSKI J P, FRASER L. Gene polymorphisms in boar spermatozoa and their associations with post-thaw semen quality. International Journal of Molecular Sciences, 2020, 21(5): 1902. doi:10.3390/ijms21051902.
[6] FRASER L, BRYM P, PAREEK C S, MOGIELNICKA-BRZOZOWSKAM, PAUKSZTO Ł, JASTRZĘBSKI J P, WASILEWSKA-SAKOWSKA K, MAŃKOWSKA A, SOBIECH P, ŻUKOWSKI K. Transcriptome analysis of boar spermatozoa with different freezability using RNA- Seq. Theriogenology, 2020, 142: 400-413. doi:10.1016/j.theriogenology. 2019.11.001.
[7] PEDROSA A C, ANDRADE TORRES M, VILELA ALKMIN D, PINZON J E P, KITAMURA MARTINS S M M, COELHO DA SILVEIRA J, FURUGEN CESAR DE ANDRADE A. Spermatozoa and seminal plasma small extracellular vesicles miRNAs as biomarkers of boar semen cryotolerance. Theriogenology, 2021, 174: 60-72. doi:10.1016/j.theriogenology.2021.07.022.
[8] CASAS I, SANCHO S, BALLESTER J, BRIZ M, PINART E, BUSSALLEU E, YESTE M, FÀBREGA A, RODRÍGUEZ-GIL J E, BONET S. The HSP90AA1 sperm content and the prediction of the boar ejaculate freezability. Theriogenology, 2010, 74(6): 940-950. doi:10.1016/j.theriogenology.2010.04.021.
[9] PRIETO-MARTÍNEZ N, VILAGRAN I, MORATÓ R, RIVERA DEL ÁLAMO M M, RODRÍGUEZ-GIL J E, BONET S, YESTE M. Relationship of aquaporins 3 (AQP3), 7 (AQP7), and 11 (AQP11) with boar sperm resilience to withstand freeze-thawing procedures. Andrology, 2017, 5(6): 1153-1164. doi:10.1111/andr.12410.
[10] LLAVANERA M, DELGADO-BERMÚDEZ A, FERNANDEZ- FUERTES B, RECUERO S, MATEO Y, BONET S, BARRANCO I, YESTE M. GSTM3, but not IZUMO1, is a cryotolerance marker of boar sperm. Journal of Animal Science and Biotechnology, 2019, 10: 61. doi:10.1186/s40104-019-0370-5.
[11] GUIMARÃES D B, BARROS T B, VAN TILBURG M F, MARTINS J A M, MOURA A A, MORENO F B, MONTEIRO-MOREIRA A C, MOREIRA R A, TONIOLLI R. Sperm membrane proteins associated with the boar semen cryopreservation. Animal Reproduction Science, 2017, 183: 27-38. doi:10.1016/j.anireprosci.2017.06.005.
[12] 王欣悦, 石田培, 赵志达, 胡文萍, 尚明玉, 张莉. 基于绵羊胚胎骨骼肌蛋白质组学的PI3K-AKT信号通路分析. 中国农业科学, 2020, 53(14): 2956-2963. doi:10.3864/j.issn.0578-1752.2020.14.018.
WANG X Y, SHI T P, ZHAO Z D, HU W P, SHANG M Y, ZHANG L. The analysis of PI3K-AKT signal pathway based on the proteomic results of sheep embryonic skeletal muscle. Scientia Agricultura Sinica, 2020, 53(14): 2956-2963. doi:10.3864/j.issn.0578-1752.2020. 14.018. (in Chinese)
[13] 刘锴栋, 莫亿伟, 冯少娴, 吴婉仪, 黎海利, 钟军弟, 袁长春. 番荔枝花发育不同阶段的差异蛋白质组分析. 中国农业科学, 2018, 51(1): 149-159. doi:10.3864/j.issn.0578-1752.2018.01.014.
LIU K D, MO Y W, FENG S X, WU W Y, LI H L, ZHONG J D, YUAN C C. Comparative proteomic analysis in different developmental stages of sugar-apple (L.) flowers. Scientia Agricultura Sinica, 2018, 51(1): 149-159. doi:10.3864/j.issn.0578- 1752.2018.01.014. (in Chinese)
14] REGO J P A, MARTINS J M, WOLF C A, VAN TILBURG M, MORENO F, MONTEIRO-MOREIRA A C, MOREIRA R A, SANTOS D O, MOURA A A. Proteomic analysis of seminal plasma and sperm cells and their associations with semen freezability in Guzerat bulls. Journal of Animal Science, 2016, 94(12): 5308-5320. doi:10.2527/jas.2016-0811.
[15] VAZQUEZ J M, MARTINEZ E A, MARTINEZ P, GARCIA-ARTIGA C, ROCA J. Hypoosmotic swelling of boar spermatozoa compared to other methods for analysing the sperm membrane. Theriogenology, 1997, 47(4): 913-922. doi:10.1016/S0093-691X(97)00046-0.
[16] SHAN X, YU T, YAN X, WU J L, FAN Y N, GUAN X Y, FANG F G, LIN Y H, ZHANG Y H, LI Y S, LIU Y. Proteomic analysis of healthy and atretic porcine follicular granulosa cells. Journal of Proteomics, 2021, 232: 104027. doi:10.1016/j.jprot.2020.104027.
[17] MANDAL R, BADYAKAR D, CHAKRABARTY J. Role of membrane lipid fatty acids in sperm cryopreservation. Advances in Andrology, 2014, 2014: 190542. doi:10.1155/2014/190542.
[18] LLAVANERA M, DELGADO-BERMÚDEZ A, OLIVES S, MATEO-OTERO Y, RECUERO S, BONET S, FERNÁNDEZ- FUERTES B, YESTE M, BARRANCO I. Glutathione S-transferases play a crucial role in mitochondrial function, plasma membrane stability and oxidative regulation of mammalian sperm. Antioxidants (Basel, Switzerland), 2020, 9(2): 100. doi:10.3390/antiox9020100.
[19] GOMES F P, PARK R, VIANA A G, FERNANDEZ-COSTA C, TOPPER E, KAYA A, MEMILI E, YATES J R, MOURA A A. Protein signatures of seminal plasma from bulls with contrasting frozen- thawed sperm viability. Scientific Reports, 2020, 10: 14661. doi:10.1038/s41598-020-71015-9.
[20] NAGDAS S K, BUCHANAN T, RAYCHOUDHURY S. Identification of peroxiredoxin-5 in bovine cauda epididymal sperm. Molecular and Cellular Biochemistry, 2014, 387(1/2): 113-121. doi:10.1007/s11010- 013-1876-3.
[21] WANG P, WANG Y F, WANG H, WANG C W, ZAN L S, HU J H, LI Q W, JIA Y H, MA G J. HSP90 expression correlation with the freezing resistance of bull sperm. Zygote (Cambridge, England), 2014, 22(2): 239-245. doi:10.1017/S096719941300004X.
[22] VINCE S, ŽAJA I Ž, SAMARDŽIJA M, BALIĆ I M, VILIĆ M, ĐURIČIĆ D, VALPOTIĆ H, MARKOVIĆ F, MILINKOVIĆ-TUR S. Age-related differences of semen quality, seminal plasma, and spermatozoa antioxidative and oxidative stress variables in bulls during cold and warm periods of the year. Animal, 2018, 12(3): 559-568. doi:10.1017/S1751731117001811.
[23] SOARES MORETTI A I, MARTINS LAURINDO F R. Protein disulfide isomerases: Redox connections in and out of the endoplasmic. Archives of Biochemistry and Biophysics, 2017, 617: 106-119. doi:10.1016/j.abb.2016.11.007.
[24] YU J, LI M, JI C L, LI X X, LI H J, LIU G Q, WANG Y T, LIU G Y, WANG T, CHE X N, LEI C Z, DANG R H, ZHAO F W. Comparative proteomic analysis of seminal plasma proteins in relation to freezability of Dezhou donkey semen. Animal Reproduction Science, 2021, 231: 106794. doi:10.1016/j.anireprosci.2021.106794.
[25] WANG W L, TU C F, TAN Y Q. Insight on multiple morphological abnormalities of sperm flagella in male infertility: What is new? Asian Journal of Andrology, 2020, 22(3): 236-245. doi:10.4103/aja.aja_ 53_19.
[26] STIVAL C, DEL C PUGA MOLINA L, PAUDEL B, BUFFONE M G, VISCONTI P E, KRAPF D. Sperm capacitation and acrosome reaction in mammalian sperm. Advances in Anatomy, Embryology, and Cell Biology, 2016, 220: 93-106. doi:10.1007/978-3-319-30567-7_5.
[27] KHAN I M, CAO Z B, LIU H Y, KHAN A, RAHMAN S U, KHAN M Z, SATHANAWONGS A, ZHANG Y H. Impact of cryopreservation on spermatozoa freeze-thawed traits and relevance OMICS to assess sperm cryo-tolerance in farm animals. Frontiers in Veterinary Science, 2021, 8: 609180. doi:10.3389/fvets.2021.609180.
[28] HUANG Z H, DANSHINA P V, MOHR K, QU W D, GOODSON S G, O’CONNELL T M, O’BRIEN D A. Sperm function, protein phosphorylation, and metabolism differ in mice lacking successive sperm-specific glycolytic enzymes. Biology of Reproduction, 2017, 97(4): 586-597. doi:10.1093/biolre/iox103.
[29] VILAGRAN I, CASTILLO J, BONET S, SANCHO S, YESTE M, ESTANYOL J M, OLIVA R. Acrosin-binding protein (ACRBP) and triosephosphate isomerase (TPI) are good markers to predict boar sperm freezing capacity. Theriogenology, 2013, 80(5): 443-450. doi:10.1016/j.theriogenology.2013.05.006.
[30] ZHU W H, YANG M, SHANG J N, XU Y L, WANG Y L, TAO Q Q, ZHANG L, DING Y Y, CHEN Y G, ZHAO D D, WANG C L, CHU M X, YIN Z J, ZHANG X D. miR-222 inhibits apoptosis in porcine follicular granulosa cells by targeting the THBS1gene. Animal Science Journal, 2019, 90(6): 719-727. doi:10.1111/asj.13208.
[31] D'AMOURS O, FRENETTE G, BORDELEAU L J, ALLARD N, LECLERC P, BLONDIN P, SULLIVAN R. Epididymosomes transfer epididymal sperm binding protein 1 (ELSPBP1) to dead spermatozoa during epididymal transit in bovine. Biology of Reproduction, 2012, 87(4): 94, 1-11. doi:10.1095/biolreprod.112.100990.
[32] HELLMAN N E, GITLIN J D. Ceruloplasmin metabolism and function. Annual Review of Nutrition, 2002, 22: 439-458. doi:10. 1146/annurev.nutr.22.012502.114457.
[33] LEUNG P S, SERNIA C. The renin-angiotensin system and male reproduction: new functions for old hormones. Journal of Molecular Endocrinology, 2003, 30(3): 263-270. doi:10.1677/jme.0.0300263.
[34] GIANZO M, SUBIRÁN N. Regulation of male fertility by the renin-angiotensin system. International Journal of Molecular Sciences, 2020, 21(21): 7943. doi:10.3390/ijms21217943.
Proteomic Analysis of Sperm with Different Freezing Tolerance in Erhualian Boar

1Department of Animal Genetics and Breeding, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095;2Jiangsu Changshu Animal Husbandry Industry and Commerce Co., Ltd., Changshu 215500, Jiangsu
【Objective】Erhualian pig is one of the excellent indigenous pig breeds in China. Frozen semen can improve the utilization rate of Erhualian boar and strengthen the protection of germplasm resources. However, the frozen semen of Erhualian pigs can not meet the production demand. This study analyzed the proteomics of Erhualian boar sperm with different freezing tolerance to promote the screening of protein markers of Erhualian boar sperm freezing tolerance, analyze the influencing factors of sperm freezing tolerance from the genetic level, and provide reference basis for improving sperm freezing tolerance. 【Method】In this study, semen from14 Erhualian boars were frozen and their quality was analyzed. Boars with good and poor freezability ejaculates (GFE and PFE, n=3) were selected respectively, according to the motility and progressive motility of frozen-thawed spermatozoa. Using tandem mass tag (TMT) analyzed the sperm proteomics of GFE and PFE, and the differentially abundant proteins (DAPs) of spermatozoa of GFE and PFE were identified. The functions of DAPs were annotated by GO enrichment analysis, and the biological pathways of DAPs were annotated by KEGG enrichment analysis. The interaction network of DAPs was analyzed by STRING protein interaction database, and the protein-protein interaction (PPI) network was constructed by Cytoscape software. 【Result】The study found that there were 138 DAPs between GFE and PFE. Compared with GFE, 109 DAPs were up-regulated and 29 DAPs were down-regulated in PFE. GO enrichment analysis showed that a total of 124 DAPs were enriched to 47 GO terms, mainly enriched in “cellular process” “single-organism process” “binding” “cell” “cell part” and so on. KEGG enrichment analysis showed that DAPs were mainly enriched in “Renin-angiotensin system” “Complement andcoagulation cascades” “Platelet activation” and so on. There were 53 nodes and 69 edges in the PPI network, among which 8 proteins showed high combine_score, including ALB, ACRBP, ACR, ZAN, ZPBP2, HSPA5, FGB and FGG. The functions of these proteins were mainly enriched in GO terms closely related to animal reproductive physiology and spermatogenesis, such as “single fertilization” “sexual reproduction” and “spermatid development”. Further analysis shows that DAPs in GFE and PFE mainly included redox related proteins (GSTM3, PRDX5, ALB, PDIA1, PDIA4), spermatogenesis and sperm function related proteins (HSPA5, MFGE8, DNAH1, DNAH7, CUL3), energy related proteins (HK1, PGM1), apoptosis and inflammation related proteins (THBS1, ELSPBP1, CP), and PPI network analysis shows that three DAPs (MME, ANPEP and PRCP) interact in renin-angiotensin system (RAS). 【Conclusion】There are significant differences in sperm protein components of Erhualian boar with different freezing tolerance, which may affect the freezing performance of sperm. These DAPs can be used as candidate protein markers of sperm freezing tolerance.
Erhualian boar; sperm freezing tolerance; TMT; differentially abundant proteins

10.3864/j.issn.0578-1752.2022.23.014
2021-09-18;
2021-12-28
江苏省种业振兴揭榜挂帅项目(JBGS(2021)026)、农业农村部地方猪遗传材料采集制作专项课题(19190632)、农业农村部都市农业重点实验室开放课题(UA201909)
童世锋,E-mail:sftong9518@163.com。通信作者刘杨,E-mail:yangliu@njau.edu.cn
(责任编辑 林鉴非)

