陌夜蛾性信息素类似物的合成及其生物活性
任梓齐,康玉洁,李海珍,王连刚,马好运,李慧,王留洋,梅向东,宁君
陌夜蛾性信息素类似物的合成及其生物活性
任梓齐1,2,康玉洁3,李海珍4,王连刚4,马好运1,李慧1,王留洋1,梅向东1,宁君1
1中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;2东北林业大学生命科学学院/东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040;3平度市农业农村局植保科,山东青岛 266799;4青岛市农业技术推广中心,山东青岛 266299
【背景】陌夜蛾()作为一种重要食叶害虫,近年来,由于其数量以及危害程度的不断增加,已对我国华北、华东等地区的农林业造成重大危害,尤其是对荞麦等作物的产量构成严重威胁。【目的】以陌夜蛾性信息素主要组分顺-11-十六碳烯乙酸酯(11-16:Ac)为母体结构,合成6种具有不同生物活性的性信息素类似物,为陌夜蛾的综合治理开辟一种新型环境友好的防治策略。【方法】选用性信息素组分的前体顺-11-十六碳烯-1-醇(11-16:OH)为原料,在缚酸剂和催化剂的作用下,与酸酐或酰氯发生反应,通过硅胶柱层析进行分离纯化后,合成性信息素类似物共6种。包括极性基团为氨基甲酸酯的性信息素类似物M3、M4,极性基团末端引入不饱和键的性信息素类似物M5、M6,以及卤素原子修饰的性信息素类似物M7、M8。通过触角电生理试验(EAG)测定不同剂量性信息素类似物直接刺激下的EAG响应值,并于北京市延庆区进行田间试验对性信息素类似物的生物活性进行验证。【结果】EAG试验表明,类似物M1、M2、M6、M7和M8具有显著的剂量-效应关系。其中陌夜蛾雄蛾触角对类似物M7的响应最为强烈,在100 μg剂量下响应值达2.36 mV,是同剂量条件下11-16:Ac响应值的77.9%。而M3—M5在10—1 000 μg剂量下,与性信息素组分11-16:Ac的相对响应值之间存在显著差异(<0.05),M5的EAG响应整体活性表现较差,最高相对响应值仅为性信息素组分的21.2%。田间试验表明,类似物M1和M5在添加剂量为1 μg时,平均诱捕量分别为38.00和35.67头/诱捕器/15 d,与性信息素对照相比存在显著差异;类似物M7在添加剂量为100 μg时,平均诱捕量为29.67头/诱捕器/15 d,显著高于性信息素对照;类似物M4具有潜在的抑制活性,随着其添加剂量的增加,平均诱捕量逐渐减少,当添加剂量为1 000 μg时,平均诱捕量仅有3.33头/诱捕器/15 d。【结论】经过EAG试验和田间试验验证,类似物M1、M5和M7具有显著的增效活性,可以用作性信息素的增效剂,类似物M4具有显著的抑制活性,可以用作性信息素的抑制剂。研究结果可为使用性信息素类似物绿色防控陌夜蛾提供理论依据。
陌夜蛾;性信息素类似物;化学合成;生物活性;田间应用
0 引言
【研究意义】陌夜蛾()隶属鳞翅目(Lepidoptera)夜蛾科(Noctuidae),幼虫取食荞麦、酸模等多种植物叶片,具有多食性、暴食性和群集性,在极短的时间内即可对寄主植物造成巨大危害[1-4]。成虫具有趋光性、假死性和迁飞性,据报道迁飞时间为每年6—11月[5]。每年发生两代,以蛹的形式在土壤中越冬,且繁殖力强,每只雌蛾可产卵上百粒[6]。陌夜蛾在世界范围内均有分布,在我国主要分布于北京、上海、黑龙江等地[7-12]。由于陌夜蛾数量以及危害程度的不断增加,近年来逐渐成为重要的农林害虫之一。传统化学农药因其具有杀伤天敌、易产生抗药性、影响环境等问题在实际生产中的施用受到限制。昆虫性信息素及其类似物作为具有特异性的“生物化学农药”,在害虫预测预报、交配干扰和成虫诱杀等方面均有显著作用[13]。因此,研究陌夜蛾性信息素及其类似物,对开展该害虫绿色防控具有重要意义。【前人研究进展】昆虫性信息素类似物与天然性信息素相比具有更好的理化性质,并可增加对害虫的特异选择性[14-15]。常见的性信息素结构修饰有卤素取代、极性基团修饰、烷基链修饰、引入标记原子或光学异构体转换等[16]。其中极性基团修饰的性信息素类似物又包括官能团转换类、引入不饱和键类、引入氨基甲酸酯类等[17]。研究表明,结构多样的昆虫性信息素类似物,具有生物活性及功能的多样性[18]。根据性信息素类似物的不同作用效果,可以将其分为模拟物、增效剂和抑制剂[19]。模拟物通常具有类似性信息素的生理活性,能够模拟性信息素组分代替其发挥作用,如苜蓿小卷蛾()性信息素组分的单氟取代类似物是其性信息素的良好模拟物[20];增效剂本身活性较弱,但与天然性信息素混用有明显的协同增效效果,如环针单纹卷蛾()性信息素组分的五氟乙基类似物是其天然性信息素的有效增效剂[21];抑制剂与天然性信息素混用具有降低其生物活性的作用,如黑穗醋栗透翅蛾()的氨基甲酸酯类性信息素类似物是其天然性信息素的显著抑制剂,在不同程度上降低了其生物活性[22]。【本研究切入点】近年来,随着利用昆虫行为学及其本身生理生化特性防治害虫的新技术逐渐成为研究热点,性信息素及其类似物在害虫防治中的应用也越来越广泛。然而,长期使用固定组分的性信息素也可能导致昆虫产生抗性[23],因此,设计合成具有生物活性的性信息素类似物可以替代或配合性信息素使用,能够更有效地进行陌夜蛾的防控。【拟解决的关键问题】以陌夜蛾性信息素的主要成分顺-11-十六碳烯乙酸酯(11-16:Ac)为母体结构,设计合成具有不同生物学特性的性信息素类似物。运用触角电生理试验(EAG)和田间试验,对合成的6种性信息素类似物以及购买的2种性信息素类似物的生物活性进行验证,以期为应用性信息素类似物绿色防控陌夜蛾提供依据。
1 材料与方法
1.1 供试材料及试剂、仪器
1.1.1 供试虫源及饲养 陌夜蛾成虫于北京市延庆区旧县镇有机农业示范区内高空探照灯下采集。实验室饲养时将其放置在两端用纱布包裹的自制养虫桶(长30 cm,直径8 cm)中,用棉球供以10%蜂蜜水,定期收集卵。将收集的卵置于室内人工气候箱内,于温度(25±2)℃,相对湿度(70±10)%,光周期L/D=16 h/8 h条件下进行孵化。待幼虫孵化后将其放入养虫笼中,食物为野外采集的新鲜酸模叶片,每日定时清理幼虫的排泄物及其取食过的叶片残渣,保持养虫笼内的清洁,观察幼虫虫龄至老熟幼虫后,将其放置在土壤表层待其入土化蛹。每日在土壤表面喷少量水以保持土壤湿度。羽化后,将雌、雄蛾分别放入拇指管(长10 cm,直径2.5 cm)中单头饲养,并按羽化天数进行标记,以10%蜂蜜水饲喂待用。
1.1.2 主要试剂及仪器 顺-11-十六碳烯-1-醇(11- 16:OH,95%)、反-11-十六碳烯-1-醇(11-16:OH,98%)购自上海有德化工有限公司,使用前需经过柱纯化;顺-11-十六碳烯醛(类似物M1,11-16:Ald,95%)、反-11-十六碳烯醛(类似物M2,11-16:Ald,95%)购自上海源叶生物科技有限公司;乙酸酐、二氟乙酸酐、丙酰氯、2-溴丙酰氯、2-丁烯酰氯、3-甲基巴豆酰氯、N-甲氨基甲酰氯、二甲氨基甲酰氯、4-二甲氨基吡啶(DMAP)、三乙胺(TEA)、碳酸钾(K2CO3)、二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF)、乙酸乙酯、石油醚、无水硫酸钠等均为市售AR级别,购自北京建强伟业科技有限公司、上海阿拉丁生化科技股份有限公司等,部分药剂按需进行重蒸除水。
PRX450D型智能人工气候箱;Syntech型触角电位仪;Bruker NEO-500MHz核磁共振波谱仪;Bruker solariX型质谱仪。
1.2 陌夜蛾性信息素类似物的合成
1.2.1 极性基团为氨基甲酸酯的性信息素类似物的合成 向含11-16:OH(1.00 g,4.16 mmol)的DMF(20 mL)中,加入缚酸剂K2CO3(0.86 g,6.24 mmol),于冰盐浴中不断搅拌至温度达到-20℃后,缓慢滴加N-甲氨基甲酰氯(0.50 g,6.24 mmol)的DMF(约5 mL)溶液,保持该温度反应30 min,自然升至室温,TLC跟踪反应进程,底物转化完全后,停止反应。有机相经乙酸乙酯(10 mL)萃取3次,合并萃取液后依次经饱和NaCl溶液(25 mL×3次)洗涤,无水硫酸钠干燥,过滤、旋蒸脱溶后得粗产物。粗品经硅胶快速柱层析分离纯化,洗脱剂:V(乙酸乙酯)﹕V(石油醚)=1﹕50,得到目标化合物顺-11-十六碳烯-1-醇-N-甲基氨基甲酸酯(M3)。采用相似的方法合成顺-11-十六碳烯-1-醇-N, N-二甲氨基甲酸酯(M4),合成路线如图1。

图1 类似物M3、M4合成路线
1.2.2 极性基团末端引入不饱和键的性信息素类似物的合成 更换缚酸剂为TEA,溶剂为DCM,采用1.2.1类似的方法合成顺-11-十六碳烯-1-醇-3-甲基-2-丁烯酸酯(M5)、顺-11-十六碳烯-1-醇-2-丁烯酸酯(M6),合成路线如图2。
1.2.3 卤素原子修饰的性信息素类似物的合成 采用1.2.2类似的方法合成顺-11-十六碳烯-1-醇-2, 2-二氟乙酸酯(M7)、顺-11-十六碳烯-1-醇-2-溴丙酸酯(M8),合成路线如图3。
1.3 EAG活性测定
选取羽化2—3 d未交配的雄蛾作为供试昆虫,用CO2麻醉后将其一端触角从触角窝处完整摘下,同时快速切下触角基部和顶部约1 mm后通过导电凝胶将其固定在两个金属电极之间形成闭合回路,调试触角电位仪,待基线平稳后进行EAG活性测定。刺激的记录时间为0.2 s,两次刺激间隔不少于1 min,使触角能够恢复对化合物的响应。触角响应的电位变化由IDAC4信号采集控制器采集,并使用EAG Pro软件记录数据。
准备长条形(2 cm×0.5 cm)的滤纸条中间对折,部分插入巴斯德管宽口端,巴斯德管尖端插入通有连续气流的钢管上一小孔内。待测化合物以正己烷溶解配成一系列的浓度梯度,即0.001、0.01、0.1、1、10、100 μg·μL-1。按照待测化合物浓度由低到高,分别取10 μL依次滴到滤纸条凹槽处,待正己烷挥发后将其完全推入,连接刺激气流管,开始EAG测定。每个待测化合物重复测试3次,每次测试均需更换触角且每只雄蛾只测试一根触角。同时,为了消除空气和溶剂的影响,以相同量的正己烷作为空白对照。每种化合物的一个浓度连续刺激两次,平均值用作处理值,在用每种化合物进行两次刺激之前和之后设置空白对照,两组对照的平均值作为对照值。试验过程中,保持生测室空气流通,室内温度在25℃左右,试验仪器用金属网罩屏蔽,以免受外界干扰。EAG相对响应值的大小对应雄蛾触角对刺激物的反应强弱,EAG相对响应值=待测化合物绝对响应值-正己烷绝对响应值[24]。
1.4 田间试验
1.4.1 诱芯及诱捕器设置 根据多次比较试验结果选择引诱效果最佳的绿色反口橡胶头作为缓释材料,诱捕器选用桶型诱捕器。向含陌夜蛾性信息素的诱芯SP(11-16:Ac﹕11-16:OH=9﹕1)中分别添加0.1、1、10、100、1 000 μg的性信息素类似物,制备成含有不同剂量性信息素类似物的诱芯。将制备好的诱芯放置在5 mL的离心管中,-20℃保存。
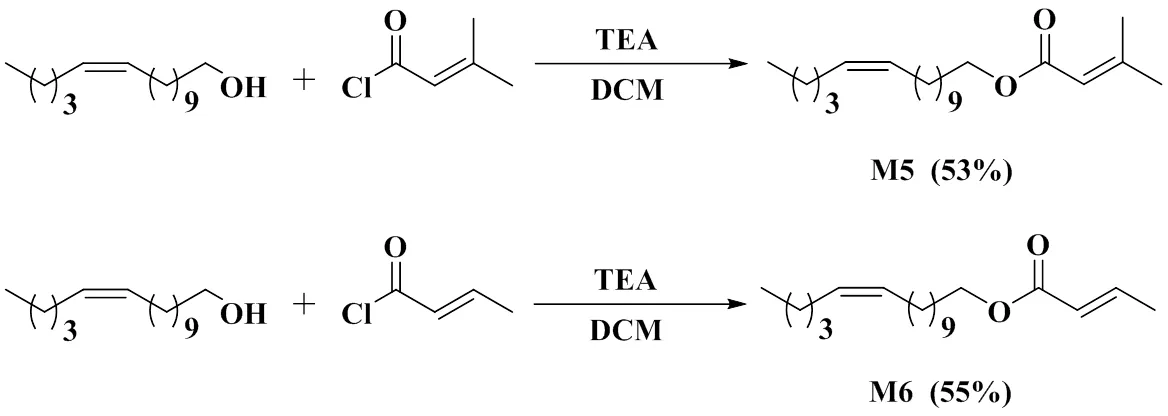
图2 类似物M5、M6的合成路线

图3 类似物M7、M8的合成路线
1.4.2 利用性信息素监测陌夜蛾成虫种群动态 利用性信息素于2021年5月10日至10月10日对陌夜蛾成虫的种群动态进行监测。试验地点选择北京市延庆区旧县镇有机农业示范区,园区占地面积66.7 hm2,种植藜科、禾本科、十字花科、茄科、菊科等多种蔬菜和作物,如玉米、甘蓝、荞麦、白菜、番茄、马铃薯、茄子、菠菜等。具体方法为在园区内随机放置3个含有陌夜蛾性信息素诱芯的桶型诱捕器,诱捕器间距不少于50 m,诱捕器高度为1 m,呈正三角形放置,每3 d调查和记录各诱捕器中的诱蛾量并清理诱捕器。为保证引诱效果,每15 d为一个周期,诱芯15 d更换一次,并随机调换诱捕器位置以减少环境误差。每个处理设置3个重复,同时放置3个空白诱芯(CK)作为对照。
1.4.3 类似物田间引诱活性试验 试验于2021年6月18日至7月20日,9月6—21日在北京市延庆区旧县镇有机农业示范区开展。将制备好的含性信息素类似物的诱芯放在安装好的桶型诱捕器小篮子中,诱芯按照类似物名称进行分组,每组在田间随机放置,相邻诱捕器之间的距离不少于20 m,诱捕器高度为1 m。从诱捕器放置后第2天起每3 d调查一次,检查和记录各诱捕器的诱蛾量并清理诱捕器,诱芯15 d更换一次。每个处理设置3个重复,同时放置含性信息素组分诱芯(SP)的桶型诱捕器作为对照(CK)。
1.5 数据处理
试验数据采用SPSS 22.0软件进行统计分析,陌夜蛾雄蛾触角对不同待测溶液的EAG相对响应值和不同诱芯田间诱蛾量采用单因素方差分析(One-way ANOVA)进行差异显著性分析,利用Tukey检验进行多重比较(<0.05),结果用平均数±标准误(mean± SE)表示,Origin绘图。
2 结果
2.1 性信息素类似物的合成
以陌夜蛾雌蛾性腺产生的性信息素主要成分顺-11-十六碳烯乙酸酯(11-16:Ac)为母体结构,设计合成陌夜蛾性信息素类似物6种,其中极性基团为氨基甲酸酯的性信息素类似物2种,极性基团末端引入不饱和键的性信息素类似物2种,卤素原子修饰的性信息素类似物2种。采用核磁共振和高分辨质谱对上述6种性信息素类似物的结构进行表征。类似物的物理性状、产率、1H NMR、13C NMR以及HRMS数据如下:
M3:顺-11-十六碳烯-1-醇-N-甲基氨基甲酸酯,()-hexadec-11-en-1-yl N-methylcarbamate,C18H35NO2,白色粉末,产率45%。1H NMR(500 MHz,CDCl3):0.89 (t,=6.2 Hz,3H),1.34(m,18H),1.63(m,2H),2.18(s,4H),2.59(m,3H),3.89(t,=6.9 Hz,2H),5.28(m,2H),7.09(br,1H);13C NMR (125 MHz,CDCl3):14.1, 22.7, 25.7, 27.3-27.9 (3C), 28.5, 29.2-29.8 (6C), 32.0, 67.6, 130.5 (2C), 157.9;HRMS(ESI)m/z:calcd for [M+H]+C18H35NO2,297.2660;found,297.2656。
M4:顺-11-十六碳烯-1-醇-N, N-二甲氨基甲酸酯,()-hexadec-11-en-1-yl N, N-dimethylcarbamate,C19H37NO2,白色粉末,产率49%。1H NMR(500 MHz,CDCl3):0.91(t,=7.2 Hz,3H),1.30(m,18H),1.62(s,2H),2.03(m,4H),2.89(s,6H),4.06(t,=6.8 Hz,2H),5.36(m,2H);13C NMR(125 MHz,CDCl3):13.9, 22.7, 26.0, 27.5, 27.7, 28.7, 29.2-29.9 (6C), 32.4, 37.7 (2C), 68.3, 130.7 (2C), 154.8;HRMS(ESI)m/z:calcd for [M+H]+C19H37NO2,311.2816;found,311.2810。
M5:顺-11-十六碳烯-1-醇-3-甲基-2-丁烯酸酯,()-hexadec-11-en-1-yl 3-methylbut-2-enoate,淡黄色油状物,产率53%;1H NMR(500 MHz,CDCl3):0.89(t,=7.2 Hz,3H),1.34(m,16H),1.61(s,2H),1.64 (m,2H),1.89(s,3H),2.16(m,7H),4.08(t,=8.4 Hz,2H),5.26(s,2H),5.70(m,1H);13C NMR(125 MHz,CDCl3):14.1, 22.4, 25.9, 26.9-27.2 (2C), 28.6, 28.9, 29.2-29.8 (7C), 32.0, 64.8, 114.6, 129.9 (2C), 138.7, 171.5;HRMS(ESI)m/z:calcd for [M+H]+C21H38O2,322.2862;found,322.2859。
M6:顺-11-十六碳烯-1-醇-2-丁烯酸酯,()-hexadec-11-en-1-yl but-2-enoate,黄色油状物,产率55%;1H NMR (500 MHz,CDCl3):0.89(t,=7.1 Hz,3H),1.34(m,18H),1.59(m,2H),2.04(m,4H),3.10 (d,=6.5 Hz,2H),4.12(t,=7.2 Hz,2H),5.14(d,=11.4 Hz,2H),5.38(m,2H),5.97(s,1H);13C NMR(125 MHz,CDCl3):14.1, 18.4, 22.7, 25.6, 27.0-27.8 (2C), 28.8-29.7 (6C), 29.9, 32.4, 64.9, 130.3 (2C), 144.2, 146.7, 166.0;HRMS(ESI)m/z:calcd for [M+H]+C20H36O2,308.2706;found,308.2703。
M7:顺-11-十六碳烯-1-醇-2, 2-二氟乙酸酯,()-hexadec-11-en-1-yl 2, 2-difluoroacetate,无色油状物,产率90%;1H NMR(500 MHz,CDCl3):0.91(t,=13.5 Hz,3H),1.32(m,16H),1.71(s,2H),2.03(m,4H),4.27(t,=13.8 Hz,2H),5.34(m,2H),5.90(s,1H);13C NMR(125 MHz,CDCl3):14.2, 22.4, 25.6, 27.2, 28.3, 29.1-29.7 (7C), 32.0, 64.8, 128.7, 130.4 (2C), 170.2;HRMS(ESI)m/z:calcd for [M+H]+C18H32F2O2,318.2374;found,318.2370。
M8:顺-11-十六碳烯-1-醇-2-溴丙酸酯,()- hexadec-11-en-1-yl 2-bromopropanoate,黄色油状物,产率83%;1H NMR(500 MHz,CDCl3):0.92(t,=13.6 Hz,3H),1.32(m,16H),1.64(m,2H),1.82(d,=7.4 Hz,3H),2.03(m,4H),4.20(t,=13.3 Hz,2H),4.36(s,1H),5.42(m,2H);13C NMR(125 MHz, CDCl3):14.0, 21.2, 22.7, 25.4, 27.6, 27.8, 28.7-29.7 (7C), 31.9, 40.3, 64.7, 130.6 (2C), 169.8;HRMS(ESI)m/z:calcd for [M+H]+C19H35BrO2,330.2326;found,330.2323。
2.2 EAG活性测定
不同剂量处理下陌夜蛾雄蛾触角对8种性信息素类似物的EAG响应值如表1。结果表明,不同剂量性信息素类似物均能引起陌夜蛾雄蛾触角的电生理响应,其中,有5个类似物的响应值具有较好的剂量-效应关系。陌夜蛾雄蛾触角对氟代类似物M7的响应最为强烈,在100 μg剂量下响应值最高,达到2.36 mV,是同剂量条件下11-16:Ac响应值的77.9%。其次为溴代类似物M8,在1 000 μg剂量下相对响应值达到2.22 mV。在其他具有较好剂量-效应关系的类似物中,类似物M1的整体相对响应值最为强烈,M6和M2仅次于M1。而M3—M5在10—1 000 μg剂量下,陌夜蛾雄蛾的EAG响应值显著低于性信息素组分11-16:Ac(<0.05),其中M5的EAG响应整体表现最差,最高相对响应值仅为性信息素组分的21.2%。

表1 陌夜蛾雄蛾对性信息素及类似物的EAG响应
表中数据均以平均值±标准误表示,数据后不同小写字母表示同一化合物不同剂量处理下差异显著(<0.05)。表2同
The data in the table are expressed as mean±SE, and different lowercase letters after the data indicate significant differences among different doses of the same compound (<0.05). The same as Table 2
2.3 利用性信息素监测陌夜蛾成虫种群动态
采用性信息素监测陌夜蛾的种群动态变化如图4所示,成虫始见于5月初,自5月10日开始,先后经历两个高峰期,分别为7月6—21日和9月16—22日,诱捕量在达到高峰期后逐渐下降,在8月中旬诱捕数量达到最低,进入10月后诱捕数量逐渐减少。推测陌夜蛾在5—6月以越冬蛹形态存在,7月末到8月中旬以幼虫形态存在。
2.4 添加不同剂量性信息素类似物田间诱捕试验
田间试验结果表明,不同结构类型的性信息素类似物引诱活性不同,同一类似物不同剂量之间引诱活性也存在一定差异。陌夜蛾性信息素及添加不同剂量类似物的田间平均诱蛾量见表2,其中,类似物M1和M5在添加剂量为1 μg时,单个诱捕器平均诱捕量分别为38.00和35.67头/诱捕器/15 d,与性信息素对照SP相比存在显著差异(图5)。类似物M7在添加剂量为100 μg时,平均诱捕量为29.67头/诱捕器/15 d,显著高于SP(12.67头/诱捕器/15 d),其他添加剂量与SP无显著差异。对于类似物M4,随着其添加剂量的增加,平均诱捕量逐渐减少。当添加剂量为1 000 μg时,平均诱捕量仅有3.33头/诱捕器/15 d,显著低于SP(16.67头/诱捕器/15 d)。其他添加剂量下诱捕量也有不同程度的下降。说明类似物M1、M5和M7具有显著的增效活性,可以作为性信息素的增效剂,而类似物M4对性信息素有显著的抑制作用,可以作为性信息素的抑制剂发挥作用。此外,添加不同剂量类似物M2、M3、M6和M8与性信息素对照相比平均诱蛾量无显著差异。
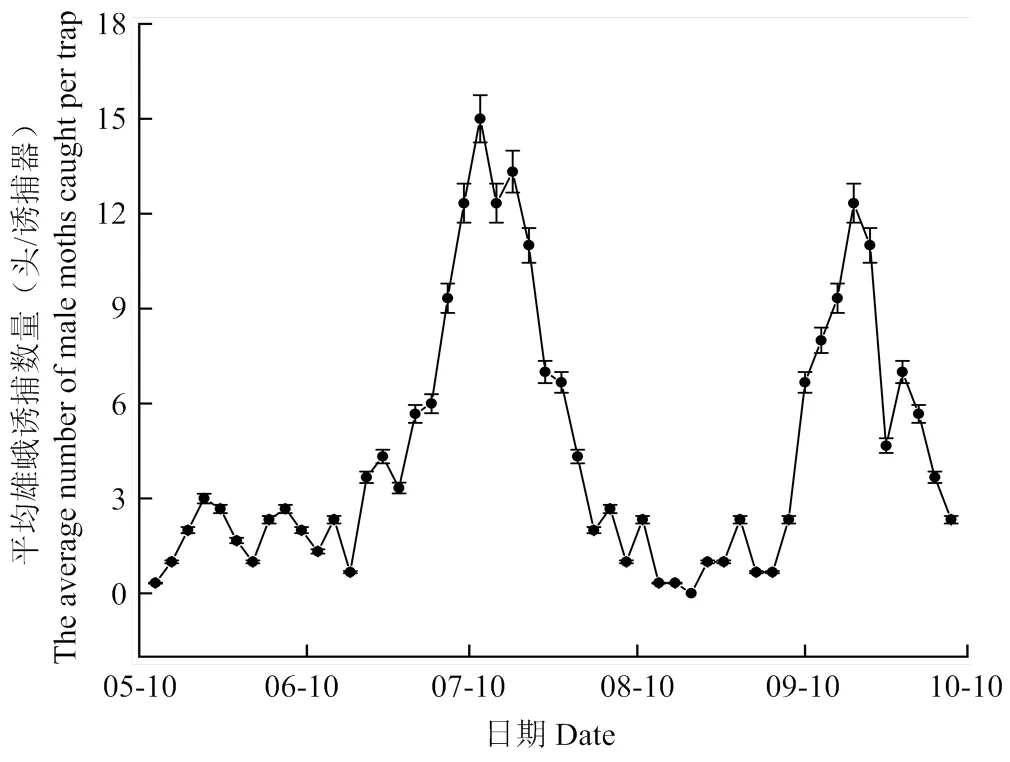
图4 利用性信息素监测陌夜蛾成虫种群动态

表2 陌夜蛾性信息素及类似物的田间诱蛾量

图5 性信息素SP和添加一定剂量类似物M1、M5的田间诱蛾效果
3 讨论
3.1 性信息素结构与活性的关系
昆虫性信息素及其类似物的开发与应用,是研究性信息素感知和分解代谢过程分子机制的关键途径,也是开展害虫绿色综合防控的重要手段[25]。因其生态友好,不易产生残留、抗性、再猖獗的“3R”现象等显著优势而在世界范围内被广泛应用[26]。目前,世界各地已有约700种蛾类的雌性信息素被成功鉴定,上千种昆虫性信息素得到了研究,百余种昆虫性信息素商品化,每年约数千万诱芯用于昆虫种群数量监测和大规模诱捕[27-28]。
鳞翅目幼虫多为植食性,可危害多种作物并造成重大危害,数十年来,其性信息素系统已经被广泛研究。根据昆虫性信息素化学结构的不同可将其分为TypeⅠ、TypeⅡ、TypeⅢ、Type0 4种类型,其中约75%的已知鳞翅目性信息素属于TypeⅠ类,结构为C10—C18直链不饱和脂肪醇、醛、乙酸酯类化合物,夜蛾科昆虫性信息素也多属此类[29-31]。近年来,随着研究人员对昆虫性信息素研究的深入,性信息素类似物作为一种环境友好的有害生物防治方法已被大量报道。WITZGALL等[32]研究表明,在葡萄小食心虫()的性信息素主要组分顺-9-十二碳烯乙酸酯(9-12:Ac)的基础上添加微量的类似物顺-11-十四碳烯乙酸酯(11-14:Ac)后诱捕效果显著提升,而加入少量的类似物顺-9-十二碳烯-1-醇(9-12:OH)则会导致诱捕量显著降低,为利用性信息素及其类似物防治葡萄小食心虫提供了新的思路;MUÑOZ等[33]对梨豹蠹蛾()的性信息素进行三氟甲基化处理后发现,性信息素与类似物混用后相比于单独性信息素处理组诱捕量明显降低。氨基甲酸酯类性信息素类似物由于具有杀虫剂的结构,可能对昆虫触角酯酶有一定的抑制作用。ALBANS等[34]以烟芽夜蛾()性信息素的主要组分顺-11-十六碳烯醛(11-16:Ald)为母体结构,设计合成氨基甲酸酯类性信息素类似物顺-9-十四碳烯-1-醇-N-甲基氨基甲酸酯。研究发现其对天然性信息素存在显著抑制作用,并且这种抑制作用是基于受体与性信息素的羰基之间的相互作用实现的;董梦雅[35]在对小菜蛾()性信息素拮抗剂的研究中发现,不含双键的性信息素类似物的生物活性明显低于同类含不饱和键的性信息素类似物,说明双键在维持性信息素的生物活性中存在重要的作用。因此,本研究选择在陌夜蛾性信息素主要组分11-16:Ac的原始双键位置以及酯基结构不变的基础上,对其极性基团部分进行3种结构修饰,分别为引入氨基甲酸酯、引入不饱和键以及卤素原子修饰,以期能够通过结构-活性关系筛选到具有理想生物活性的性信息素增效剂和抑制剂,协同性信息素对陌夜蛾的防控起到一定有益效果。
3.2 陌夜蛾性信息素类似物的合成与筛选
本研究中陌夜蛾性信息素类似物的合成主要选用相应性信息素组分的前体醇11-16:OH为原料,在缚酸剂和催化剂的作用下,与酸酐或酰氯发生反应合成相应的性信息素类似物。方法原料易得,合成路线简单且产率较高。试验过程中为保证原料反应完全,醇与酸酐或酰氯的摩尔比设置为1.0﹕1.5,同时由于酸酐和酰氯易水解,溶剂需提前做除水处理。经过试验表明,在醇与酸酐的反应中添加少量的DMAP可以作为催化剂加快反应速率和反应完全度。在进行氨基甲酸酯类性信息素类似物合成中,由于其反应活性较低,二氯甲烷为溶剂,三乙胺为缚酸剂的反应体系中酯化反应几乎不能发生,因此选用N, N-二甲基甲酰胺为溶剂,采用K2CO3为缚酸剂,碱性的增强一方面促进了氮氢键的活化有利于反应,另一方面以无机碱替代有机碱也能够减少发生副反应的可能,增加产率[36]。在进行含卤素的性信息素类似物合成时,由于氟原子在空间大小上与氢原子相似,且拥有更强的电负性,提高了分子的极性,因此氟代类似物的产率高于溴代类似物。合成醛类类似物时,由于底物反应不够充分,因此产率较低。
在对类似物进行触角电生理试验时,大多数类似物的相对响应值在低剂量下与性信息素没有显著差异,可能是由于浓度较低,昆虫触角上的性信息素结合蛋白结合的性信息素分子较少,导致EAG响应活性较弱[37]。而氨基甲酸酯类性信息素类似物整体EAG活性较差(表1),推测可能由于化合物本身挥发性较低,在相同剂量下未能激发显著的电生理响应。类似物M5的整体EAG响应活性表现较差(表1),但在田间添加试验中,却表现出显著的增效活性(表2)。故要确定性信息素及其类似物的生物活性和性诱剂的诱蛾效果还需要结合有效的田间试验进行实践验证[38-40]。
田间试验中性信息素类似物的添加剂量、比例、田间施用参数等都会对田间诱蛾效果产生影响。明确性信息素类似物的施用密度和剂量可以使害虫防治更具有针对性。如本文中当性信息素类似物添加剂量小于0.1 μg时,由于剂量较低,覆盖面积不够,导致持效期缩短,因此诱捕数量与性信息素诱芯诱捕量几乎没有显著差异。而当剂量为1 000 μg时,由于性信息素类似物在田间低密度、高剂量释放,则会导致雄虫的触角长时间接触高浓度的性信息素而处于麻痹状态,失去对雌虫的性召唤反应能力,进而干扰陌夜蛾雌雄昆虫之间的通讯系统,使害虫迷向。此外,田间施用参数中诱捕器类型、缓释材料组合、诱芯悬挂高度、密度等对诱蛾效果也有一定影响。由于时间及虫量等因素,本试验对于诱芯悬挂高度以及密度并没有做系统的筛选,这也是今后的研究方向之一。
4 结论
通过对陌夜蛾性信息素主要组分的乙酸酯部分进行结构修饰合成了6种具有不同生物活性的性信息素类似物,并在室内和田间分别对购买的M1、M2以及所合成的性信息素类似物M3—M8进行了活性验证和筛选,结果表明,类似物M1、M5和M7具有显著增效活性,可以作为性信息素增效剂发挥作用;类似物M4具有显著抑制活性,可以作为性信息素抑制剂发挥作用。研究结果可为陌夜蛾的种群动态监测以及生物防治提供新手段。
[1] CRAIK C. Mother Shipton’s little secret. Bulletin of the American Entomologists’ Society, 2018, 77(531): 260-266.
[2] DING J Q, FU W D, REARDON R, WU Y, ZHANG G L. Exploratory survey in China for potential insect biocontrol agents of mile-a-minute weed,L., in eastern USA. Biological Control, 2004, 30(2): 487-495.
[3] FAROOQ S, REHMAN R U, PIRZADAH T B, MALIK B, DAR F A, TAHIR I. Cultivation, agronomic practices, and growth performance of buckwheat//Molecular Breeding and Nutritional Aspects of buckwheat. Academic Press, 2016: 299-319.
[4] VELJKOVIĆ M. Contribution to the knowledge of butterfly and moth fauna (Insecta: Lepidoptera) of Gornje Plavnice, Bjelovar, Croatia - result of a one year photographic study. Natura Croatica, 2019, 28(2): 345-358.
[5] NOWACKI J, PAŁKA K. Noctuid moths (Lepidoptera: Noctuoidea: Nolidae, Erebidae, Noctuidae) of the Nowa Dęba Military training area in the Sandomierz Primeval Forest (south-eastern Poland). Fragmenta Faunistica, 2015, 58(1): 21-36.
[6] SZANYI S, NAGY A, MOLNÁR A, KATONA K, TÓTH M, VARGA Z. Night-active Macroheterocera species in traps with synthetic attractants in the Velyka Dobron’ Game Reserve (Ukraine, Transcarpathia). Acta Zoologica Academiae Scientiarum Hungaricae, 2017, 63(1): 97-114.
[7] MIN H K, YOON S J, JUNG S H, LIM J T, RYU J W, NAM S C, CHO Y B. Insect diversity of Dadohae marine National Park, Jeonnam Province, Korea. Journal of Korean Nature, 2009, 2(1): 19-25.
[8] SAKAGAMI K, SUGIURA S. A diverse assemblage of moths feeding on aphid honeydew. Journal of Asia-Pacific Entomology, 2018, 21(1): 413-416.
[9] RICCUCCI M, LANZA B. Bats and insect pest control: a review. Vespertilio, 2014, 17: 161-169.
[10] SATO J J, OHTSUKI Y, NISHIURA N, MOURI K. DNA metabarcoding dietary analyses of the wood mouseon Innoshima Island, Japan, and implications for primer choice. Mammal Research, 2022, 67(1): 109-122.
[11] CHOI J K, LEE J W. Five new records of the subfamily Campopleginae (hymenoptera: Ichneumonidae) from south Korea. Animal Systematics, Evolution and Diversity, 2018, 34(1): 27-36.
[12] POLTAVSKY A N, MATOV A Y, IVLIEV P P. Heteroceran moths (Lepidoptera, Heterocera) of the Don River Delta. Entomological Review, 2009, 89(9): 1072-1081.
[13] 马好运, 李慧, 王留洋, 翁爱珍, 赵红盈, 梅向东, 折冬梅, 宁君. 银纹夜蛾性信息素类似物的合成与活性研究. 现代农药, 2020, 19(5): 15-19.
MA H Y, LI H, WANG L Y, WENG A Z, ZHAO H Y, MEI X D, SHE D M, NING J. Synthesis and activity of sex pheromone analogues of(Staudinger). Modern Agrochemicals, 2020, 19(5): 15-19. (in Chinese)
[14] WEBER D C, MORRISON W R, KHRIMIAN A, RICE K B, LESKEY T C, RODRIGUEZ-SAONA C, NIELSEN A L, BLAAUW B R. Chemical ecology of: discoveries and applications. Journal of Pest Science, 2017, 90: 989-1008.
[15] MARTINAZZO J, BALLEN S C, STEFFENS J, STEFFENS C. Sensing of pheromones from(F.) stink bugs by nanosensors. Sensors and Actuators Reports, 2022, 4: 100071.
[16] RENOU M, GUERRERO A. Insect parapheromones in olfaction research and semiochemical-based pest control strategies. Annual Review of Entomology, 2000, 45: 605-630.
[17] 王安佳, 张开心, 梅向东, 高玉林, 张涛, 折冬梅, 宁君. 昆虫性信息素及其类似物干扰昆虫行为的机理和应用研究进展. 农药学学报, 2018, 20(4): 425-438.
WANG A J, ZHANG K X, MEI X D, GAO Y L, ZHANG T, SHE D M, NING J. Research progress on mechanisms and applications of insect mating behavior disruption by insect sex pheromones and analogues. Chinese Journal of Pesticide Science, 2018, 20(4): 425-438. (in Chinese)
[18] SOLARI P, CRNJAR R, FRONGIA A, SOLLAI G, SECCI F, SPIGA M, MASALA C, LISCIA A. Oxaspiropentane derivatives as effective sex pheromone analogues in the gypsy moth: electrophysiological and behavioral evidence. Chemical Senses, 2007, 32(8): 755-763.
[19] REDDY G V P, GUERRERO A. New pheromones and insect control strategies. Vitamins and Hormones, 2010, 83: 493-519.
[20] SVATOŠ A, KALINOVÁ B, BOREK V, VRKOČ J.(Lepidoptera, Tortricidae) response to halogenated analogues of (E8, E10)-dodecadien-1-yl acetate. Acta Entomologica Bohemoslovaca, 1990, 87(5): 393-395.
[21] BENGTSSON M, RAUSCHER S, ARN H, SUN W C, PRESTWICH G D. Fluorine-substituted pheromone components affect the behavior of the grape berry moth. Experientia, 1990, 46(11/12): 1211-1213.
[22] HOSKOVEC M, KALINOVÁ B, KONEČNÝ K, KOUTEK B, VRKOČ J. Structure-activity correlations among analogs of the currant clearwing moth pheromone. Journal of Chemical Ecology, 1993, 19(4): 735-750.
[23] 王洋, 刘红霞, 荆小院, 窦蕊, 宗彦平, 刘金龙. 两种鳞翅目螟蛾科昆虫性信息素组分的合成. 化学与生物工程, 2021, 38(2): 22-25.
WANG Y, LIU H X, JING X Y, Dou R, Zong Y P, Liu J L. Synthesis of two kinds of insect sex pheromone components in Lepidoptera: Pyralidae. Chemistry and Bioengineering, 2021, 38(2): 22-25. (in Chinese)
[24] 李慧, 尹士采, 郭宗香, 马好运, 任梓齐, 折冬梅, 梅向东, 宁君. 宽胫夜蛾性信息素类似物的合成及其生物活性. 中国农业科学, 2022, 55(9): 1790-1799.
LI H, YIN S C, GUO Z X, MA H Y, REN Z Q, SHE D M, MEI X D, NING J. Synthesis and bioactivity of sex pheromone analogues of. Scientia Agricultura Sinica, 2022, 55(9): 1790-1799. (in Chinese)
[25] 郑丽霞, 吴兰花, 余玲, 吴伟坚, 魏洪义. 昆虫类信息素研究进展及应用前景. 植物保护学报, 2018, 45(6): 1185-1193.
ZHENG L X, WU L H, YU L, WU W J, WEI H Y. Advances in the research and application prospects of insect parapheromones. Journal of Plant Protection, 2018, 45(6): 1185-1193. (in Chinese)
[26] SHAO X, LI Z, QIAN X. Research and development of green pesticides in China//Recent Highlights in the Discovery and Optimization of Crop Protection Products. Academic Press, 2021: 39-64.
[27] ANDO T, YAMAMOTO M. Semiochemicals containing lepidopteran sex pheromones: Wonderland for a natural product chemist. Journal of Pesticide Science, 2020, 45(4): 191-205.
[28] WITZGALL P, KIRSCH P, CORK A. Sex pheromones and their impact on pest management. Journal of Chemical Ecology, 2010, 36(1): 80-100.
[29] MILLAR J G. Polyene hydrocarbons and epoxides: a second major class of lepidopteran sex attractant pheromones. Annual Review of Entomology, 2000, 45: 575-604.
[30] VICKERS N J. Pheromone communication in moths: evolution, behavior, and application. Animal Behaviour, 2018, 135: 237-238.
[31] YUVARAJ J K, CORCORAN J A, ANDERSSON M N, NEWCOMB R D, ANDERBRANT O, LÖFSTEDT C. Characterization of odorant receptors from a non-ditrysian moth,sheds light on the origin of sex pheromone receptors in Lepidoptera. Molecular Biology and Evolution, 2017, 34(11): 2733-2746.
[32] WITZGALL P, BENGTSSON M, TRIMBLE R M. Sex pheromone of grape berry moth (Lepidoptera: Tortricidae). Environmental entomology, 2000, 29(3): 433-436.
[33] MUÑOZ L, BOSCH M P, BATLLORI L, ROSELL G, BOSCH D, GUERRERO A, AVILLA J. Synthesis of allylic trifluoromethyl ketones and their activity as inhibitors of the sex pheromone of the leopard moth,L. (Lepidoptera: Cossidae). Pest Management Science, 2011, 67(8): 956-964.
[34] ALBANS K R, BAKER R, JONES O T, JUTSUM A R, TURNBULL M D. Inhibition of response ofto its natural pheromone by antipheromones. Crop Protection, 1984, 3(4): 501-506.
[35] 董梦雅. 小菜蛾性信息素拮抗剂的合成及活性研究[D]. 北京: 中国农业科学院, 2016.
DONG M Y. Synthesis and activity evaluation of sex pheromone antagonist of[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[36] 杨利, 梁峰, 周翔, 吴成泰.,,-三(异丙基)-1,4,7-三氮杂环壬烷的合成改进. 化学试剂, 2006, 28(1): 51-52.
YANG L, LIANG F, ZHOU X, WU C T. Improvement in the synthesis of,,-tri (isopropyl)-1,4,7-triazacyclononane. Chemical Reagents, 2006, 28(1): 51-52. (in Chinese)
[37] 田志强, 孙丽娜, 李艳艳, 张怀江, 闫文涛, 岳强, 全林发, 仇贵生. 昆虫性信息素结合蛋白功能研究进展. 农学学报, 2017, 7(9): 14-20.
TIAN Z Q, SUN L N, LI Y Y, ZHANG H J, YAN W T, YUE Q, QUAN L F, QIU G S. Research progress of the function of sex pheromone binding protein in insects. Journal of Agriculture, 2017, 7(9): 14-20. (in Chinese)
[38] 王桂花, 吕宝乾, 金启安, 温海波, 彭正强, 易克贤, 章程辉. 几种植物气味挥发物与性信息素组合对棉铃虫触角电位反应的影响. 热带作物学报, 2013, 34(9): 1781-1785.
WANG G H, LÜ B Q, JIN Q A, WEN H B, PENG Z Q, YI K X, ZHANG C H. Effects of the combination of plant volatiles and sex pheromone to electroantennogram responses of. Chinese Journal of Tropical Crops, 2013, 34(9): 1781-1785. (in Chinese)
[39] YANG L, LIU Y, RICHOUX G M, BERNIER U R, LINTHICUM K J, BLOOMQUIST J R. Induction coil heating improves the efficiency of insect olfactory studies. Frontiers in Ecology and Evolution, 2019, 7: 247.
[40] VANG L V, THY T T, HANH D K, LINH T P, YAMAMOTO M, ANDO T. Sex pheromone analysis and effective attraction of males of the cabbage webworm,, inhabiting the Mekong Delta of Vietnam. Journal of Asia-Pacific Entomology, 2020, 23(4): 935-941.
Synthesis and Bioactivity of Sex Pheromone Analogues of
REN ZiQi1,2, KANG YuJie3, LI HaiZhen4, WANG LianGang4, MA HaoYun1, LI Hui1, WANG LiuYang1, MEI XiangDong1, NING Jun1
1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193;2College of Life Sciences, Northeast Forestry University/Key Laboratory of Saline-alkali Vegetation Ecology Restoration, Ministry of Education, Harbin 150040;3Plant Protection Section, Pingdu Bureau of Agriculture and Rural Affairs, Qingdao 266799, Shandong;4Qingdao Agricultural Technology Extension Center, Qingdao 266299, Shandong
【Background】is an important leaf-eating pest, which has caused great harm to agriculture and forestry in north China, east China, and other regions in recent years due to its increasing numbers and the level of hazards, especially posing a serious threat to the yield of crops such as buckwheat.【Objective】Based on the maternal structure ()-hexadec-11-en-1-yl acetate (11-16:Ac), which is the main component of the sex pheromone of, six sex pheromone analogues with different bioactivities were synthesized. The aim was to open up a novel environment-friendly control strategy for the comprehensive treatment of.【Method】As the raw material, the sex pheromone precursor ()-hexadec-11-en-1-ol (11-16:OH) was used to react with an acid anhydride or acyl chloride under the action of an acid binding agent and catalyst. After being separated and purified by silica gel column chromatography, a total of six synthetic pheromone analogues were obtained, including M3 and M4, the sex pheromone analogues with carbamate polar groups, M5 and M6, the sex pheromone analogues with the unsaturated bond at the end of the polar group, and sex pheromone analogues M7 and M8 with halogen atom modification. The electrophysiological response values under direct stimulation of different doses with sex pheromone analogues were measured by the EAG test, and the biological activities of sex pheromone analogues were verified in field experiments conducted in Yanqing, Beijing in 2021.【Result】The EAG test showed that analogues M1, M2, M6, M7, and M8 had significant dose-dependent relationships. In particular,showed the strongest response to analogue M7, with a response value of 2.36 mV at the dose of 100 μg, which was 77.9% of that of the response value of11-16:Ac at the same dose. While there were significant differences (<0.05) between the relative response values of M3-M5 and sex pheromone components11-16:Ac at the doses of 10-1 000 μg. The M5 displayed lowest EAG response and the highest relative response value was only 21.2% of the sex pheromone fraction. As shown in the field trials, the average capture amount of analogues M1 and M5 was 38.00 and 35.67 moths/trap/15 d at an addition of 1 μg, respectively, which was significantly different compared with the sex pheromone control. The analogue M7 trapped 29.67 moths/trap/15 d at an addition of 100 μg, which was also significantly higher than that of the sex pheromone control. The analogue M4 showed potential inhibitory activity against sex pheromone, and the average capture amount decreased gradually with the increase of its addition, the average capture amount was only 3.33 moths/trap/15 d at the dose of 1 000 μg.【Conclusion】The EAG tests and field trials verified that the analogues M1, M5, and M7 showed significant synergistic activity and could be developed as synergists of sex pheromones. The analogue M4 showed significant inhibitory activity, which could be used as an inhibitor of sex pheromones. This study provides a necessary theoretical basis for the use of sex pheromone analogues to controlin a green way.
; sex pheromone analogue; chemical synthesis; bioactivity; field application

10.3864/j.issn.0578-1752.2022.23.006
2022-07-13;
2022-08-14
国家重点研发计划(2021YFD1400200)
任梓齐,E-mail:445921744@qq.com。通信作者梅向东,E-mail:xdmei@ippcaas.cn。通信作者宁君,E-mail:jning@ippcaas.cn
(责任编辑 岳梅)

