鸡Wnt3a的SNPs筛选及其与皮肤毛囊密度性状关联分析
屠云洁,姬改革,章明,刘一帆,巨晓军,单艳菊,邹剑敏,李华,陈智武,束婧婷
鸡的SNPs筛选及其与皮肤毛囊密度性状关联分析
屠云洁1,姬改革1,章明1,刘一帆1,巨晓军1,单艳菊1,邹剑敏1,李华2,陈智武3,束婧婷1
1江苏省家禽遗传育种重点实验室,江苏省家禽科学研究所,江苏扬州 225125;2佛山科技学院,广东佛山 528225;3广西金陵农牧集团有限公司,南宁 530000
【目的】Wnt信号通路在动物皮肤毛囊的发生发育中具有重要作用,前期研究结果表明可能是影响鸡皮肤毛囊密度性状的重要候选基因。为进一步验证在皮肤毛囊生长发育中的作用,研究以金陵花鸡为研究对象,筛选SNPs,并分析其与毛囊密度性状的相关性,以期找到对皮肤毛囊密度有显著影响的分子标记,为培育屠体美观的屠宰型肉鸡的“分子编写育种”提供参考。【方法】采用PCR扩增直接测序法对的SNPs位点进行筛查,分析单个SNP标记与皮肤毛囊密度性状的相关性。采用Haploview软件分析这些SNP位点的连锁不平衡(LD)程度,并分析不同单倍型组合与毛囊密度性状的相关性。【结果】共发现14个SNP位点,在第2外显子发现1个SNP位点(SNP1),为同义突变;第2内含子发现4个突变位点( SNP2—SNP5),在第3内含子发现9个SNP位点(SNP6—SNP14)。卡方检验表明,第2外显子的1个突变位点(SNP1)和第2内含子的3个突变位点(SNP3—SNP5)的3个位点均处于哈代-温伯格平衡状态(>0.05),第3内含子的9个SNPs(SNP6-SNP14)偏离哈代-温伯格平衡(<0.05)。SNP1—SNP5的均小于0.50,均小于0.25,这5个SNP位点遗传多样性较低。第3内含子的9个突变位点,SNP6、SNP7、SNP9位点<0.25,其他6个突变位点 0.25<<0.5,为中度多态。单标记关联分析表明,公、母鸡SNP2位点的AG基因型的毛囊密度显著高于GG基因型(<0.05);母鸡SNP8位点的AA与GG基因型的毛囊密度显著高于AG基因型(<0.05),在公鸡中3种基因型的毛囊密度差异不显著。14个SNPs连锁不平衡分析表明,SNP3、SNP4和SNP5的强连锁产生了2种单倍型,H1(GAT)频率为0.882和H2(TCC)频率为0.118;SNP6—SNP13之间的强连锁产生了5种单倍型,其中H1(ACATTATC)和H2(ACGTCCCA),H3(ACGTTCCA),H4(GTGCTATA),H5(ACGTCCCC),单倍型频率分别为0.469、0.275、0.123、0.113、0.014。SNP3、SNP4和SNP5连锁产生的2 种单倍型组合后产生了3种单倍型组合,关联分析发现在公、母鸡中3种单倍型组合的毛囊密度均差异不显著;将SNP6—SNP13连锁产生的5种主要单倍型组合后,公鸡有7种组合单倍型组合,毛孔数量差异不显著;母鸡有8种主要单倍型组合,其中H1H1(AACCAATTTTAATTCC)毛囊密度最大。SNP2和SNP8位点与皮肤毛囊密度显著相关,单倍型组合H1H1(AGAA)、H1H2(AGAG)为母鸡优势单倍型。【结论】筛选到的14个SNPs位点,其中,SNP2(rs2587721 G>A)和SNP8(rs2555967G>A)位点与毛囊密度显著相关,8个SNPs(SNP6—SNP13)位点处于强连锁不平衡,母鸡H1H1单倍型毛囊密度最大。的SNP2和SNP8位点的单倍型组合H1H1(AGAA)、H1H2(AGAG)和SNP6—SNP13连锁产生的H1H1(AACCAATTTTAATTCC)单倍型组合与母鸡毛囊密度显著相关,可以为鸡毛囊密度“分子编写育种”提供重要遗传信息。
鸡;;皮肤毛囊;SNP位点;连锁不平衡
0 引言
【研究意义】近年来,随着禽流感事件和新冠疫情对家禽行业负面影响的加重和大众对食品安全的重视,家禽行业进入重要变革时期。活鸡市场的逐步关闭、屠宰后冷鲜上市已经成为不可逆转的趋势[1-2]。鸡屠体外观逐渐成为消费者的关注重点,其中皮肤毛孔更是屠体外观关注的重点,受到育种工作者越来越多的重视[3-4]。【前人研究进展】冰鲜鸡具有毛孔细密、皮肤紧实度好的特征,更受到消费者的青睐。毛囊密度直接影响鸡的屠体外观[5-7]。毛囊密度发育受Wnt、Edar 等信号通路和、、、等基因调控[5-10],其中Wnt信号通路在鸡、鹅等家禽的毛囊密度发育过程中发挥重要作用[11-16]。Wnt家族成员3a()是Wnt信号通路中的重要成员,在毛囊的生长发育中具有重要作用[17-18]。对鸡毛囊的大小起到重要作用[6,15-16],能够增加真皮厚度,扩大了脊髓束大小,减少了芽间域间距,同时影响鸟类羽毛类型[19],对黄羽肉鸡胚胎期羽囊形态发生起到重要调控作用[20]。【本研究切入点】笔者前期研究发现,表达和SNPs在鸡不同部位皮肤毛囊密度差异的皮肤组织中具有显著差异,推测可能是影响鸡皮肤毛囊密度性状的重要候选基因[15-16]。【拟解决的关键问题】为进一步验证在皮肤毛囊生长发育中的作用,筛选的SNPs位点,分析多态位点与鸡毛囊密度的关联性,找出对毛囊密度有显著效应的SNP标记,以期为进一步深入研究在皮肤毛囊生长发育中的作用机制提供基础资料,为培育屠体美观的屠宰型肉鸡的“分子编写育种”研究提供参考。
1 材料与方法
1.1 试验时间与地点
2021年1—2月在广西金陵农牧集团有限公司饲养金陵花鸡、翅静脉采血、屠宰和毛囊密度测定统计。2021年3—5月由江苏省家禽科学研究所家禽遗传育种重点实验室科研人员开展金陵花鸡PCR扩增试验。
1.2 试验动物及样品采集
金陵花鸡来自广西金陵农牧集团有限公司培育的优质肉鸡配套系,选取1 000个种蛋入孵,饲养至上市日龄(7周龄),随机选择金陵麻鸡382只(公162只,母220只),记录脚号,并进行翅下静脉采血1 mL,ACD抗凝,混匀后放入-20℃冰箱保存备用。
1.3 毛囊密度数据的测定
毛囊密度统计方法:7周龄382只金陵花鸡屠宰拔毛后,以背中线为轴,统计左侧背部皮肤2 cm×2 cm=4 cm2面积内毛囊的数目,所有毛囊密度均由同一人测量,所测部位基本一致[15]。公、母鸡背部毛囊密度测定方法见图1。

图1 公、母鸡背部毛囊密度测定方法
1.4 主要试剂和仪器
DYY-6D型电泳仪,离心机,涡旋振荡器,梯度 PCR 仪,凝胶成像系统(Tanon 2500)、紫外分光光度计(NanoDrop One)。Loadingbuffer,1.5%的琼脂糖凝胶,TBE电泳液,PCR八连管,无菌超纯水。
1.5 引物设计与合成
根据GenBank登录号:NC_006089DNA序列,设计部分外显子和内含子序列PCR引物,-1(F:CACGGAGGAACTGAAGATGC,R:TGAAATTCAGTCCTGTCTCCAC)、-2(F:GTCCATGCCATCGCCTCTG,R:TCCTACACCCA GG TACACATAGG),PCR产物长度分别为480、593 bp,引物由生工生物工程(上海)股份有限公司合成。
1.6 Wnt3a PCR扩增与测序
采用全血基因组DNA提取试剂盒(DP348),提取的DNA溶于超纯水中。PCR扩增反应。PCR总反应体系50 μL:DNA模板2 μL,dNTP(2 mmol/L)4 μL,Mg2+(3 mmol·L-1)0.6 μL,1×PCR反应缓冲液5 μL,上、下游引物(10 μmol·L-1)各1 μL,聚合酶(1U·μL-1)2.5 μL,补超纯水至50 μL。PCR反应程序:95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸5 min。PCR扩增目的片段用1.5%的琼脂糖凝胶电泳检测。PCR产物送生工生物工程(上海)股份有限公司进行测序。
1.7 SNP位点确定、基因分型和遗传多态性分析
通过DNAMan6.0进行比对,并用Chromas软件(Ver.1.6.0)筛查SNP位点。针对SNP位点测序峰图,对382个个体基因分型。利用PopGene(version 1.31)统计各个SNP位点基因型频率、基因频率、杂合度()和多态信息含量()。对所有SNP位点利用Hapoview4.1进行连锁不平衡分析,利用卡方检验(c2)检测SNP位点是否处Hardy-Weinberg(H-W)平衡状态。
1.8 Wnt3a SNP位点与毛囊密度相关性分析
以SPSS 16.0软件的一般线性模型中单变量方差分析进行位点3种基因型与鸡毛囊密度性状关联分析,结果用平均值±标准误表示。固定因子:SNP标记的不同基因型,因变量:毛囊密度,采用LSD法多重比较不同标记基因型之间毛囊密度的差异显著性,<0.05表示差异显著。SNP位点两种基因型与鸡毛囊密度性状关联分析采用独立样本T检验法,比较不同基因型之间毛囊密度的差异显著性,<0.05表示差异显著。
2 结果
2.1 金陵花鸡公母鸡毛囊密度统计
金陵花鸡公母鸡毛囊密度统计结果见表1。可见,金陵花鸡母鸡毛囊密度显著高于公鸡。
2.2 Wnt3a SNP位点的测序峰图和突变类型
SNP位点的相应位置通过“http://asia. ensembl.org/index.html?redirect=no”查找。14个SNP位点不同基因型的测序峰图见图2。在第2外显子发现1个SNP位点SNP1(rs2587569 G>A),为同义突变;第2内含子发现4个突变位点,分别为SNP2(rs2587721G>A), SNP3(rs2587832G>T), SNP4(rs2587845 位点A>C), SNP5(rs2587849T>C)。在第3内含子发现9个SNP位点,分别为SNP6(rs2555891 G>A),SNP7(rs2555961 T>C),SNP8(rs2555967G>A),SNP9(rs2556041 C>T),SNP10(rs2556078 T>C),SNP11(rs2556088A>C),SNP12(rs2556093T>C),SNP13(rs2556109 A>C),SNP14(rs2556178 G>T)。

表1 金陵花鸡公、母鸡毛囊密度比较
同列不同小写字母表示毛囊密度差异显著(<0.05)
Different lowercase letters in the same column indicate that the skin feather follicle density is significantly different (<0.05)
2.3 Wnt3a SNP位点的遗传多态性分析
由表2可知,14个SNP位点中,除了SNP2位点在金陵花鸡群体中有2种基因型,其他13个SNP位点均有3种基因型。每个SNP位点不同基因型频率不同。
经H-W平衡检测,SNP1位点(在第2外显子)和SNP3、SNP4和SNP5(在第2内含子)均处于H-W平衡状态(>0.05),SNP6—SNP14(在第3内含子)偏离H-W平衡(<0.05)。SNP1—SNP5这5个SNP位点遗传多样性较低,因为<0.50,<0.25。第3内含子的9个突变位点,除了SNP6、SNP7、SNP9位点<0.25,其他6个突变位点 0.25<<0.5,为中度多态。
2.4 单标记与皮肤毛囊密度性状的关联分析
的14个SNPs位点与背部皮肤毛囊密度的关联性分析结果表明,除了SNP2和SNP8,其他12个SNP位点的毛囊密度无显著差异。SNP2(rs2587721)位点在公、母鸡中均是AG基因型的毛囊密度显著高于GG基因型(<0.05);SNP8(rs2555967)位点在母鸡中AA与GG基因型的毛囊密度显著高于AG基因型(<0.05),在公鸡中3种基因型的毛囊密度差异不显著。
2.5 连锁不平衡分析
连锁不平衡分析结果见图3。图3-A方框中的数值为D’值乘以100后得到。可见,金陵花鸡的14个SNP位点构建了2个连锁不平衡(LD)Block(单倍型区块)。Block1由8个SNP位点(SNP6—SNP13)构成,D’值处于0.88—1之间,Block2由3个SNPs位点(SNP3-SNP5)构成,D’值均为1。根据文献报道,当D’值>0.8 和2>0.33时表示SNPs位点间存在强连锁不平衡[21-22],本研究两个单倍区块型两两SNP之间的2值在0.944—1.0之间,表明SNP6—SNP13之间存在强连锁不平衡,SNP3—SNP5存在强连锁不平衡。由图3-B可知,SNP3、SNP4和SNP5的强连锁产生了2种单倍型,H1(GAT)频率为0.882和H2(TCC)频率为0.118;SNP6、SNP7、SNP8、SNP9、SNP10、SNP11、SNP12、SNP13、SNP14之间的连锁产生了5种单倍型,其中H1(ACATTATC)、H2(ACGTCCCA)、H3(ACGTTCCA)、H4(GTGCTATA)、H5(ACGTCCCC)单倍型频率分别为0.469、0.275、0.123、0.113、0.014。
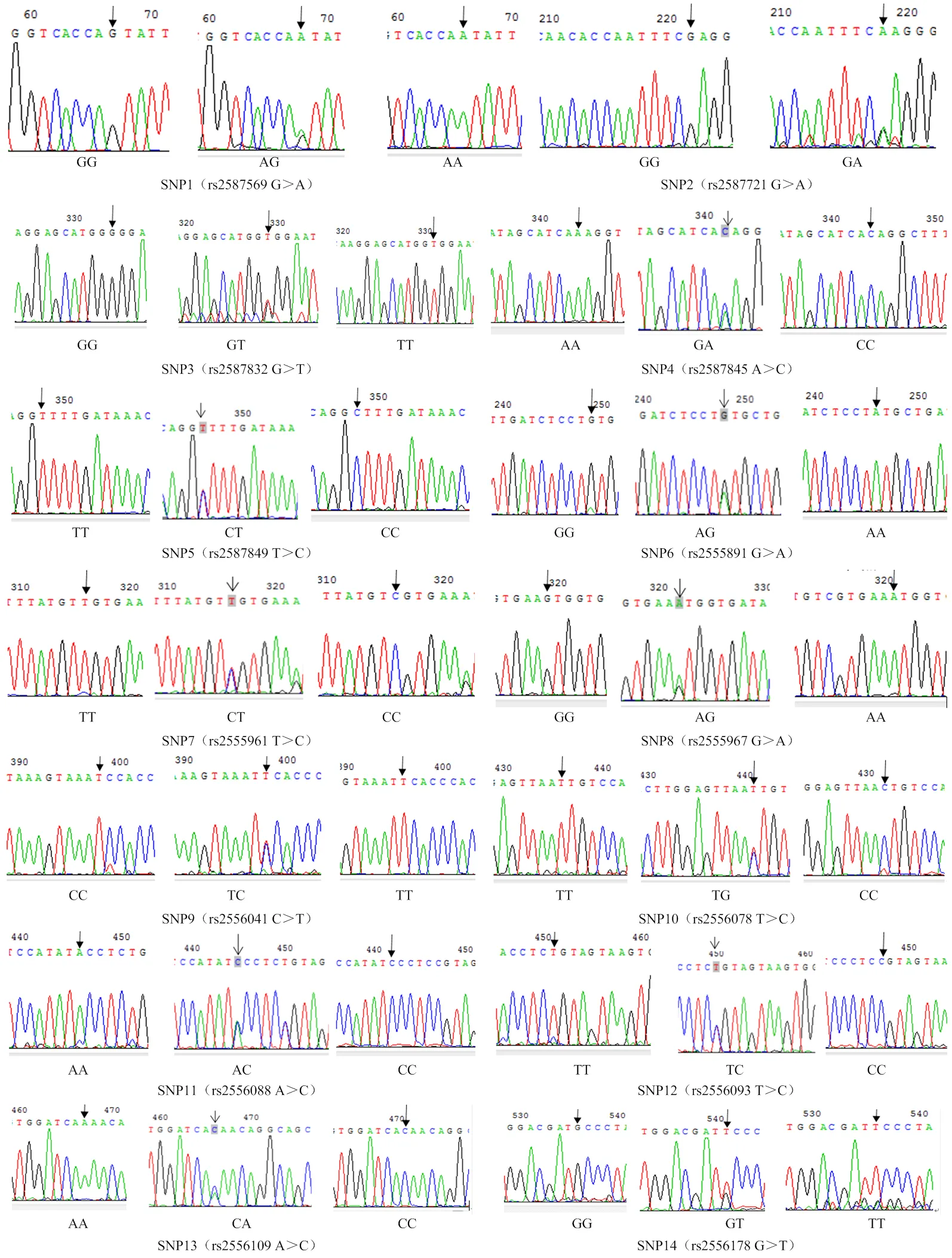
图2 Wnt3a 14个突变位点测序峰图
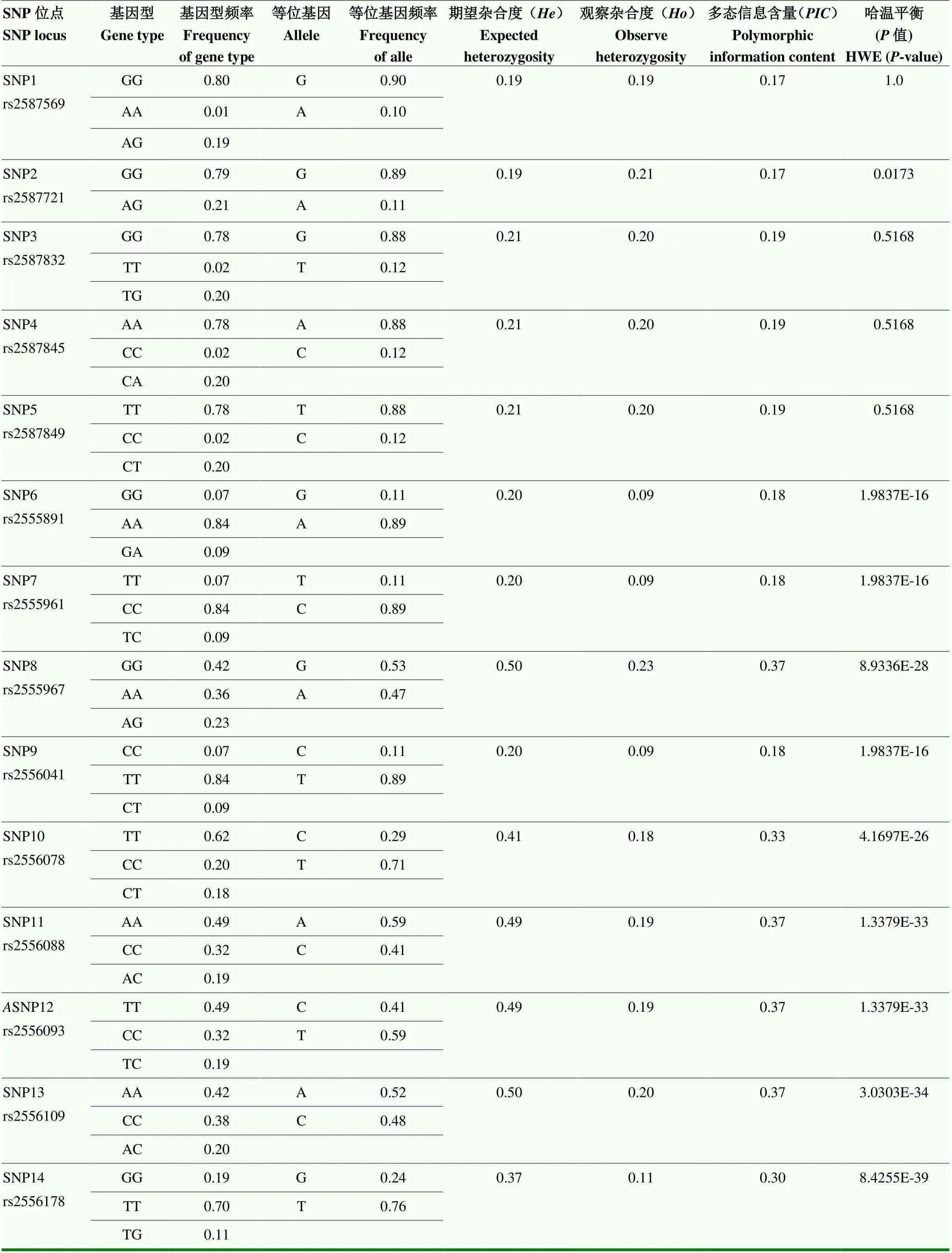
表2 Wnt3a的14个位点遗传多态性与哈代-温伯格平衡检验

表3 Wnt3a位点与皮肤毛囊密度性状的关联分析(平均值±标准误)
同一位点中同列不同小写字母表示同一性别不同基因型毛囊密度差异显著(<0.05)。下同
Different lowercase letters in the same column in the same site indicate that the skin feather follicle density of different genotypes in the same sex is significantly different (<0.05). The same as below

A:连锁图。方块颜色由浅至深表示连锁程度由低到高;数值代表位点间连锁不平衡的强弱(数值=D’值×100);B:单倍型分析。线越粗表示相邻单倍型结合可能性大
2.6 Wnt3a单倍型与毛囊密度性状关联分析
SNP3、SNP4和SNP5连锁产生的2 种单倍型组合后产生了3种单倍型,结果见表4。可见,关联分析发现在公、母鸡中3种单倍型组合的毛囊密度均差异不显著;从表5结果可见,将 SNP6—SNP13处的5种单倍型组合后,个体数小于3的单倍型组合不参与统计与比较,所以公鸡有7种单倍型组合,毛孔数量差异不显著;母鸡有8种单倍型组合,其中H1H1(AACCAATTTTAATTCC)毛囊密度最大,毛孔数量显著高于H1H5、H1H4、H2H2和H4H4。由表6结果可见,SNP2和SNP8位点单倍型组合后,公鸡有6种单倍型组合,毛孔数量差异不显著,母鸡H1H1(AGAA)、H1H2(AGAG)单倍型组合的毛孔数量显著高于H2H2(GGAG)和H2H3(GGGG)。

表4 Wnt3a SNP3-SNP5位点单倍型组合与皮肤毛囊密度性状关联分析(平均值±标准误)
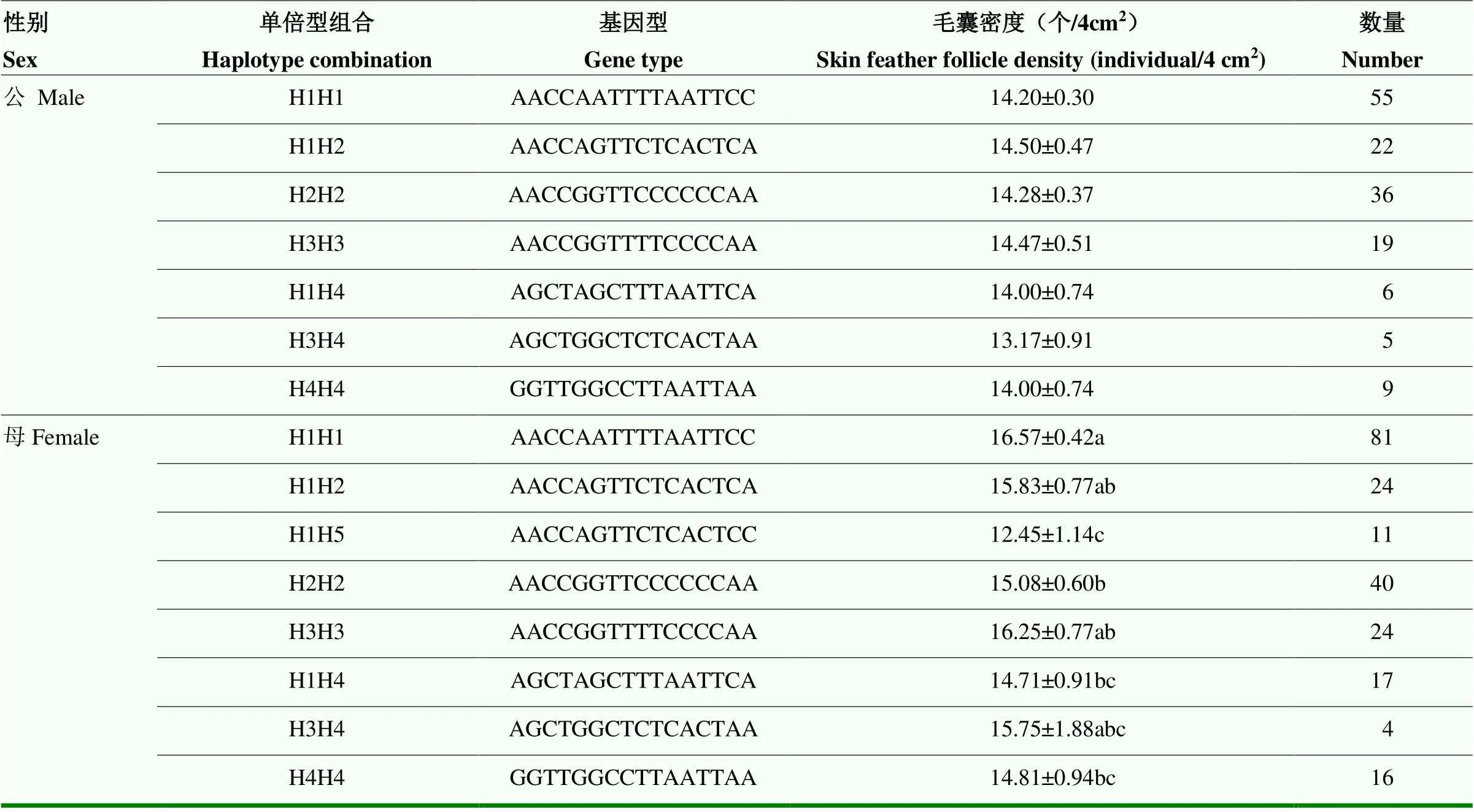
表5 Wnt3a SNP6-SNP13位点单倍型组合与皮肤毛囊密度性状关联分析(平均值±标准误)
3 讨论
3.1 Wnt3a群体遗传特征分析
本研究对第2、3外显子、第2、3内含子进行测序,分析发现14个SNP位点,除了SNP2(rs2587721)位点存在2种基因型GG、AG,其他SNP位点存在3种基因型。H-W平衡检验结果显示,4个SNP位点处 H-W平衡状态。试验选择的金陵花鸡是2015年12月20通过的国家畜禽遗传资源委员会审定的肉鸡配套系[23],没有对试验群体进行长期的高强度的人工选择,因而有些位点表现出在基因组上分布均匀,处于H-W平衡状态。第3内含子的9个SNP位点偏离H-W平衡(<0.05),可能是因为试验群体是人工选种选配,而非自然交配,组成配套系的3个专门化品系经过较长期的选育,导致部分基因型的个体数量偏少所致;另外也可能是试验群体数目较少造成,下一步将扩大样本量进行进一步验证。群体遗传多样性的大小代表着群体遗传丰富度的高低,多样性越高,则遗传丰富度也越高,通常用和用衡量这一指标[24-25]。第2外显子、第2内含子的5个突变位点和均小于0.25,说明这5个SNP位点遗传多样性较低。第3内含子的9个突变位点,除了SNP6、SNP7、SNP9位点<0.25,其他6个突变位点 0.25<<0.5,为中度多态。总体遗传变异程度低,这可能是由于参与金陵花鸡配套系培育的3个品系经过较长期的人工定向选择,特别是终端父系的皮肤毛孔密度进行了较高强度的选育,所以导致遗传多态性较低。
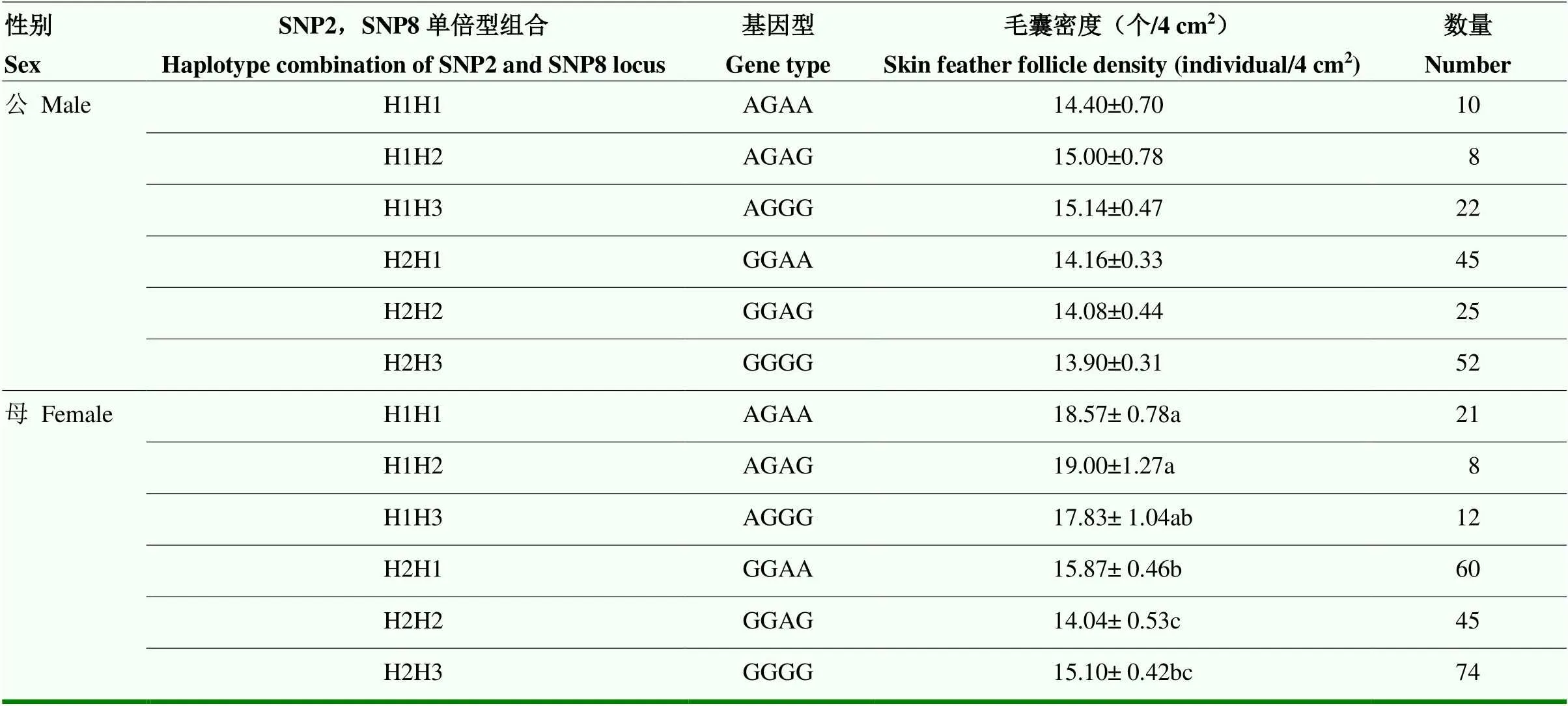
表6 Wnt3a SNP2,SNP8位点单倍型组合与皮肤毛囊密度性状关联分析(平均值±标准误)
3.2 Wnt3a多态性与毛囊密度的关联性分析
研究发现,Wnt信号通路中的多个SNPs位点与鸡屠体性状相关,其中与胸肌率显著相关[26]。目前,关于在禽类毛囊生长发育方面的研究相对较少。作者前期对花山麻鸡第2、3外显子、第2、3内含子进行测序,只发现3个SNP位点,其中第3内含子g.2555377 T>C位点与皮肤毛囊密度显著相关[16]。本研究用相同的引物对金陵花鸡进行PCR扩增与测序,发现14个SNP位点,其中2个SNP位点,SNP2(rs2587721A>G)和SNP8(rs2555967G>A)与皮肤毛囊密度显著相关。品种不同,SNP位点差异显著,只在第2外显子发现一个相同的SNP位点(rs2587569 G>A),其他SNP位点不同;与毛囊密度显著相关的SNP标记也不同。同时,在第二外显子存在相同突变位点的基因型不同,在金陵花鸡中存在3种基因型(GG、AG、AA),而在花山麻鸡中只存在2种基因型(GG、AA)。这可能与2个品种毛囊密度不同有关,花山麻鸡公母鸡平均毛囊密度为20左右,公母鸡毛囊密度差异不显著;金陵花鸡母鸡毛囊密度(15.71)显著高于公鸡(14.25),进一步推测是毛囊密度的关键候选基因,下一步将在相同品种和不同品种扩大数量进行验证SNP标记。
基因组中的突变位点绝大多数位于内含子区域,而外显子相对较保守,本研究在鸡中发现的14个突变位点中就有13个位于内含子,可能是因为内含子比外显子选择压力较小,更容易积累变异[27]。与毛囊密度显著相关的SNP2和SNP8两个位点突变虽然均在内含子,但也可能影响mRNA翻译,从而使蛋白质的功能发生变化,进而影响到表型变化[28-29]。
表型的变化可能是单个突变位点引起的,也可能是多个SNPs间的连锁作用造成的[30]。对突变位点之间进行连锁不平衡分析能够鉴别连锁的位点,连锁分析后可看出非等位基因间更多位点的相互作用,可更好地综合分析表型变化原因[31]。本研究连锁不平衡分析发现:SNP3—SNP5的3个位点,SNP6—SNP13的8个SNP位点间均存在强连锁,而且连锁水平很高(2值在0.944—1.0)。诸多因素都会导致群体内的SNP位点间出现连锁不平衡状态,如交配模式、群体混合和选择都将影响群体的连锁不平衡水平[32]。本研究的试验材料金陵花鸡是三系杂交组合的肉鸡配套系,是3个品系的群体混合,3个品系又经过8个世代以上的选育,这可能是多个SNP位点间存在强连锁水平的重要原因。
经过连锁产生的单倍型组合与毛囊密度的相关性分析,发现 SNP6—SNP13的强连锁对鸡毛囊密度产生重要影响。 SNP6—SNP13连锁产生5种单倍型,其中H1单倍型(ACATTATC)频率最高,为0.469,推断H1单倍型可能是鸡最早出现在祖先中的单倍型[27]。 SNP6—SNP13连锁产生5种单倍型组合后,对公鸡毛囊密度无显著影响效应,对母鸡有显著影响效应,其中H1H1单倍型(AACCAATTTTAATTCC)在群体中出现频率最高。虽然SNP2和SNP8不存在强连锁关系,但将2个位点与鸡毛囊密度显著相关,SNP2和SNP8位点单倍型组合后,对公鸡毛囊密度无显著影响效应,母鸡H1H1(AGAA)、H1H2(AGAG)为优势单倍型组合。研究发现SNP6—SNP13联锁后产生的单倍型以及SNP2和SNP8位点单倍型组合后,对公鸡不存在显著影响效应,对母鸡皮肤毛囊密度产生显著的遗传学效应。表型测定结果表明,母鸡的平均毛囊密度显著高于公鸡毛囊密度。对鸡毛囊密度的影响效应是否有性别效应,需要进一步扩大群体数量,在不同品种中进行验证。
本研究对与鸡毛囊密度显著相关多个SNP标记进行连锁分析与单倍型组合分析,除去个体数小于3的单倍型组合,共获得8种组合类型,其中SNP6— SNP13强连锁后单倍型组合H1H1单倍型样本量最多,占群体频率37.33%,毛囊密度最大。SNP2和SNP8单标记与毛囊密度显著相关,SNP2和SNP8组合单倍型母鸡H1H1、H1H2单倍型组合为优势单倍型。鉴于多个SNP位点和单倍型组合对鸡皮肤毛囊密度产生显著的遗传效应,可以考虑将SNP2和SNP8位点母鸡组合单倍型H1H1(AGAA)、H1H2(AGAG)以及SNP6—SNP13处的强连锁产生的H1H1单倍型组合(AACCAATTTTAATTCC)作为选育毛囊密度的重要分子标记,以推动屠宰型肉鸡的“分子编写育种”进展[33],为加快分子水平的编写并定向培养屠宰型肉鸡新品种,获得分子杂种优势,提高育种效率奠定基础。
4 结论
在第2外显子、第2、第3内含子共发现14个SNPs。第2外显子的1个突变位点(SNP1)和第2内含子的3个突变位点(SNP3—SNP5)的3个位点均处于Hardy-Weinberg平衡状态,第3内含子的9个突变位点(SNP6—SNP14)偏离Hardy-Weinberg平衡。SNP2和SNP8位点与皮肤毛囊密度显著相关,母鸡组合单倍型H1H1(AGAA)、H1H2(AGAG)为优势单倍型。SNP6—SNP13之间存在强连锁不平衡,H1(ACATTATC)为优势单倍型,母鸡有8种单倍型组合,其中H1H1(AACCAATTTTAATTCC)个体数量最多,占群体频率37.33%,毛囊密度最大。的SNP2和SNP8位点的H1H1(AGAA)、H1H2(AGAG)和SNP6—SNP13连锁产生的H1H1(AACCAATTTTAATTCC)单倍型组合可以为母鸡皮肤毛囊密度“分子编写育种”提供遗传信息。
[1] 文杰. 中国肉鸡产业技术创新与发展趋势. 兽医导刊, 2020(3): 4-5.
WEN J. Technological innovation and development trend of broiler industry in China. Veterinary Orientation, 2020(3): 4-5. (in Chinese)
[2] 辛翔飞, 郑麦青, 文杰, 王济民. 2019年肉鸡产业形势分析、未来展望与对策建议. 中国畜牧杂志, 2020, 56(3): 155-159. doi:10.19556/j.0258-7033.20200217-07.
XIN X F, ZHENG M Q, WEN J, WANG J M. Situation analysis, future prospect and countermeasures of broiler industry in 2019. Chinese Journal of Animal Science, 2020, 56(3): 155-159. doi:10. 19556/j.0258-7033.20200217-07. (in Chinese)
[3] 陈宽维. 黄羽肉鸡冰鲜市场展望. 科学种养, 2015(2): 64.
CHEN K W. Prospects for the yellow feather broiler chilled fresh market. Ke Xue Zhong Yang, 2015(2): 64. (in Chinese)
[4] 赵华, 范梅华. 活鸡向冰鲜鸡消费转型亟需解决的六大问题. 中国畜牧杂志, 2015, 51(16): 8-10, 14.
ZHAO H, FAN M H. Six problems need to solve during the consumption of chilled chicken replacing live chicken. Chinese Journal of Animal Science, 2015, 51(16): 8-10, 14. (in Chinese)
[5] CHI W, WU E, MORGAN B A. Dermal papilla cell number specifies hair size, shape and cycling and its reduction causes follicular decline. Development, 2013, 140(8): 1676-1683. doi:10.1242/dev.090662.
[6] CHANG C H, JIANG T X, LIN C M, BURRUS L W, CHUONG C M, WIDELITZ R. Distinct Wnt members regulate the hierarchical morphogenesis of skin regions (spinal tract) and individual feathers. Mechanisms of Development, 2004, 121(2): 157-171. doi:10.1016/j. mod.2003.12.004.
[7] FESSING M Y, SHAROVA T Y, SHAROV A A, ATOYAN R, BOTCHKAREV V A. Involvement of the edar signaling in the control of hair follicle involution (catagen). The American Journal of Pathology, 2006, 169(6): 2075-2084. doi:10.2353/ajpath.2006.060227.
[8] YU M, YUE Z, WU P, WU D Y, MAYER J A, MEDINA M, WIDELITZ R B, JIANG T X, CHUONG C M. The biology of feather follicles. The International Journal of Developmental Biology, 2004, 48(2/3): 181-191. doi:10.1387/ijdb.031776my.
[9] 陶林, 杜炳旺, 张丽. 卷羽鸡毛囊发育规律及卷羽候选基因KRT75遗传特征分析. 中国农业科学, 2015, 48(4): 821-830.
TAO L, DU B W, ZHANG L. The development of frizzled follicle and genetic characteristics of candidate gene
[10] 苏蕊, 李金泉, 张文广, 尹俊, 赵珺, 常子丽. 骨形态发生蛋白2(BMP2)基因在内蒙古绒山羊不同时期皮肤毛囊中的表达. 中国农业科学, 2008, 41(2): 559-563.
SU R, LI J Q, ZHANG W G, YIN J, ZHAO J, CHANG Z L. Expression of BMP2 in the skin and hair follicle from different stage in Inner Mongolia cashmere goat. Scientia Agricultura Sinica, 2008, 41(2): 559-563. (in Chinese)
[11] ELLIOTT K, STEPHENSON T J, MESSENGER A G. Differences in hair follicle dermal papilla volume are due to extracellular matrix volume and cell number: implications for the control of hair follicle size and androgen responses. The Journal of Investigative Dermatology, 1999, 113(6): 873-877. doi:10.1046/j.1523-1747.1999. 00797.x.
[12] 姬改革, 束婧婷, 单艳菊, 章明, 屠云洁, 刘一帆, 巨晓军, 邹剑敏. 鸡皮肤毛囊性状研究进展. 中国家禽, 2019, 41(10): 46-49. doi:10.16372/j.issn.1004-6364.2019.10.009.
JI G G, SHU J T, SHAN Y J, ZHANG M, TU Y J, LIU Y F, JU X J, ZOU J M. Research progress of skin hair follicle traits in chicken. China Poultry, 2019, 41(10): 46-49. doi:10.16372/j.issn.1004-6364. 2019.10.009. (in Chinese)
[13] JAMORA C, LEE P, KOCIENIEWSKI P, AZHAR M, HOSOKAWA R, CHAI Y, FUCHS E. A signaling pathway involving TGF-beta2 and snail in hair follicle morphogenesis. Journal of Cheminformatics, 2005, 3(1): e11. doi:10.1371/journal.pbio.0030011.
[14] 张小康. Wnt信号通路在鹅皮肤及羽囊早期发育中的功能研究[D]. 武汉: 华中农业大学, 2018.
ZHANG X K. Study on the function of Wnt signaling pathway in the early development of goose skin and feather follicles[D]. Wuhan: Huazhong Agricultural University, 2018. (in Chinese)
[15] 姬改革, 束婧婷, 单艳菊, 章明, 屠云洁, 刘一帆, 巨晓军, 邹剑敏. 基于表达谱芯片筛选鸡不同部位皮肤组织差异表达基因. 畜牧兽医学报, 2018, 49(1): 36-45.
JI G G, SHU J T, SHAN Y J, ZHANG M, TU Y J, LIU Y F, JU X J, ZOU J M. Identification of differentially expressed genes between different positions of chicken skin based on gene expression microarray. Chinese Journal of Animal and Veterinary Sciences, 2018, 49(1): 36-45. (in Chinese)
[16] 束婧婷, 姬改革, 屠云洁, 章明, 巨晓军, 单艳菊, 刘一帆, 邹剑敏. 鸡Wnt3a基因组织表达差异与SNPs对鸡毛囊密度性状的遗传效应. 中国畜牧兽医, 2021, 48(5): 1672-1680. doi:10.16431/j.cnki. 1671-7236.2021.05.018.
SHU J T, JI G G, TU Y J, ZHANG M, JU X J, SHAN Y J, LIU Y F, ZOU J M. Tissue expression analysis of Wnt3a gene and genetic effects of SNPs on feather follicle density in chicken. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1672-1680. doi:10. 16431/j.cnki.1671-7236.2021.05.018. (in Chinese)
[17] NEMOTO E, SAKISAKA Y, TSUCHIYA M, TAMURA M, NAKAMURA T, KANAYA S, SHIMONISHI M, SHIMAUCHI H. Wnt3a signaling induces murine dental follicle cells to differentiate into cementoblastic/osteoblastic cells via an osterix-dependent pathway. Journal of Periodontal Research, 2016, 51(2): 164-174. doi:10.1111/jre.12294.
[18] PARK K C, CHOI H R, NA J I, CHO H J, NAM K M, CHOI J W, NA S Y, HUH C H. Effects of murine dermal cells on the regulation of hair growth is dependent on the cell number and post-natal age of newborn mice. Annals of Dermatology, 2012, 24(1): 94-98. doi:10. 5021/ad.2012.24.1.94.
[19] YUE Z, JIANG T X, WIDELITZ R B, CHUONG C M. Wnt3a gradient converts radial to bilateral feather symmetry via topological arrangement of epithelia. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(4): 951-955. doi:10.1073/pnas.0506894103.
[20] XIE W Y, CHEN M J, JIANG S G, YAN H C, WANG X Q, GAO C Q. Investigation of feather follicle morphogenesis and the expression of the Wnt/β-catenin signaling pathway in yellow-feathered broiler chick embryos. British Poultry Science, 2020, 61(5): 557-565.
[21] ARDLIE K G, KRUGLYAK L, SEIELSTAD M. Patterns of linkage disequilibrium in the human genome. Nature Reviews Genetics, 2002, 3(4): 299-309. doi:10.1038/nrg777.
[22] MUELLER J C. Linkage disequilibrium for different scales and applications. Briefings in Bioinformatics, 2004, 5(4): 355-364. doi: 10.1093/bib/5.4.355.
[23] 金陵. 金陵花鸡配套系. 农村百事通, 2016(17): 33. doi:10.19433/ j.cnki.1006-9119.2016.17.014.
JIN L. Jin Ling Hua chicken cross strain. Nongcun Baishi Tong, 2016(17): 33. doi:10.19433/j.cnki.1006-9119.2016.17.014. (in Chinese)
[24] TU Y J, CHEN K W, ZHANG S J, TANG Q P, GAO Y S, YANG N. Genetic diversity of 14 indigenous grey goose breeds in China based on microsatellite markers. Asian-Australasian Journal of Animal Sciences, 2006, 19(1): 1-6. doi:10.5713/ajas.2006.1.
[25] ZANETTI E, DE MARCHI M, ABBADI M, CASSANDRO M. Variation of genetic diversity over time in local Italian chicken breeds undergoingconservation. Poultry Science, 2011, 90(10): 2195-2201. doi:10.3382/ps.2011-01527.
[26] LU Y, CHEN S R, LIU W B, HOU Z C, XU G Y, YANG N. Polymorphisms in Wnt signaling pathway genes are significantly associated with chicken carcass traits. Poultry Science, 2012, 91(6): 1299-1307. doi:10.3382/ps.2012-02157.
[27] 孙雪, 李胜杰, 杜金星, 姜鹏, 周家辉, 白俊杰. 草鱼GHRH基因SNPs的筛选及其与生长性状的关联分析. 农业生物技术学报, 2021, 29(5): 963-972.
SUN X, LI S J, DU J X, JIANG P, ZHOU J H, BAI J J. Screening of SNPs in GHRH and association analysis with growth traits in grass carp(). Journal of Agricultural Biotechnology, 2021, 29(5): 963-972. (in Chinese)
[28] CARTEGNI L, CHEW S L, KRAINER A R. Listening to silence and understanding nonsense: Exonic mutations that affect splicing. Nature Reviews Genetics, 2002, 3(4): 285-298. doi:10.1038/nrg775.
[29] 岳武成, 杨鹤, 侯鑫, 王静安, 陈晓雯, 王军, 王成辉. 中华绒螯蟹肌肉抑制素基因()同义突变对基因转录和翻译效率的影响. 水产学报, 2021, 45(4): 497-504.
YUE W C, YANG H, HOU X, WANG J G, CHEN X W, WANG J, WANG C H. Effects of synonymous mutation on transcription and translation efficiency of Es-gene in Chinese mitten crab (). Journal of Fisheries of China, 2021, 45(4): 497-504. (in Chinese)
[30] OROZCO G, HINKS A, EYRE S, KE X, GIBBONS L J, BOWES J, FLYNN E, MARTIN P, WELLCOME TRUST CASE CONTROL CONSORTIUM, YEAR CONSORTIUM, WILSON A G, BAX D E, MORGAN A W, EMERY P, STEER S, HOCKING L, REID D M, WORDSWORTH P, HARRISON P, THOMSON W, BARTON A, WORTHINGTON J. Combined effects of three independent SNPs greatly increase the risk estimate for RA at 6q23. Human Molecular Genetics, 2009, 18(14): 2693-2699. doi:10.1093/hmg/ddp193.
[31] HORNE B D, CAMP N J. Principal component analysis for selection of optimal SNP-sets that capture intragenic genetic variation. Genetic Epidemiology, 2004, 26(1): 11-21. doi:10.1002/gepi.10292.
[32] AKEY J, JIN L, XIONG M M. Haplotypes vs single marker linkage disequilibrium tests: What do we gain? European Journal of Human Genetics, 2001, 9(4): 291-300. doi:10.1038/sj.ejhg.5200619.
[33] 刘志国, 王冰源, 牟玉莲, 魏泓, 陈俊海, 李奎. 分子编写育种: 动物育种的发展方向. 中国农业科学, 2018, 51(12): 2398-2409.
LIU Z G, WANG B Y, MU Y L, WEI H, CHEN J H, LI K. Breeding by molecular writing(BMW): The future development of animal breeding. Scientia Agricultura Sinica, 2018, 51(12): 2398-2409. (in Chinese)
Screening ofSNPs and Its Association Analysis with Skin Feather Follicle Density Traits in Chicken
TU YunJie1, JI GaiGe1, ZHANG Ming1, LIU YiFan1, JU XiaoJun1, SHAN YanJu1, ZOU JianMin1, LI Hua2, CHEN ZhiWu3, SHU JingTing1
1Key Laboratory of Poultry Genetics and Breeding of Jiangsu Province, Jiangsu Institute of Poultry Sciences, Yangzhou 225125, Jiangsu;2Foshan University, Foshan 528225, Guangdong;3Guangxi Jinling Agriculture and Animal Husbandry Group Co., Ltd., Nanning 530000
【Objective】The Wnt signaling pathway plays an important role in the development of animal skin feather follicles. The results of previous studies indicated that themight be an important candidate gene that had effects on the chicken feather follicle density. In order to further verify the role ofin the growth and development of skin feather follicle density,SNPs were screened and their association with feather follicle density would be analyzed in Jinling Hua chicken. The study could provide a reference for “breeding by molecular writing” of slaughter-type broilers with beautiful carcasses.【Method】The SNPs ofgene were screened by PCR amplification and direct sequencing, and the correlation between a single SNP marker and skin feather follicle density traits was analyzed. Haploview software was used to analyze the degree of linkage disequilibrium (LD) of these SNP loci, and the correlation between different haplotype combinations and feather follicle density traits was also analyzed. 【Result】A total of 14 SNP sites were found, and one SNP site (SNP1) was found in the second exon, which was a synonymous mutation. Four mutation sites (SNP2-SNP5) were found in the second intron, and 9 SNP sites (SNP6-SNP14) were found in the third intron. The chi-square test showed that one mutation site (SNP1) in the second exon and three mutation sites (SNP3-SNP5) in the second intron were all in the Hardy-Weinberg equilibrium (>0.05), 9 mutation sites (SNP6-SNP14) of the third intron deviated from Hardy-Weinberg equilibrium (<0.05). The expected heterozygosity () of SNP1-SNP5 was less than 0.50, and the polymorphic information content () was less than 0.25. The genetic polymorphisms of these 5 SNP loci were low. The third intron had 9 mutation sites,of SNP6, SNP7, SNP9 sites was less than 0.25, and the other 6 mutation sites were 0.25<<0.5, which were moderately polymorphic. Single-marker association analysis showed that the number of skin feather follicle with SNP2 locus of AG genotype in males and females was significantly higher than that of GG genotype (<0.05). The number of skin feather follicles with SNP8 locus of AA and GG genotypes in females was significantly higher than that of the AG genotype (<0.05). The skin feather follicles density in the three genotypes in males was not significantly different. The linkage disequilibrium analysis of 14 SNPs showed that SNP6-SNP13 and SNP3-SNP5 had a strong linkage disequilibrium, respectively. SNP3, SNP4, and SNP5 produced three haplotype combinations after the combination of the two haplotypes linked by SNP3- SNP5. Association analysis found that the skin feather follicle density of the three haplotype combinations in males and females were not significantly different. After the combination of 5 main haplotypes at SNP6-SNP13 locus, the males had 7 haplotype combinations, and the skin feather follicles density was not significant. Females had 8 haplotype combinations, of which H1H1 (AACCAATTTTAATTCC) had the highest skin feather follicles density. SNP2 and SNP8 were significantly correlated with skin feather follicle density, and the haplotype combination H1H1(AGAA) and H1H2 (AGAG) were the dominant haplotypes in hens.【Conclusion】Fourteen SNPs ofwere screened. Among them, individuals with different genotypes at rs2587721 G>A (SNP2) and rs2555967G>A (SNP8) locus had significant differences in feather follicle density. Eight SNPs (SNP6-SNP13) loci were in strong linkage disequilibrium, and the combination of H1H1 had the highest feather follicles density in females. The haplotype combination of SNP2 and SNP8 ofH1H (AGAA), H1H2 (AGAG) and SNP6-SNP13 linked to produce the H1H1 (AACCAATTTTAATTCC) haplotype combination were significantly correlated with feather follicle density in females, which provided important genetic information for “breeding by molecular writing” on chicken skin feather follicle density.
chicken;; skin feather follicle; SNP sites; linkage disequilibrium

10.3864/j.issn.0578-1752.2022.23.016
2021-09-13;
2022-05-27
江苏省农业重大新品种创制项目(PZCZ201728)、扬州市现代农业项目(YZ2021029)、江苏现代农业(肉鸡)产业技术体系(JATS[2020]357)、现代农业产业技术体系建设专项(CARS-41)、江苏省农业自主创新基金(CX(21)2011-1)、江苏省自然科学基金(BK20210955)、江苏省种业振兴揭榜挂帅项目(JBGS(2021)107)
屠云洁,E-mail:tyj3030@126.com。通信作者束婧婷,E-mail:shujingting@163.com
(责任编辑 林鉴非)

