不同产地野生金荞麦SSR标记鉴定△
赵莎,郑司浩,李进瞳,刘美娟,林晖才,熊啟相,曾燕,王继永*
1.中国中药有限公司,北京 100195;2.国药种业有限公司,北京 100035
金荞麦为蓼科植物金荞麦Fagopyrum dibotrys(D.Don)Hara 的干燥根茎,最早记载于《本草拾遗》,现收载于《中华人民共和国药典》2020 年版一部,具有清热解毒、排脓祛瘀之功效,用于肺痈吐脓、肺热喘咳、乳蛾肿痛[1]。金荞麦根茎中主要含有原矢车菊素、表儿茶素、没食子酸、槲皮素、木犀草素等化合物[2]。现代药理研究表明,金荞麦在抗菌消炎、抗氧化、调血脂、抗癌、抑制肿瘤细胞侵袭和转移及增强免疫力等方面具有明显的药理活性,为金荞麦片、复方金荞麦颗粒、威麦宁胶囊等多种抗癌药和癌预防药物的主要原料,也是急支糖浆的主要原料之一,可显著改善呼吸道炎症[3-5]。金荞麦分布于我国黄河以南的多个省区,主要以云南、贵州、四川3 省的野生资源最为集中,但随着生态环境的恶化与过度采挖等因素,野生金荞麦资源逐年减少,因此被列为国家二级重点保护植物[6]。不同产地金荞麦的总酚、鞣质、表儿茶素含量有区别,质量差异较大,进行金荞麦产地鉴别对于金荞麦种质资源鉴定具有重要意义[7-9]。
简单重复序列(simple sequence repeats,SSR)标记是近年来发展起来的建立在聚合酶链式反应(PCR)基础上的第二代分子标记技术,具有共显性及含量丰富、多态性高、重复性好、操作简单等优点,在作物遗传多样性、基因定位、分子辅助标记、遗传图谱构建、品种鉴定和纯度鉴定等方面都有很高的应用价值[10-11]。詹海仙等[12]通过12对引物对不同产地甘草进行区分,可用于甘草种质资源的鉴定分析。目前,利用SSR 标记技术分析荞麦遗传多样性的研究多以甜荞、苦荞为研究对象[13-14],以金荞麦为研究对象的研究鲜有报道。本研究基于金荞麦全基因组设计SSR 标记引物,对来自云南、贵州、四川等地的野生金荞麦样本进行遗传多样性及聚类分析,筛选用于鉴别不同产区野生金荞麦种质资源的引物组合,以期为金荞麦种质资源保护、开发及分子标记辅助育种等提供参考。
1 材料
野生金荞麦样品共35 批分别采自云南、贵州、四川地区,采集根茎活体移栽至位于云南省昆明市的中国中药有限公司金荞麦野生种质资源圃,并于2020 年6 月采集当年萌发的鲜叶,硅胶干燥保存,由国药种业有限公司李进瞳副主任药师鉴定为金荞麦Fagopyrum dibotrys(D.Don)Hara。具体样品信息见表1。

表1 金荞麦样品信息
T100 型PCR 仪、GelDocXR+型凝胶成像仪(美国Bio-Rad 公司);DYY-6D 型电泳仪(北京六一生物科技有限公司);1-14 型离心机(德国Sartorius 公司);NanoDrop One 型超微量分光光度计(美国Thermo公司)。
异丙醇(批号:20190605)、无水乙醇(批号:20190507)均购自国药集团化学试剂有限公司;TaqDNA 聚合酶(批号:W9205a)、10×TaqBuffer(批号:U8402a)均购自天根生化科技(北京)有限公司;琼脂糖凝胶纯化回收试剂盒(批号:DC011,北京金百特生物技术有限公司)。
2 方法
2.1 基因组DNA提取
利用十六烷基三甲基溴化铵法(mCTAB)提取金荞麦样本叶片的总DNA:取野生金荞麦样本叶片约100 mg,浸入液氮冷冻研磨至细小粉末;加入buffer A[0.1 mol·L-1三(羟甲基)氨基甲烷盐酸盐(Tris-HCl),pH 8.0;5 mmol·L-1乙 二 胺 四 乙 酸(EDTA);0.25 mol·L-1氯化钠(NaCl);1%聚乙烯吡咯烷酮40(PVP-40)]1.5 mL,反复颠倒离心混匀,冰浴10 min,10 000×g离心10 min,弃上清液;在沉淀中加入buffer A 1.5 mL,反复颠倒离心混匀,冰浴10 min,10 000×g离心10 min,弃上清液。在沉淀中加入预热的2% CTAB(0.1 mol·L-1Tris-HCl,pH 8.0;1.4 mol·L-1NaCl;25 mmol·L-1EDTA;2%CTAB;0.2%β-巯基乙醇;1%PVP-40)溶液800 μL,将沉淀均质悬浮于溶液后置于65 ℃水浴锅中保存1.5~2.0 h,期间颠倒均质溶液3~5 次。将混合液放至室温,10 000×g离心5 min,取上清液,加入等体积CI 溶液(三氯甲烷-异戊醇24∶1),在颠倒摇床上混合10 min,10 000×g离心5 min,取上清液,加入等体积CI 溶液,在颠倒摇床上混合10 min。混合液10 000×g离心5 min,取上清液至1.5 mL 离心管中,加入0.6 倍体积冷的异丙醇,颠倒混合后置于-20 ℃冰箱保存1 h以上,10 000×g离心2 min,弃上清液,得到凝固体。将离心管倒置于干燥纸上尽量控干液滴,加入RNase 溶液(100 mg·L-1)100 μL,37 ℃保存0.5 h,依次加入双蒸水(ddH2O)150 μL,5 mol·L-1NaCl 50 μL 和无水乙醇700 μL,充分混合后10 000×g离心2 min,弃上清液,将离心管倒置于干燥纸上尽量控干液滴,加入70%乙醇600 μL,混合后10 000×g离心2 min,弃上清液。再次加入70%乙醇600 μL,混合后10 000×g离心2 min,弃上清液,干燥除去乙醇,加TE缓冲液100 μL溶解,得到DNA溶解液。
将金荞麦叶片的总DNA 进行纯化,用琼脂糖凝胶纯化回收试剂盒进行操作,得到纯化的DNA 溶解液,应用NanoDrop One 型超微量分光光度计检测DNA浓度,稀释至50 ng·μL-1,待后续PCR扩增使用。
2.2 SSR引物设计
从本课题组破译的金荞麦全基因组高通量数据中筛选出6935 对SSR 引物。在SSR 核心区侧翼序列中(150 bp 范围),使用primer 3 进行primer 引物设计,引物最佳长度为24 bp;引物最小长度为20 bp;引物最大长度为28 bp;最佳退火温度为63 ℃;最低退火温度为60 ℃;最高退火温度为65 ℃;1对引物退火温度的最大差值为1 ℃。其他参数采用primer 3 的默认参数。将引物BLAST 比对回基因组上,将成对引物在基因组上可以扩增得到的序列长度进行比较,与含有目标SSR 的产物长度差在2 kb以上,保留该对引物,与含SSR 产物长度差在2 kb以下则滤掉该引物,最终即可得到SSR 候选引物。筛选出来的SSR 候选引物中,选择重复单元(碱基序列)碱基数2~5 bp、重复单元(碱基序列)重复5~10 次的引物进行预试验。所选择的引物长度为20~25 bp,理论退火温度在55 ℃左右,PCR 产物长度为150~350 bp。
2.3 PCR扩增及电泳检测
用筛选出的引物对金荞麦DNA进行PCR反应。反应体系为20 μL:10×TaqBuffer 2 μL,2 mmol·L-1脱氧核糖核苷三磷酸(dNTPs)2 μL,5 μmol·L-1引物对各1 μL,1.0 UTaqDNA 聚合酶0.2 μL,50 ng·μL-1DNA 模板2 μL,加灭菌双蒸水至20 μL。设置未加模板DNA 的PCR 反应为阴性对照。反应程序:94 ℃,4 min;94 ℃,30 s;退火30 s(JQM03、JQM04 退火温度为56 ℃,JQM07、JQM21 退火温度为58 ℃,JQM19 退火温度为54 ℃);72 ℃,1 min,32个循环;72 ℃,10 min。PCR扩增产物用1%的琼脂糖凝胶电泳检测,观察是否有条带、片段大小是否合适,以确认实验是否成功。将检验成功的PCR 扩增产物送生工生物工程(上海)股份有限公司进行毛细管电泳检测分型,得到PCR扩增产物的分型结果。
2.4 数据分析
将PCR 扩增产物的分型结果用GeneMarker 4.0进行峰图判读,以“0,1”二元方式来记录等位基因片段大小,即某一等位基因存在时记为1,某一等位基因不存在时记0,缺失数据记为-9,从而得到等位基因矩阵,并通过GenALEx 计算金荞麦在每个产地、个体间的遗传多样性数据。基于GenALEx计算所得的个体遗传距离矩阵,通过MEGA 进行UPGMA聚类分析,构建聚类树。
3 结果与分析
3.1 引物筛选
利用不同产地的金荞麦样本对设计的SSR 引物开展预试验,从扩增成功率及多态性(毛细管荧光电泳方式)2个维度进行引物的筛选,最终选定5对多态性好、扩增成功率高的SSR 分子标记引物,引物信息见表2。JQM03、JQM04、JQM07、JQM19、JQM21 这5 对引物对四川产地的金荞麦扩增成功率高,JQM04、JQM07、JQM19、JQM21 这4 对引物对贵州产地的金荞麦扩增成功率高。

表2 金荞麦产地鉴别SSR引物筛选
3.2 不同产区金荞麦遗传多样性分析
3.2.1 四川地区金荞麦遗传多样性分析 基于金荞麦SSR 引物组合JQM03、JQM04、JQM07、JQM19、JQM21得到各居群的遗传多样性参数见表3,结果显示,3个居群观测等位基因数(Na)为2.400~8.200,有效等位基因数(Ne)为2.236~5.727,Shannon′s指数(I)为0.739~1.768,其中四川居群的等位基因均值最低,相应的I也较低。云南居群、贵州居群的观测杂合度(Ho)≈期望杂合度(He),表明该居群比较符合客观状态;四川居群Ho>He,表明该居群可能存在一定的杂种选择现象或者远交现象。

表3 基于引物组合JQM03、JQM04、JQM07、JQM19、JQM21的不同产地野生金荞麦遗传多样性分析
3.2.2 贵州地区金荞麦遗传多样性分析 基于金荞麦SSR 引物组合JQM04、JQM07、JQM19、JQM21得到各居群的遗传多样性参数见表4,结果显示,3 个居群Na为4.750~6.750,Ne为2.650~3.590,I为1.189~1.499,其中贵州居群的等位基因均值最低,相应的I也较低。云南、四川居群Ho<He,表明该居群可能存在一定的近交现象或者有杂合缺失未检测到的情况;贵州居群Ho>He,表明该居群可能存在一定的杂种选择现象或者远交现象。
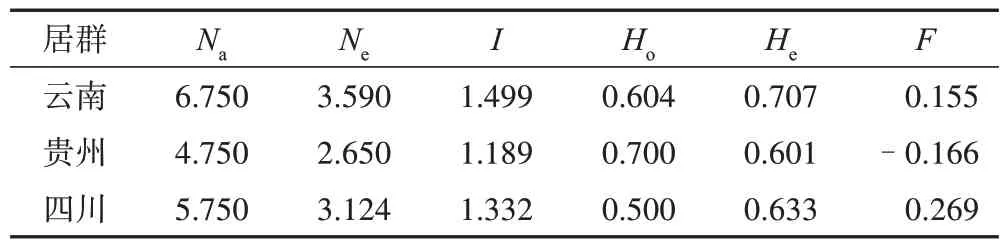
表4 基于引物组合JQM04、JQM07、JQM19、JQM21的不同产地野生金荞麦遗传多样性分析
3.3 聚类结果分析
3.3.1 四川地区金荞麦鉴定 基于金荞麦SSR引物组 合QM03、JQM04、JQM07、JQM19、JQM21,通过GenALEx计算各居群间遗传相似性系数(表5)。由表5 可知,3 个居群间平均遗传相似性系数为0.472,其中云南居群与贵州居群的遗传相似性系数最大为0.769,说明云南、贵州居群的种群关系近,四川与云南、贵州居群的遗传相似性系数分别为0.333、0.313,说明四川与云南、贵州居群种群关系相对更远。基于GenALEx 计算所得的遗传多样性数据,通过MEGA 进行UPGMA 聚类分析,构建聚类树(图1)可知,只有四川居群的聚为较纯的一支,其他分支都有不同程度的混杂情况,同时也说明基于金荞麦SSR 引物组合JQM03、JQM04、JQM07、JQM19、JQM21 可以较好地对产地为四川产地的金荞麦进行区分鉴定。

表5 基于引物组合JQM03、JQM04、JQM07、JQM19、JQM21的各居群间遗传相似性系数

图1 基于引物组合JQM03、JQM04、JQM07、JQM19、JQM21的不同产地金荞麦样品的UPGMA聚类树
3.3.2 贵州地区金荞麦鉴定 基于金荞麦SSR 引物组合JQM04、JQM07、JQM19、JQM21,通 过GenALEx 计算各居群间遗传相似性系数(表6)。通过表6 可知,居群间平均遗传相似系数为0.455,其中云南与贵州居群的遗传相似系数最大为0.644,说明云南、贵州居群的种群关系近;四川与云南、贵州居群的遗传相似系数分别为0.413、0.308,说明四川与云南、贵州两居群种群关系相对更远。基于GenALEx 计算所得的遗传多样性数据,通过MEGA 进行UPGMA 聚类分析,构建聚类树(图2)可知,只有贵州居群的聚为较纯的一支,其他分支都有不同程度的混杂情况,同时也说明基于金荞麦SSR引物组合JQM04、JQM07、JQM19、JQM21可以较好地对产地为贵州产地的金荞麦进行区分鉴定。
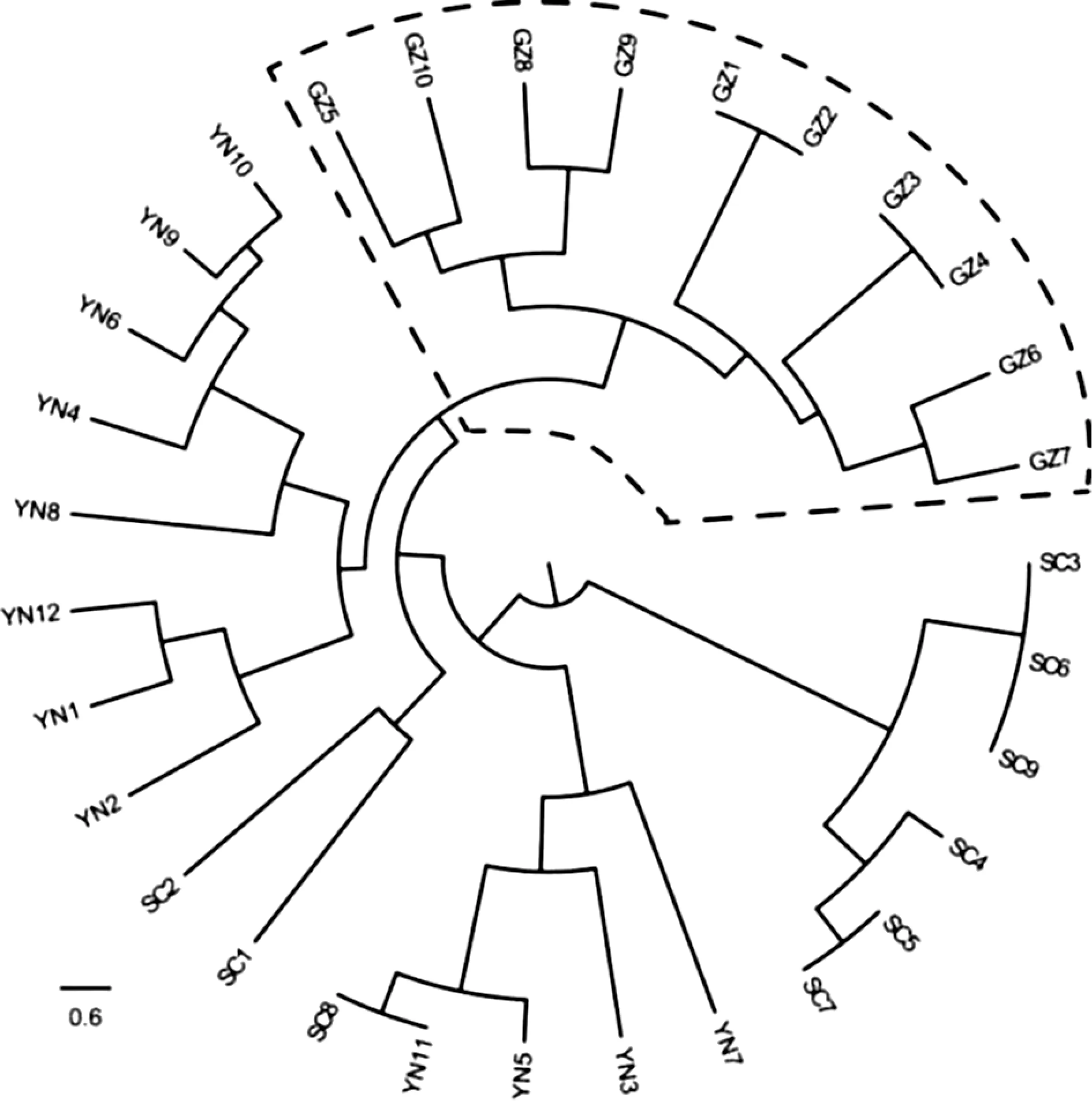
图2 基于引物组合JQM04、JQM07、JQM19、JQM21的不同产地金荞麦样品的UPGMA聚类树

表6 基于引物组合JQM04、JQM07、JQM19、JQM21的各居群间遗传相似性系数
4 讨论
我国西南地区是国际公认的荞麦起源中心,也是遗传多样性中心[15]。张春平等[16]采用随机扩增的多态性DNA(RAPD)技术对重庆市7 个野生金荞麦居群的87 个个体进行遗传多样性分析,得出金荞麦种内有丰富的遗传多样性,且与地理因素有显著相关性。邓蓉等[17]应用简单序列重复间区(ISSR)标记方法,对贵州省内11 个不同地域的金荞麦种质进行遗传多样性与亲缘关系分析,得出种质间遗传差异较小且相对稳定,为金荞麦品种ISSR 指纹图谱建立、种质资源鉴定、基因定位等工作提供科学依据。程成等[6]使用内转录间隔区(ITS)、matK分子标记手段,对收集的云南省内金荞麦进行遗传多样性和亲缘关系分析,结果表明海拔是影响其分类的主要因素。
本研究首次基于金荞麦全基因组数据设计SSR标记引物,对来自云南、贵州、四川3 个不同产地金荞麦样本进行遗传多样性及聚类分析,发现不同产地的金荞麦具有丰富的遗传多样性,云南、贵州居群的种群关系近,四川与云南、贵州两居群种群关系相对更远。引物组合JQM03、JQM04、JQM07、JQM19、JQM21 可以对产地为四川的金荞麦进行鉴定区分;引物组合JQM04、JQM07、JQM19、JQM21 可以对产地为贵州的金荞麦进行鉴定区分;引物组合JQM03、JQM04、JQM07、JQM19、JQM21 可成功对云南产地金荞麦进行扩增,但可能由于云南产地的金荞麦混杂较为严重,目前无法从产地将其区分开。后续研究将继续加大样本量,验证并筛选更多、更稳定的SSR 标记引物,为金荞麦种质资源鉴定、保护,遗传多样性分析和金荞麦新品种选育提供更多的参考依据。

