基于UHPLC-LTQ-Orbitrap MS代谢组学的不同产地酸枣仁化学成分差异性比较△
黄晓欣,毛怡宁,李虹,王宇航,刘勇
北京中医药大学 中药学院,北京 100102
酸枣仁为鼠李科植物酸枣Ziziphus jujubaMill.var.spinosa(Bunge)Hu ex H.F.Chou的干燥成熟种子,始载于《神农本草经》,味酸,性平,主治心腹寒热、邪结气聚、四肢酸疼湿痹,久服安五脏[1]。酸枣仁广布全球,在中国主要分布于北方大部分地区,如河北、陕西、辽宁、河南等省。失眠又称睡眠障碍性疾病,主要表现为难以入睡,持续睡眠困难等症状,并产生一些不适的感觉,如疲惫、头痛及注意力不佳等,严重影响患者的生活质量。酸枣仁为中医治疗失眠的常用药物,其需求量也随之不断增加。然而,酸枣仁广泛分布于北方低山丘陵地区,目前多为野生,少数栽培的酸枣管理较为粗放。不同产地间生态环境与栽培管理等因素使得药材中的各类成分差异较大,导致不同地区酸枣仁品质存在显著的差异。
目前,已从酸枣仁中分离鉴定了190 余个化学成分,包括皂苷类、黄酮类、三萜类、生物碱类、脂肪油类、甾体类、酚酸类化合物、多种氨基酸和微量元素等。酸枣仁中的皂苷类、黄酮类和生物碱类成分较受关注,其中现代药理研究主要集中在皂苷类成分,其镇静催眠作用已被广泛认可。酸枣仁总皂苷质量分数约为0.091 6%,主要包括四环三萜和五环三萜2 种[2],如从酸枣仁甲醇提取部位中得到的酸枣仁皂苷A(jujuboside A)和酸枣仁皂苷B(jujuboside B)。酸枣仁总黄酮质量分数为0.95%,主要为芹菜素型黄酮碳苷类化合物[3]。Woo 等[4]首次从酸枣仁甲醇提取部位分离得到斯皮诺素(spinosin)黄酮碳苷及其酰基化衍生物,并确定其结构,此后从酸枣仁甲醇提取物中分离出葛根素(puerarin)、异斯皮诺素(isospinosin)、异牡荆素(isovitexin)、酸枣黄素(zivulgari)等黄酮类化合物。酸枣仁中生物碱类成分含量相对较高。目前已从酸枣仁中分离鉴定出26 个生物碱,主要分为吡咯类、吲哚类、异喹啉类和环肽类。最先从酸枣仁中分离得到的生物碱为lysicamine 和juzirine,后来发现还有环肽类生物碱、酸枣仁碱A、酸枣仁碱B、酸枣仁碱D、酸枣仁碱F、酸枣仁碱G1、酸枣仁碱G2和阿朴菲类生物碱酸枣仁碱E、酸枣仁碱Ⅰa、酸枣仁碱Ⅰb、酸枣仁碱K等。
酸枣仁的质量控制手段主要有多指标成分含量测定及指纹图谱整体控制2 种。《中华人民共和国药典》2020 年版将斯皮诺素、酸枣仁皂苷A 作为酸枣仁检测的指标成分。随着分析手段和仪器的不断发展,关于酸枣仁质量控制研究的热点逐渐由多指标成分含量测定向指纹图谱整体评控方向转移。温度、光照、湿度等气候因素会导致不同产地酸枣仁次生代谢产物的积累不同,进而导致药材质量差别。因此,研究酸枣仁不同产地的质量差别对于保证药材质量和建立酸枣仁良好农业规范(GAP)基地是十分必要的。
目前,产地因素对酸枣仁内在化学成分影响的研究多为利用高效液相色谱法、紫外分光光度法等对斯皮诺素,酸枣仁皂苷A、B 等几个指标成分进行定性、定量分析。而中药为复杂的化学体系,仅靠几个指标性成分不能全面体现其品质差异。另外,色谱分析法依赖对照品,对中药材中含量较低的化学成分难以检测,定量分析的化合物也比较有限,难以反映其化学成分的代谢谱。近年来,随着超高效液相色谱-线性离子阱/静电场轨道阱组合式高分辨质谱法(UHPLC-LTQ-Orbitrap MS)代谢组学技术的发展,为中药的区分或差异性评价及中药质量评控提供了一种可靠的方法[5]。
本实验基于植物代谢组学技术的发展,利用UHPLC-LTQ-Orbitrap MS 结合主成分分析(PCA)及正交偏最小二乘法-判别分析(OPLS-DA)对不同产地酸枣仁的差异性进行鉴别分析,为不同地理位置酸枣仁中化学成分差异性及品质多样性的研究提供参考。
1 材料
1.1 仪器
Thermo Scientific LTQ-Oribitrap XL 型线性离子阱-串联静电场轨道阱质谱仪,配有热喷雾离子源(HESI)、Xcalibur 2.1化学工作站;Thermo Scientific Dionex Utimate 3000 UHPLC Plus Focused型超高效液相色谱系统,含二元梯度泵、自动进样器、柱温箱、二极管阵列(DAD)检测器;Chromeleon 7 工作站;Millipore Synergy UV 型超纯水机(美国Millipore公司);R200D型电子分析天平(十万分之一,德国Sartorius公司)。
1.2 试药
对照品芦丁(批号:Y06J8S37439)、山柰酚(批号:R03F6C1)、葛根素(批号:YM051DYA14)、斯皮诺素(批号:P01N8F47228)、酸枣仁皂苷A(批号:P08A8F33617)均购于上海源叶生物科技有限公司;对照品酸枣仁皂苷B(批号:110814-200607)购于中国食品药品检定研究院,所有对照品纯度均≥98%;水为超纯水;甲醇、乙腈为色谱纯(美国Fishier Scientific 公司);其余试剂均为分析纯。
样品采自辽宁、河北、山西、陕西、河南5 个产区的10 个不同产地,经北京中医药大学刘勇教授鉴定为鼠李科植物酸枣Ziziphus jujubaMill.var.spinosa(Bunge)Hu ex H.F.Chou 的干燥成熟种子。样品详细采集信息见表1。

表1 酸枣仁样品来源
2 方法
2.1 供试品溶液制备
取各产地酸枣仁粉末(过四号筛)约l g,精密称定,置索氏提取器中,加石油醚(60~90 ℃)适量,加热回流4 h,弃去石油醚液,药渣挥去溶剂,转移至锥形瓶中,加70%乙醇20 mL,超声2 h,滤过,滤渣用70%乙醇5 mL 洗涤,合并洗液与滤液,回收溶剂至干,残渣加甲醇溶解,转移至5 mL 量瓶中,加甲醇至刻度,摇匀,用微孔滤膜(0.22 μm)滤过,即得。
2.2 质量控制(QC)样品制备
分别精确吸取按2.1 项下制备的10 个产地共34 份样品,等容混匀,经微孔滤膜(0.22 μm)滤过,置于液相色谱小瓶中,即得QC 样品。在样品分析前连续进样5次同一QC 样品,在运行样品序列中每间隔10个样品运行1次QC样品。
2.3 色谱与质谱条件
色谱柱:Waters ACQUITY UPLC BEH-Cl8(50 mm×2.1 mm,1.7 μm);流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~5 min,5.0%~20.0 %A;5~10 min,20.0%~22.5%A;10~12 min,22.5%~48.0%A;12~15 min,48.0%~58.0%A;15~35 min,58.0%~90.0%A;35.0~35.1 min,90.0%~5.0%A);流速为0.3 mL·min-1;柱温为30 ℃;检测波长为210 nm;进样量为4 μL。
质谱参数:加热电喷雾离子源(HESI),正、负离子检出模式,扫描范围:m/z50~1800;离子源温度:350 ℃;电离源电压:4 kV;毛细管电压:35 V;管透镜电压:110 V;鞘气和辅助气均为高纯氮气(纯度>99.99%);鞘气流速:40 arb,辅助气流流速:20 arb;数据采集采用傅里叶变换高分辨全扫方式(TF,Full scan,Resolution 30 000)、数据依赖性DDA-MS 2、母离子列表PIL-MS2 等多种采集策略,碰撞诱导裂解(CID)条件。
2.4 代谢物定性及数据分析
基于代谢物信息公共数据库及对照品对比,对质谱检测的一级精确相对分子质量及二级碎片离子信息进行色谱峰归属的定性分析。使用SIEVE 2.1软件对原始数据进行峰检测、筛选、对齐、滤噪等预处理,得到二维峰原始数据矩阵,并对数据进行归一化预处理。使用SIMCA 14.0软件对数据进行标准化处理,随后进行PCA 无监督模式识别、OPLSDA有监督模式分析,并通过排列置换检验的方法来检验模型是否过拟合。根据变量重要性投影(variable importance in projection,VIP)对组间分离贡献大的化合物进行初步筛选(VIP 值>1),并结合独立样本t检验(P<0.05 为差异具有统计学意义)筛选潜在的差异标记化合物。
3 结果
3.1 酸枣仁成分鉴别
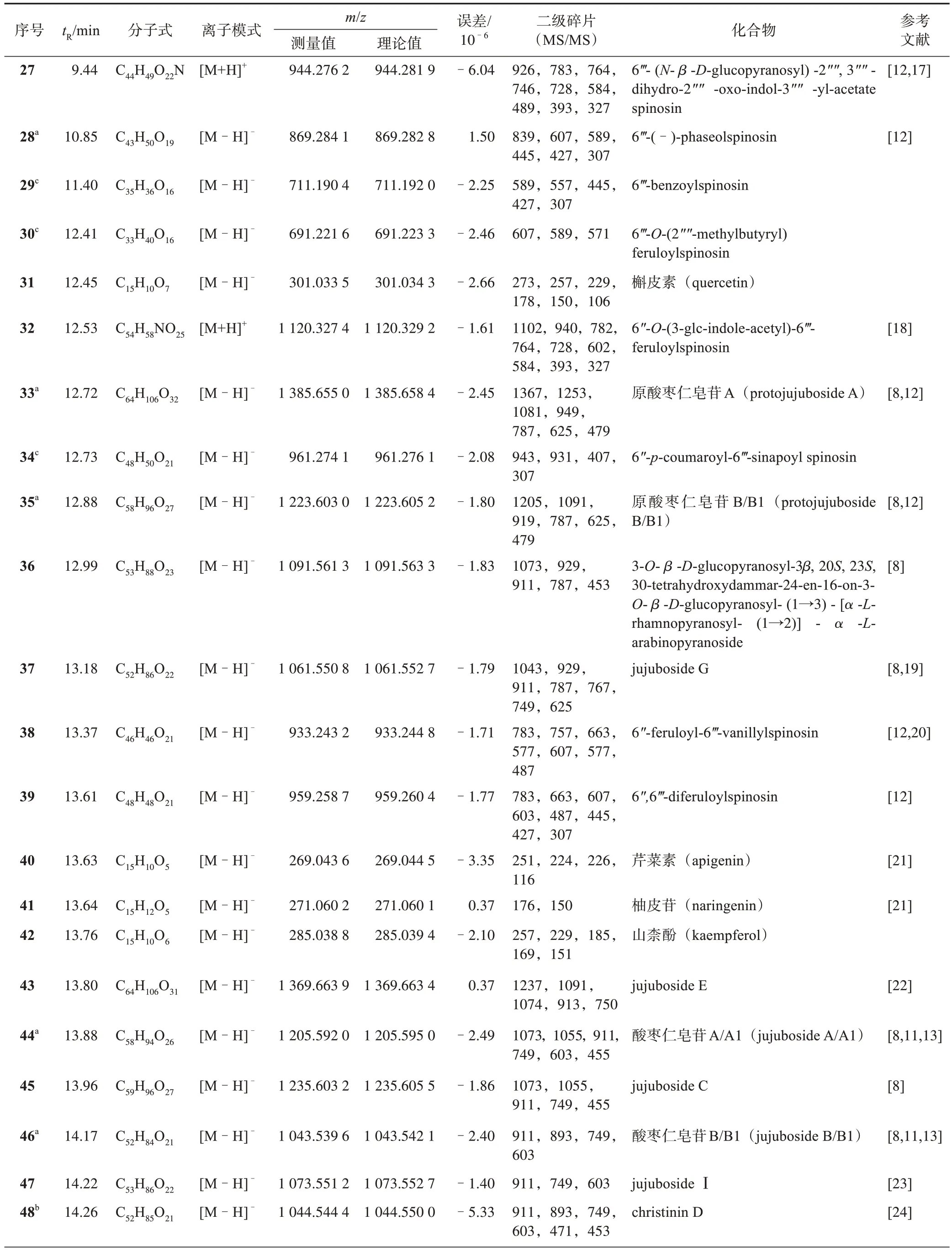
酸枣仁代谢产物的质谱数据和结构鉴定结果见表2,结合本课题组前期实验[6],通过高分辨质谱及二级质谱的碎片离子推测化合物的结构式,再根据部分对照品信息、相关文献及色谱峰进行推断鉴定,共表征49 个化合物,包括27 个黄酮类、14 个皂苷类、6 个三萜类、2 个生物碱类,其中christinin D、jujubasaponin Ⅰ、jujubasaponin Ⅵ、ziziberanalic acid 为首次从酸枣仁中检测到。并采用Mass Frontier 和Metwork 工具对可能存在的新化合物进行了预测,共推测出9 个新成分。

表2 酸枣仁代谢产物的UHPLC-LTQ-Orbitrap MS分析结果
续表2

续表2
表2 中化合物christinin D、jujubasaponin Ⅰ、jujubasaponin Ⅵ,zizyberanalic acid 为首次从酸枣仁中检测到。酸枣仁中皂苷类成分的质谱行为主要为依次脱去糖基,根据裂解规律结合文献进行推测结构。以化合物48 为例,质谱给出准分子离子峰m/z1 044.550 0 [M-H]-,可推断其分子式C52H85O21,以m/z1 044.550 0 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z911 [MH-Xyl]-为母离子丢失1分子木糖产生,之后连续丢失1分子葡萄糖、1分子鼠李糖及1分子阿拉伯糖产生的碎片离子m/z749,603,453。m/z893[M-H-H2OXyl]-,747 [M-H-H2O-Xyl-Rha]-为母离子丢失1 分子水,继而脱去1分子木糖及1分子鼠李糖形成的碎片离子。结合文献推测此化合物为christinin D。
化合物51 为jujubasaponin Ⅰ。质谱给出准分子离子峰m/z941.510 4 [M-H]-,可推断其分子式C47H76O16,以m/z941.510 4 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z895[M-H-2CH3-H2O]-,为母离子脱去1 分子水和2 分子甲基,继而丢失1 分子鼠李糖、1 分子葡萄糖、1 分子阿拉伯糖形成碎片离子453。结合文献推测此化合物51 为jujubasaponin Ⅰ。相同裂解方式结合文献可推测化合物52为枣树皂苷Ⅵ。
化合物56为zizyberanalic acid,质谱给出准分子离子峰m/z469.331 2 [M-H]-,可推断其分子式C30H46O4,以m/z469.331 2作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z451[M-H-H2O]-,423[M-H-CO-H2O]-,401[MH-2CH3-H2O]-,结合文献推测该化合物为zizyberanalic acid。
表2 中化合物6、7、9、10、15、16、29、30、34 为推测出的新成分。化合物6、7、9 质谱给出准分子离子峰分别为m/z919.250 3[M-H]-,889.239 7[M-H]-,975.276 5[M-H]-,可推断其分子式分别 为C42H48O23、C41H46O22、C45H52O24。分 别以m/z919.250 3,889.239 7,975.276 5 作为母离子进行二级质谱分析。化合物6 所得二级质谱图中有明显的碎片离子m/z757 [M-H-Glc]-,之后再裂解成607[M-H-60-90]-,595[M-H-Glc]-,427[MH-90-120-120]-。化合物7、9 所得二级质谱图中有明显的碎片离子m/z607,427,294 碎片离子,具有与斯皮诺素(spinosin)相似的质谱行为和紫外光谱吸收,有规律地产生脱去m/z60,90,120 质量单位的碎片峰。结合斯皮诺素的裂解规律(图1),推测化合物6、7、9 分别为6‴-(4"′′-O-β-D-吡喃葡萄糖基)-香草酰斯皮诺素、6‴-(4"′′-O-β-D-吡喃葡萄糖基)-对羟基苯甲酰斯皮诺素、6"′-(4"′′-O-β-D-吡喃葡萄糖基)-芥子酰斯皮诺素。

图1 斯皮诺素可能的裂解途径
化合物10 质谱给出准分子离子峰m/z725.192 4[M-H]-,可推断其分子式C32H38O19,以m/z725.192 4 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z593[M-H-Xyl]-,575[M-H-Xyl-H2O]-为母离子脱去1分子木糖产生的碎片离子,继而丢失1分子葡萄糖和1分子鼠李糖形成碎片离子431[M-H-Xyl-Glc]-,285[MH-Xyl-Glc-Rha]-。结合斯皮诺素的裂解规律,推测此化合物为山柰酚-3-O-α-L-吡喃鼠李糖基-(1→6)-β-D-O-吡喃鼠李糖基-O-β-吡喃木糖苷。
化合物15 质谱给出准分子离子峰m/z903.255 4[M-H]-,可推断其分子式C41H46O21,以m/z903.255 4 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z857[M-H-H2OCO]-,757 [M-H-Rha]-,741 [M-H-Glc]-;417 [M-H-Glc-CO-120]-为m/z741 丢失1 分子CO 和1 分子葡萄糖形成的碎片离子。结合斯皮诺素的裂解规律,推测此化合物为6‴-(4"′′-O-β-D-吡喃鼠李糖基)-香草酰斯皮诺素。
化合物16质谱给出准分子离子峰m/z649.1763 1[M-H]-,可推断其分子式C30H34O16,以m/z649.176 3作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z607[M-H-AC]-,445 [MH-Glc]-,427[M-H-Glc-H2O]-,367[M-HGlc-H2O-60]-,325 [M-H-120-Glc]-,307[M-H-Glc-H2O-120]-。结合斯皮诺素的裂解规律,推测此化合物为6‴-乙酰斯皮诺素。
化合物29 质谱给出准分子离子峰m/z711.192 0[M-H]-,可推断其分子式C35H36O16,以m/z711.192 0 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z589[M-H-CH2-H2O-90]-,557[M-H-CH2-H2O]-,445[M-HH2O]-,427[M-H-2H2O]-,307[M-H-2H2O-120]-。结合斯皮诺素的裂解规律,推测此化合物为6‴-苯甲酰斯皮诺素。
化合物30 质谱给出准分子离子峰m/z691.223 3[M-H]-,可推断其分子式C33H40O16,以m/z691.223 3 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z607[M-H-2AC]-,589[M-H-H2O]-,571[M-H-H2O]-。结合斯皮诺素的裂解规律,推测此化合物为6‴-O-(2"′′-甲基丁酰基)阿魏酰斯皮诺素。
化合物34 质谱给出准分子离子峰m/z961.276 1[M-H]-,可推断其分子式C48H50O21,以m/z961.276 1 作为母离子进行二级质谱分析。所得二级质谱图中有明显的碎片离子m/z943[M-H-H2O]-,931 [M-H-2CH3]-,m/z932 丢失1 分子葡萄糖和2 分子水后形成碎片离子407 [M-H-Glc-2H2O-90-120-120]-,307[M-H-Glc-AC-60-120-120-120]-,有规律地产生脱去60,90,120质量单位的碎片峰。结合斯皮诺素的裂解规律,推测此化合物为6"-对香豆酰基-6‴-芥子酰斯皮诺素。
3.2 PCA与OPLS-DA结果
3.2.1 系统方法评价 整个实验过程中,所有QC样品中化合物的保留时间RSD值均小于1%,峰强X射线衍射(XRD)值<30%,说明仪器精密度、重复性符合要求;在无监督的PCA中,在样品序列运行中插入的QC样品紧密聚集在一起(图2),说明仪器稳定性良好,数据质量良好,可对数据进行进一步分析。

图2 不同产地酸枣仁醇提物PCA得分
3.2.2 PCA PCA 是指在海量的原始数据中筛选出少数几个具有代表性的主成分,根据主成分作图以直观地描述样品整体的分类趋势及不同组别之间的聚类情况[29-30]。从图2 可以看出,5 个产地的酸枣仁样品均分别聚集为一类,分类趋势较为明显。
3.2.3 OPLS-DA OPLS-DA 被广泛用于代谢组数据的分析,由于其分析方法可以最大化组间差异常被用于差异代谢物的筛选[31]。为了更好地观察不同产地样品间的组内差异,在PCA 分组的基础上,进一步进行有监督的OPLS-DA,获得相应模型,OPLS-DA 得分见图3。由图3 可知,10 批酸枣仁样品大致聚集分为4 组[辽宁、华北(河北、山西)、陕西、河南],表明4 组药材中的化学成分存在差异。从模型验证的参数图可知,模型的稳定性和交叉验证的预测力都较高(Q2=0.956,R2Y=0.989,R2X=0.85),说明所建立的OPLS-DA 模型可以很好地用于下一步的分析,即不同产地酸枣仁的差异代谢物分析。

图3 不同产地酸枣仁醇提取物OPLS-DA结果
3.3 差异代谢物的筛选
为鉴定不同产地酸枣仁中化学代谢物的差异情况,采用OPLS-DA 对陕西、河南、辽宁、华北4 组酸枣仁样品分别两两组合进行OPLS-DA,并根据VIP 值结合t检验筛选差异标志物,以VIP>1,P<0.05为筛选标准(图4)。

图4 不同产地酸枣仁醇提取物差异代谢物比较的OPLS-DA结果
根据VIP 值及t检验结果结合前面所鉴定的58 个化学成分,筛选鉴定产地间差异标记化合物,结果表明34 个化学成分在陕西和河南样品间差异有统计学意义;26 个化学成分在陕西和华北样品间差异有统计学意义;15 个化学成分在陕西和辽宁样品间差异有统计学意义;33个化学成分在辽宁和华北样品间差异有统计学意义;39个化学成分在河南和华北样品间差异有统计学意义;33个化学成分在河南和辽宁样品间差异有统计学意义,见表3。结果表明,外在环境因素对不同产地酸枣仁的差异代谢物存在一定的影响,因此统计了不同产地的气候信息,见表4。

表3 各产地酸枣仁的差异代谢物

表4 酸枣仁各产地气候信息
4 讨论
酸枣仁作为一种常用中药,其药材的质量直接影响到汤剂的质量与疗效,而不同产地的药材质量差异往往较大,因此评价不同产地酸枣仁药材的质量,优选产地也是保证酸枣仁相关汤剂质量的重要手段之一。本研究采用基于UHPLC-ESI-MS/MS 的代谢组学方法对不同产地酸枣仁的化合物进行分析,结合文献共鉴别出58 个化合物,其中检测到9 个新成分;再利用PCA、OPLS-DA 筛选出不同产地酸枣仁中的差异标记代谢物,结果显示不同产地的酸枣仁中化学成分是有差异的。
本实验中相对于各产地间差异代谢物含量都有显著性差异的有黄酮类及三萜酸类2 种,包括山柰酚-3-O-芸香糖苷、6"′-对羟基苯甲酰斯皮诺素及美洲茶酸3 个化合物,可作为潜在的质量标志物区分以上不同产地酸枣仁,但中药作为一种复杂的化学体系,仅靠几个指标性成分也不足以全面体现其品质差异,因此最好是能结合其他指标性成分进行分析。河南产地与陕西、辽宁、华北产地的差异标记物中,其黄酮类成分特别是黄酮碳苷类成分、皂苷类成分含量较低。有大量研究认为,紫外辐射、高光强、低温、干旱等条件可能促进黄酮的合成。其中光照、温度的影响最大,可对黄酮合成途径中关键酶[如查耳酮合成酶(CHS)、苯丙氨酸解氨酶(PAL)等]的活性产生直接影响,从而影响植物中黄酮类成分的含量[32-33]。此外酸枣仁的“抢青”现象较严重,不同产地酸枣成熟时间不同,采收期也会对酸枣仁中化学成分产生影响[34]。本实验中河南酸枣仁样品采集于河南南部的南阳、平顶山地区,这些地区降水量、平均相对湿度、平均气温均高于其他地区,这些气候因素可能会对酸枣仁中黄酮类、皂苷类成分积累产生一定抑制作用。
另外,结果表明不同产地间的温度、光照、降水、土壤等环境因子对酸枣仁化学组成是有一定影响的,但这些差异代谢物对于不同产地酸枣仁质量高低、汤剂中酸枣仁用量与临床疗效之间的关系还有待进一步研究。该研究结果为评价不同产地酸枣仁质量提供了一种可行的方法,也为进一步研究环境因子对酸枣仁品质的影响提供了有关的基础研究数据。

