基于JAK2/STAT3的龙胆苦苷通路调控溃疡性结肠炎小鼠巨噬细胞极化机制研究△
谢彦媛,邵颖颖,韩伟超,谢保城,何淑芬
广东省东莞市人民医院 药学部,广东 东莞 523059
溃疡性结肠炎(ulcerative colitis,UC)具有病情反复、难以痊愈的特点,是一种发病机制尚未明确的肠道炎症性疾病。中医认为,UC 属于“泄泻”“久痢”范畴,常表现为湿热蕴结于大肠而出现大便稀薄,故常用清热利湿中药对症治疗[1]。已有研究表明,UC与肠炎相关性结直肠癌有密切的联系。临床研究表明,由于肠道中炎性环境的长期存在,炎症性肠病(inflammation bowel disease,IBD)恶化癌变肠炎相关性结直肠癌及患者死亡的风险明显增加[2-3]。目前,对于UC 的治疗药物主要包括免疫抑制剂、糖皮质激素和5-氨基水杨酸等[4],但有限的治疗效果及长期服药所导致的不良反应严重影响了患者的康复进程。因此,寻找一种有效、不良反应小的药物尤为迫切。
巨噬细胞与UC 病程的发展密切相关。巨噬细胞具有可塑性和异质性,可极化为能够分泌促炎因子的M1 型巨噬细胞和能够分泌抗炎因子的M2 型巨噬细胞。在UC 发病早期,巨噬细胞被激活并向M1型巨噬细胞极化,通过分泌促炎因子和趋化因子,破坏结肠黏膜结构的完整性,并且能够募集大量中性粒细胞到炎症发生位置,加剧炎症的发展[5]。M2型巨噬细胞则能通过分泌抗炎因子,抑制单核-巨噬细胞分泌一氧化氮和炎症因子的水平,缓解局部环境炎症反应的发生和发展。此外,M2型巨噬细胞能够发挥吞噬和清除病原体的作用,抑制炎症的进一步加剧[6]。因此,调控巨噬细胞极化对于UC 的治疗及预后具有重要的意义。
龙胆是我国传统中药材,具有清热燥湿、泻肝胆火的功效,为清肝胆湿热、泻下焦郁火常用中药[7]。龙胆苦苷为龙胆的主要活性成分,属于裂环环烯醚萜苷类化合物。现代药理学研究表明,龙胆苦苷具有抗炎、抗肿瘤、健胃和降血压等作用[8-9]。已有研究表明,龙胆苦苷在多种炎症性疾病的治疗中均发挥了积极的作用,如脓毒血症和糖尿病肾炎[10-11]。赵文娜等[12]研究发现,龙胆苦苷能够明显改善2,4,6-三硝基苯磺酸-乙醇溶液诱导的UC 小鼠肠道的炎性环境,减少结肠炎性细胞浸润和充血水肿,改善结肠组织结构损伤。综上所述,龙胆苦苷抗UC 具有良好的疗效。基于此,本研究探讨并分析龙胆苦苷对巨噬细胞极化的影响,进而对龙胆苦苷抗小鼠UC做初步机制阐述。
1 材料
1.1 实验动物
SPF级BALB/c雄性小鼠60只,体质量20~23 g,购于广东省医学实验动物中心,实验动物使用许可证号:SCXK(粤)2020-0005,动物饲养于SPF 级别动物房,饲养温度为22~25 ℃,相对湿度为45%~55%,每日光照12 h,动物自由食用标准饲料和自由饮用蒸馏水。
1.2 仪器
HP300 型组织脱水机(奥华科技有限公司);ES30 型组织包埋机(华速科技有限公司);CU600型电热恒温水浴锅(上海博讯有限公司);Elx808型全波长多功能酶标仪(广州吉源生物科技有限公司);ZE5 型流式细胞仪、DYC-Mini1 型垂直电泳槽、E1101 型电泳仪(美国Bio-Rad 生物科技有限公司);Nano Drop 2000c 型超微量分光光度计、CFX96 型实时定量聚合酶链式反应(PCR)仪(美国赛默飞生物科技有限公司);Tanon4600 型化学发光成像仪(上海天能科技有限公司)。
1.3 试药
龙胆苦苷(批号:20200703-2,纯度≥98%)、硫酸葡聚糖(DSS,批号:H17061909)均购于默克Sigma Aldrich公司;白细胞介素-12(IL-12)测定试剂盒(批号:20200877)、IL-10 测定试剂盒(批号:20200427)、IL-6 测定试剂盒(批号:20200219)、IL-4 测定试剂盒(批号:20200214)均购于江苏酶免实业有限公司;诱导型一氧化氮合酶(iNOS)抗体(批号:7913216)、CD206 抗体(批号:7246276)、酪氨酸激酶2(JAK2)抗体(批号:1372864)、p-JAK2 抗体(批号:2563073)、信号转导及转录激活因子3(STAT3)抗体(批号:4729976)、p-STAT3 抗体(批号:2944710)均购于美国CST 公司;APC anti-mouse CD45 抗体(批号:4332602)、PerCP-Cy 5.5 anti-mouse F4/80 抗体(批号:9273801)、APC/Cy7 anti-mouse CD206 抗 体(批号:40037611)、PE anti-mouse iNOS 抗体(批号:9928710)均购于美国BioLegend 公司;FITC anti-mouse CD11b 抗体(批号:4127642,Invitrogen公司);磷酸脱氢酶(GAPDH)抗体(批号:8884,美国CST 公司;RIPA 裂解液(批号:P0013B)、BCA 蛋白浓度测定试剂盒(批号:P0012S)均购于上海碧云天生物技术有限公司。
2 方法
2.1 动物分组与给药
BALB/c 雄性小鼠60 只,适应性饲养3 d,按体质量随机分成对照组、模型组及龙胆苦苷低、中、高剂量(25、50、100 mg·kg-1)组,每组12只。实验期间,对照组小鼠每天给予蒸馏水自由饮用,其余组小鼠每天给予2.5% DSS 溶液自由饮用,制备UC模型,以造模小鼠出现严重的稀便、便血和体质量明显下降为造模成功。造模的同时,龙胆苦苷低、中、高剂量组小鼠灌胃给予相应的药物,对照组与模型组同时灌胃给予等体积蒸馏水,持续7 d。每天记录小鼠的体质量变化、稀便和血便程度,根据评分标准,按公式(1)作疾病活动指数(DAI)评分记录,评分标准参考Chen 等[13]的研究,见表1。


表1 UC模型小鼠DAI评分标准
2.2 血液和脏器样本采集
实验结束后,对小鼠进行乙醚麻醉,眼眶取血,4 ℃、3500×g离心15 min 得血清,血清保存于-80 ℃冰箱中备用。小鼠脱颈椎处死后解剖,以回盲部下端为起始,以肛门端为结束,小心剥离结肠,将结肠平铺舒展,沿肠系膜方向(纵向)剖开使肠腔暴露,剔除内容物,使用电子游标卡尺对回盲部至肛门的结肠进行长度测量并拍照记录,对靠近肛门段的结肠进行厚度测量。
2.3 炎症因子测定
取小鼠结肠组织约0.4 g加入到含有磷酸盐缓冲液(PBS)500 μL 的离心管中,匀浆,将所得匀浆液3500×g离心10 min 得上清液。按照试剂盒说明书进行酶联免疫吸附法(ELISA)检测小鼠血清和结肠上清液中IL-10、IL-4、IL-6和IL-12水平。
2.4 相关蛋白表达测定
将结肠组织加裂解液于冰上裂解30 min 提取细胞总蛋白,12 000 r·min-1(离心半径6.3 cm)离心15 min,取上清液,采用BCA 试剂盒测定结肠组织蛋白质量浓度;经十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳后,采用半干转法将蛋白转移到聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h,加一抗(p-JAK2/JAK2、p-STAT3/STAT3、iNOS、CD206 和GAPDH)4 ℃冰箱孵育过夜;次日加入相应二抗,孵育1 h,随后显色曝光,拍照并保存相应蛋白条带,使用Image J软件分析蛋白和磷酸化蛋白条带的灰度值,与内参蛋白GAPDH的灰度值校准。
2.5 巨噬细胞亚群的测定
截取实验结束后所得结肠1 cm,在预冷的PBS中,充分研磨后过200 目滤膜到PBS 中,均匀吹打得结肠单细胞悬液。将制备的结肠单细胞悬液以1×106个收集于流式管中,加入CD45 抗体0.5 μL、CD11b 抗体1 μL、F4/80 抗体0.5 μL 和CD206 抗体1 μL,混匀,37 ℃避光孵育25 min。待表面抗体孵育完成后,使用冷的PBS 洗涤细胞1 次。洗涤后每份流式管加入配置好的流式破膜固定液1 mL 并脉冲涡旋,室温孵育60 min。每份流式管添加透化液2 mL,室温条件下800 r·min-1离心5 min(离心半径6.3 cm),弃上清。每份流式样品重悬后添加iNOS(PE,3.5 μL)抗体,室温避光孵育30 min。每份流式管添加透化液2 mL,室温条件800 r·min-1离心5 min(离心半径6.3 cm),弃上清,PBS 洗涤1 次。最后将样品重悬于PBS 300 μL 中,使用流式细胞仪分析样品。其中CD45 和CD11b 抗体为中性粒细胞的细胞标记物,F4/80为巨噬细胞的细胞标记物,iNOS 为M1 型巨噬细胞的细胞标记物,CD206为M2型巨噬细胞的细胞标记物。
2.6 统计方法
3 结果
3.1 龙胆苦苷对UC小鼠DAI评分的影响
实验结束后DAI评分结果显示,与对照组比较,模型组小鼠DAI 评分显著升高(P<0.01)。与模型组比较,龙胆苦苷各剂量(25、50、100 mg·kg-1)均能显著下调小鼠DAI 评分(P<0.01),作用呈剂量依赖性。此外,模型组小鼠在实验第五、六、七天均有1 只小鼠因溃疡严重而死亡,龙胆苦苷低剂量组有1 只小鼠在实验第七天因溃疡严重而发生死亡,2 组小鼠病死率分别为25.0%、8.3%。动物死亡后的DAI 评分、血清和脏器数据不纳入后续的实验结果。龙胆苦苷各剂量均能一定程度降低结肠炎小鼠病死率,见图1。

图1 龙胆苦苷对UC小鼠DAI评分的影响(, n=9~12)
3.2 龙胆苦苷对UC小鼠结肠病变的影响
从结肠病变的结果可观察到,与对照组比较,模型组小鼠结肠明显缩短,且发生肿胀。与模型组比较,龙胆苦苷各剂量组小鼠结肠缩短和肿胀均有一定程度的缓解,见图2。与对照组比较,DSS能够诱导小鼠结肠长度显著缩短(P<0.01),且厚度显著增加(P<0.01)。与模型组比较,龙胆苦苷各剂量组小鼠结肠缩短和结肠厚度增加的病理变化均发生显著改善(P<0.05,P<0.01),且改善作用呈剂量依赖性。见图3。由此可见,龙胆苦苷能显著改善DSS诱导的小鼠结肠损伤。
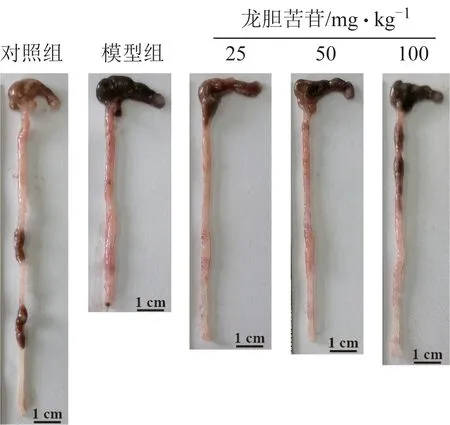
图2 各组小鼠结肠形态

图3 龙胆苦苷对UC小鼠结肠的影响(, n=9~12)
3.3 龙胆苦苷对UC小鼠肠道炎性环境的影响
结肠中炎性因子的结果显示,与对照组比较,模型组小鼠结肠中抗炎因子IL-10和IL-4表达水平显著升高(P<0.01);与模型组比较,龙胆苦苷各质量浓度组小鼠结肠中抗炎因子IL-10和IL-4表达水平显著升高(P<0.01)。与对照组比较,模型组小鼠结肠中促炎因子IL-6 和IL-12 的表达水平显著升高(P<0.01);与模型组比较,龙胆苦苷各剂量组小鼠结肠中促炎因子IL-6 和IL-12 表达水平显著降低(P<0.01)。此外,血清中相应的细胞因子水平变化与结肠组织中的趋势相对应(P<0.05,P<0.01),见图4。基于此可得,龙胆苦苷能够缓解DSS 诱导的结肠炎性环境,恢复结肠抗炎/促炎平衡,并且此作用具有剂量依赖性。

图4 龙胆苦苷对UC小鼠肠道炎性环境的影响(, n=9~12)
3.4 龙胆苦苷对UC小鼠巨噬细胞极化的影响
流式细胞术的结果显示,与对照组比较,模型组小鼠iNOS+巨噬细胞比例显著升高(P<0.01),同时CD206+型巨噬细胞比例显著升高(P<0.01)。与模型组比较,龙胆苦苷各剂量均能够显著降低小鼠结肠中iNOS+型巨噬细胞比例(P<0.01),且明显上调CD206+型巨噬细胞比例(P<0.05,P<0.01),见图5。此外,蛋白免疫印迹法(Western blot)的结果说明,龙胆苦苷各剂量均能提高CD206 的表达而降低iNOS 的表达(P<0.05,P<0.01),见图6。结果表明,龙胆苦苷可调控结肠巨噬细胞极化,并使巨噬细胞向具有抗炎作用的M2 型巨噬细胞的趋势极化。
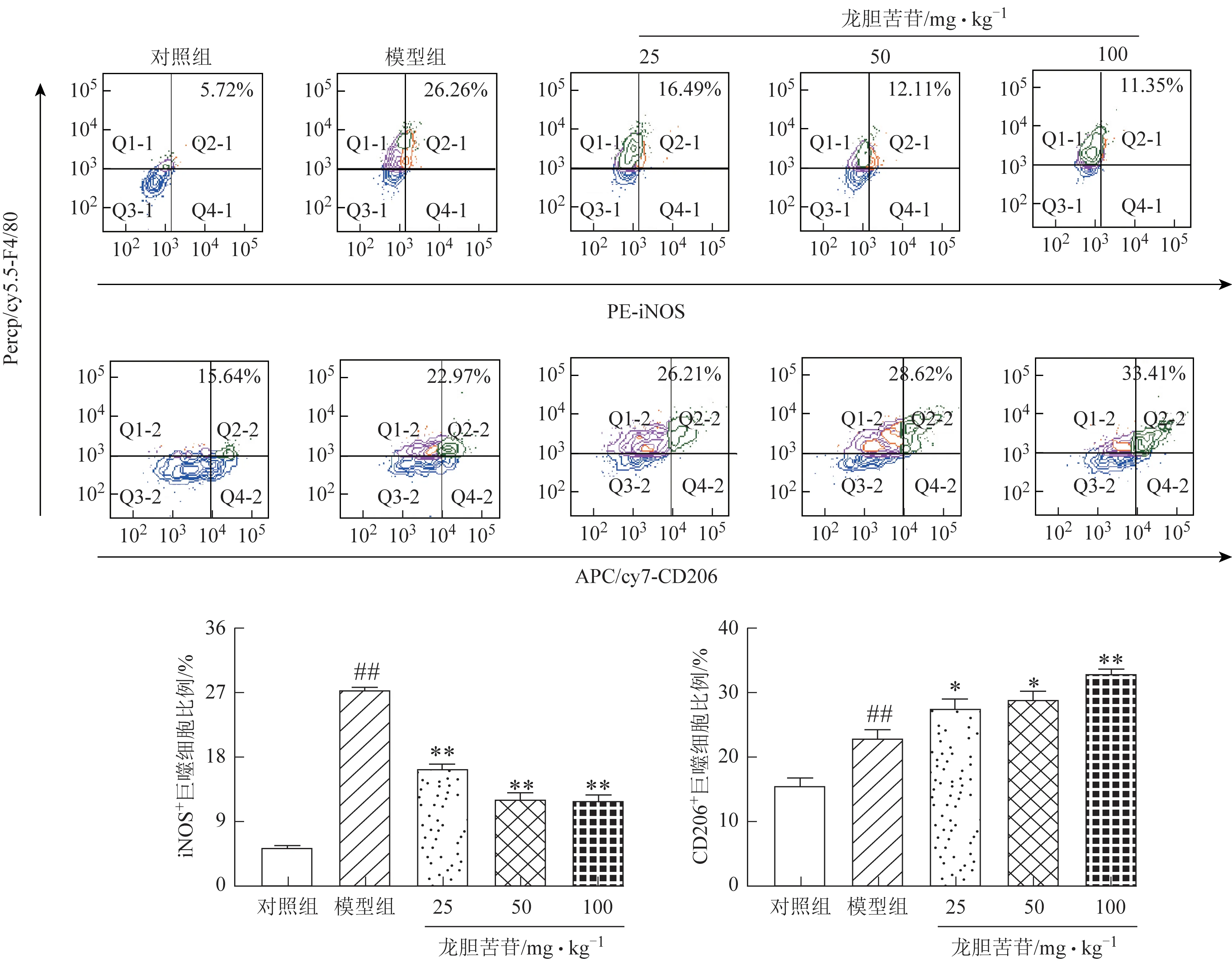
图5 龙胆苦苷对UC小鼠巨噬细胞极化的影响(, n=4)

图6 龙胆苦苷对UC小鼠巨噬细胞iNOS和CD206蛋白表达的影响(, n=4)
3.5 龙胆苦苷对JAK2/STAT3通路磷酸化的影响
结果显示,龙胆苦苷对JAK2 和STAT3 蛋白表达水平无明显的影响,但能明显下调p-JAK2 蛋白(P<0.05)及p-STAT3(P<0.05)蛋白的表达水平(图7)。结果发现,龙胆苦苷可能通过下调JAK2/STAT3信号通路的磷酸化表达影响巨噬细胞极化。
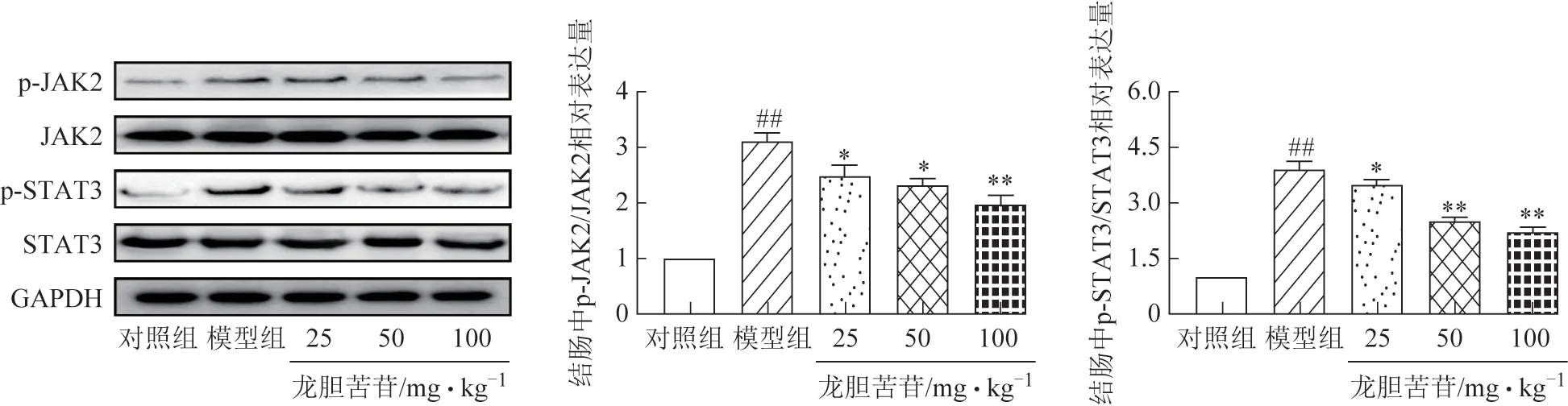
图7 龙胆苦苷对UC小鼠巨噬细胞JAK2/STAT3通路蛋白磷酸化的影响(, n=4)
4 讨论
龙胆苦苷是我国传统珍贵中药材龙胆的重要活性成分之一[7]。本研究结果显示,对DSS 诱导的UC小鼠给予龙胆苦苷干预,能够明显改善小鼠结肠损伤,减轻肠道炎症,并且作用机制可能是通过下调JAK2/STAT3 通路的磷酸化表达,进而上调肠道中M2 型巨噬细胞数量,下调M1 型巨噬细胞数量,调控巨噬细胞极化方向从而改善肠道炎性环境有关。
UC的中医证候包括大肠湿热、脾虚湿蕴、寒热错杂、脾肾阳虚、肝郁脾虚、热毒炽盛和阴血亏虚。因此治疗UC 应以清热利湿、温阳化湿为主[1]。龙胆性寒,味苦,清下焦郁火的功效尤为显著。现代药理研究表明,龙胆具有抗肿瘤、抗炎镇痛的作用[14]。UC 属于炎症性肠病的范畴。病理研究显示UC 患者肠黏膜屏障结构受损,从而影响免疫系统和神经内分泌系统,进一步导致肠道微环境受破坏,发生肠黏膜局部溃疡。在本研究中,DSS 能够诱导小鼠出现稀便、血便的症状,并且对结肠进行观察发现DSS能够缩短结肠长度,并使结肠厚度增加。利用疾病活动指数评价UC模型小鼠造模成功。同时,小鼠肠道屏障结构受损,肠道中抗炎因子IL-4和IL-10表达水平下降,促炎因子IL-6和IL-12表达上调,反映了UC 的发生。对UC 模型小鼠给予不同剂量的龙胆苦苷之后,其状态发生明显改变,稀便、血便症状减轻,DAI评分出现明显的下降。与此同时,龙胆苦苷能够下调UC小鼠肠道的促炎因子表达,并且上调抗炎因子的表达,缓解结肠缩短以及结肠厚度增加。值得留意的是,龙胆苦苷改善DAI、缓解肠道受损及肠道炎症的程度与给药剂量呈正比。综上,龙胆苦苷治疗UC具有显著的疗效,可明显改善稀便、血便,并且能够缓解结肠损伤,改善肠道炎性环境。
巨噬细胞是参与体液免疫和细胞免疫的一种重要的免疫细胞,极具可塑性和异质性。当机体局部环境受刺激时,成熟的巨噬细胞可进行极化以适应环境的变化[15]。根据极化后不同的细胞表明标记物及不同的细胞功能,可将极化后的巨噬细胞分为由干扰素-γ和脂多糖介导分化的M1 经典活化巨噬细胞和由白细胞介素和糖皮质激素等激活的M2 替代活化型巨噬细胞。M1型巨噬细胞可通过产生大量促炎因子参与初始炎症反应,如IL-6和IL-12,并发挥吞噬、清除入侵微生物和抑制肿瘤发生免疫逃逸的功能。M2 型巨噬细胞则可分泌大量抗炎因子如IL-10 和IL-4,并能促进血管生成,加速伤口愈合[6,16-17]。由于M1 和M2 型巨噬细胞作为2 种对炎症有着不同影响的巨噬细胞亚群,因此巨噬细胞被认为在多种炎症性疾病中发挥着重要的作用,巨噬细胞极化也被认为是调控炎症发展进程中的重要手段[18-19],调控巨噬细胞极化可运用于多种炎症性疾病以及炎症导致的癌变研究中[20-25]。本研究中,UC 小鼠稀便、血便严重,结肠长度和厚度的改变以及促炎因子的增加表明结肠发生严重的病理变化,伴有大量的促炎因子浸润,提示肠道中巨噬细胞极化方向更趋向于M1 型巨噬细胞,造成促炎/抗炎平衡破坏。对UC 小鼠给予龙胆苦苷之后,M2 型巨噬细胞比例上调且CD206 蛋白表达水平上升,提示肠道中巨噬细胞极化趋势倾向于向M2 型巨噬细胞极化。龙胆苦苷恢复肠道中抗炎/促炎平衡,同时修复肠道损伤,改善小鼠稀便血便。结果提示龙胆苦苷对DSS诱导的UC小鼠的治疗作用可能通过调控肠道中巨噬细胞的极化实现的。除此之外,炎症因子和巨噬细胞基因差异性表达的结果显示龙胆苦苷对炎症的缓解和对巨噬细胞的极化具有剂量依赖性,即随着龙胆苦苷剂量上调,作用越显著。本研究结果显示,龙胆苦苷高剂量(100 mg·kg-1)治疗效果最好,提示龙胆苦苷剂量大于100 mg·kg-1或许能发挥更明显的治疗UC效果。
巨噬细胞的极化和功能调节是多种因素共同作用下完成的,涉及多种信号通路转导和转录网络的调控[26]。其中,最常见的为JAK2/STAT3 通路,JAK2是一种蛋白酪氨酸激酶,存在于细胞质中并调节下游STATs基因表达,其中可直接影响STAT3 的磷酸化水平,从而影响细胞增殖、迁移和侵袭[27]。已有研究表明,JAK2/STAT3通路可诱导巨噬细胞向M1 型巨噬细胞的极化,生成和分泌大量促炎因子,其潜在的机制可能与核转录因子-κB通路相关[25]。在本研究中,龙胆苦苷各剂量对JAK2 及STAT3 蛋白表达水平均无明显影响,但能显著下调蛋白磷酸化水平,提示通路的表达受到龙胆苦苷的抑制,进而减缓巨噬细胞向M1型巨噬细胞极化的趋势。与巨噬细胞极化的检测相一致,龙胆苦苷100 mg·kg-1对JAK2/STAT3通路磷酸化水平抑制最明显,进一步证实高剂量龙胆苦苷可更有效地调控巨噬细胞的极化趋势。
综上所述,龙胆苦苷通过抑制JAK2/STAT3 通路的磷酸化水平,促使巨噬细胞向M2 型巨噬细胞极化,从而下调肠道促炎因子的分泌,上调抗炎因子水平,缓解DSS 诱导的小鼠肠道损伤以及肠道炎症,抑制UC 的发展。然而本研究对于龙胆苦苷调控巨噬细胞极化治疗溃疡性UC 只作初步探讨,进一步探讨龙胆苦苷治疗UC 的机制,仍然需要进行体外细胞和在体动物的正向和反向验证。

