伤害诱导普通白木香与奇楠种质沉香中倍半萜类成分及早期倍半萜合酶基因表达的差异分析△
吕菲菲,杨云,孙佩文,冯剑,刘培卫,刘洋洋,徐艳红*,魏建和,*
1.中国医学科学院 北京协和医学院 药用植物研究所 海南分所/海南省南药资源保护与开发重点实验室/国家中医药管理局沉香可持续利用重点研究室,海南 海口 570311;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
沉香是 瑞香科(Thymelaeaceae)沉 香属(AquilariaLam.)或拟沉香属植物伤害诱导防御反应形成的含树脂木材,是中国的传统名贵中药,广泛应用于中成药、藏药和日本汉方药中[1-2]。因具有独特的芳香气味,沉香也被广泛用于熏香香料行业,是高级香水香料的定香剂[3]。奇楠被认为是品质优良的沉香,外表油润光滑,香味醇厚,味微苦、麻、辣、清凉[4]。中国产的奇楠沉香以野生采挖为主[5],香农在野外采香的过程中发现某些白木香树经轻微伤害后可以持续地形成奇楠沉香,但这种优良性状很难通过有性繁殖而延续。近年来,香农将采挖的野生奇楠沉香树木进行嫁接扩繁,获得了可稳定遗传的奇楠种质,通过钻孔法伤害成功地生产了奇楠沉香,由奇楠种质生产的奇楠沉香已流通于市场。
倍半萜是沉香的主要成分之一,只有受伤害后才会在茎干、枝条和根内大量合成,其组成和含量决定了沉香的药用价值和芳香气味[6]。奇楠种质生产的奇楠沉香颜色重、油性大、香味独特,明显不同于普通白木香生产的沉香,可见2 种种质生产的沉香中倍半萜组分和含量有所不同,但倍半萜合成差异的分子调控机制尚缺乏研究。倍半萜合酶是白木香伤害诱导合成倍半萜的关键催化酶,其活性受基因表达调控[7]。健康白木香中倍半萜合酶几乎不表达,外界伤害刺激后,才会被激活诱导表达[8],倍半萜合酶基因表达一定程度上决定了白木香受到伤害后倍半萜合成的种类和含量。基于此,本研究以一种生产上的奇楠种质和普通白木香种质为研究对象,分析2 种种质所结沉香倍半萜组分的差异,以及伤害早期显著响应的7 个倍半萜合酶基因(AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS18、AsTPS20、AsTPS23)诱导表达模式,初步分析这2 种种质伤害诱导形成倍半萜差异的机制,也为沉香优良结香种质的鉴定和筛选、结香分子机制的解析提供依据。
1 材料
1.1 试药
奇楠种质及其所结沉香取自广东省茂名市电白区观珠镇,经中国医学科学院药用植物研究所海南分所采用DNA boarding 技术鉴定为白木香Aquilaria sinensis(Lour.)Gilg。普通白木香种质及其所结沉香取自海南省海口市中国医学科学院药用植物研究所海口研发中心。
乙醚(西陇科学股份有限公司);液氮(纯度>99.99%,海南佳腾化工气体有限公司);EASY-spin plus RN38型植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司);TransScript®First-Strand cDNA Synthesis SuperMix、TransStart®Top Green qPCR SuperMix、琼脂糖均购于北京全式金生物技术有限公司。
1.2 仪器
XPE 105 型电子天平(梅特勒-托利多公司);7890A型气相色谱-质谱仪(安捷伦公司);Nano Drop 2000C 超微量分光光度计(赛默飞世尔科技公司);LightCycler®96 型实时荧光定量聚合酶链式反应(qRT-PCR)仪(霍夫曼·罗氏公司);SB25-12DTDN型超声波清洗机(宁波新芝生物科技股份有限公司);MiniVac Beta 型真空离心浓缩干燥机(Labogene 公司);ChemiDoc™XRS+型凝胶成像仪(Bio-Rad公司)。
2 方法
2.1 倍半萜提取与测定
沉香倍半萜提取参考文献[9]方法,准确称取结香2 年沉香0.5 g,液氮研磨成粉,向粉末中加入乙醚5 mL,冰浴超声提取30 min,静置5 min,收集上清液备用。向沉淀中再次加入乙醚5 mL,重复提取2 次,合并3 次收集的上清液,真空旋转干燥,向干燥物中加入乙醚1 mL 溶解,经0.22 μm 滤膜滤过后,气相色谱-质谱法(GC-MS)测定化学组分。
GC 分析条件:毛细管柱为HP-5MS 5% Phenyl Silox(30 m×250 μm,0.25 μm);载气为氦气;柱体积流量为1.0 mL·min-1,不分流;进样口温度为240 ℃;升温程序:初始柱温60 ℃,保持2 min,5 ℃·min-1升至250 ℃,保持10 min,共运行50 min。
质谱条件:电子轰击离子源(EI);电子能为70 eV;离子源温度为230 ℃;四级杆温度为150 ℃;质量扫描范围为m/z50~300。
2.2 茎干总RNA提取和cDNA合成
选取3 年生健康茎干,直径为(1.2±0.2)cm,对茎干进行全断干伤害处理,并分别在伤害后0、2、6、24 h 截取伤口处2 cm 茎干(伤害诱导结香早期0~24 h 是伤害信号传递、防御反应启动、基因诱导表达相对最活跃阶段),立即投入液氮中冷冻,-80 ℃保存备用。
全断干伤害处理茎干经液氮研磨成粉,按照试剂盒说明书提取茎干总RNA,1.5%琼脂糖凝胶电泳检测RNA 完整性,测定RNA 浓度。取所提取的RNA 约500 ng,根据要求反转录合成cDNA第一条链,作为qRT-PCR模版。测定cDNA浓度。
2.3 qRT-PCR检测基因表达
根据本课题组白木香全基因组注释的倍半萜合酶基因序列,采用Primer 5.0 软件设计特异性引物(表1),由广州艾基生物有限公司合成,所有引物经PCR扩增后,产物由广州艾基生物有限公司测序验证。
qRT-PCR 检测基因表达量:20 μL PCR 体系包含Mix enzyme 10 μL,10 μmol·L-1的上下游引物各1 μL,反转录所得cDNA 1 μL 和双蒸水(ddH2O)7 μL。qRT-PCR 扩增程序:95 ℃预变性10 min,95 ℃变性10 s,按不同基因引物退火温度退火15 s(表1),72 ℃延伸20 s,共40 个循环,72 ℃延伸10 min。实验设定3 个重复。以三磷酸甘油醛脱氢酶(GAPDH)为内参[10],将qRT-PCR 所得的样品Ct值利用2-ΔΔCt方法转化为基因相对表达量值。使用SPSS 1.1.0 数据统计软件对检测结果进行单样本t检验显著性分析,结果以(-x±s)表示,P<0.05 为差异有统计学意义。

表1 沉香倍半萜合酶基因引物和扩增片段
3 结果与分析
3.1 倍半萜类成分差异
GC-MS 测定后,将测得的化合物与NIST 数据库比对,对匹配度>75%的21个倍半萜及其衍生物进行对比分析,发现普通白木香所结的沉香中有17个,奇楠沉香中有16 个,在奇楠沉香中检测到的香橙烯、柠檬烯、α-马榄烯、石竹烯4个倍半萜类化合物在普通白木香结的沉香中没有检测到,而普通白木香所结沉香中存在的蛇麻烯、(-)-马兜铃烯、别香橙烯、长叶醛、香橙烯氧化物1 也没有在奇楠沉香中检测到,可见2 种种质所结沉香倍半萜组分差异较大。对两者共有成分相对含量进行对比分析,发现倍半萜及其衍生物在两者中的相对含量也有所不同,如普通白木香所结沉香中α-檀香醇的相对含量是奇楠沉香的6 倍左右,而奇楠沉香中α-愈创木烯相对含量是普通白木香所结沉香的2 倍有余(表2),综上,奇楠沉香和普通白木香所结的沉香中倍半萜组分和含量差异明显。
表2 普通白木香所结沉香和奇楠沉香中倍半萜及其衍生物对比(, n=3)

表2 普通白木香所结沉香和奇楠沉香中倍半萜及其衍生物对比(, n=3)
注:根据Duncan′s多区间统计分析,上标不同字母代表各组间P<0.05。
3.2 倍半萜合酶基因检测
提取茎干的总RNA,经琼脂糖电泳检测明显有18S 和28S 2 条带,条带清晰,无拖尾,28S/18S 约为1.5(图1),说明提取的茎干总RNA 质量较好,经反转后可用于后续qRT-PCR检测。
图1 2种白木香茎干总RNA凝胶电泳
根据白木香全基因组(PRJNA524272)及前期白木香倍半萜合酶基因诱导表达模式[11]分析发现,伤害诱导结香早期显著响应的倍半萜合酶基因主要为AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS18、AsTPS20、AsTPS23。经PCR 扩增,扩增条带大小与设计引物得到的片段大小基本一致(图2)。将PCR产物测序,所得结果进行BLAST 比对,所有序列比对结果均符合全基因组注释结果,即所有扩增产物为倍半萜合酶的DNA序列。
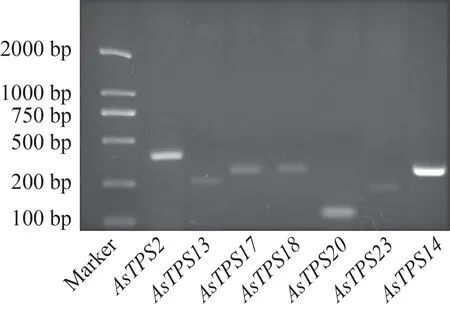
图2 7个倍半萜合酶基因在伤害处理白木香茎干中PCR扩增条带
3.3 普通白木香倍半萜合酶基因伤害早期诱导表达
对已验证序列的7个伤害早期诱导表达倍半萜合酶基因进行了qRT-PCR 检测,发现普通白木香AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS18、AsTPS20、AsTPS23基因均响应于伤害诱导,伤害24 h 内基因表达量均先上升,2 h 达到最大值后下降,诱导表达最大相对倍数均在几十倍到几百倍,诱导表达强度明显(图3),说 明AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS18、AsTPS20、AsTPS23均强烈响应于普通白木香的早期伤害诱导,且诱导表达模式基本一致,呈先上升后下降的态势。
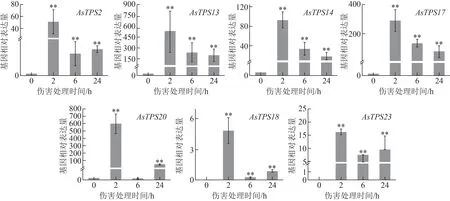
图3 不同伤害处理时间对普通白木香种质中7个倍半萜合酶基因诱导表达水平的影响(, n=3)
3.4 奇楠种质倍半萜合酶基因伤害早期诱导表达
经qRT-PCR 检测,发现除AsTPS18基因外,奇楠 种质中的AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS20、AsTPS23基因也都响应于伤害刺激,但各基因响应伤害诱导的表达模式不同,AsTPS2、AsTPS13、AsTPS14、AsTPS17和AsTPS23基因在伤害诱导24 h 内表达逐渐增强,基因表达量呈递增态势,AsTPS20则呈现先上升后下降的表达趋势,伤害诱导6 h 表达量最高,这6 个倍半萜合酶基因伤害诱导24 h 内最大表达相对倍数集中于十几倍到几十倍,与普通白木香相比诱导响应强度较低(图4)。AsTPS18基因在伤害诱导24 h 内表达不明显,6 h 达到最大表达量,仅为3.60,远低于普通白木香中的诱导相对表达量,其在奇楠种质中可能不是早期响应伤害的倍半萜合酶基因。说明除AsTPS18外,其余6 个倍半萜合酶基因在奇楠种质中均在伤害诱导结香早期有所响应,但与普通白木香中的基因诱导表达模式不一致,诱导表达强度相对普通白木香较低。
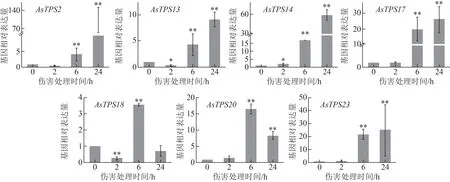
图4 不同伤害处理时间对奇楠种质中7个倍半萜合酶基因表达水平的影响(, n=3)
3.5 健康奇楠种质与普通白木香倍半萜合酶基因表达分析
为了进一步探索2 种种质的差异,对比了奇楠种质和普通白木香健康茎干内倍半萜合酶基因表达情况(图5),发现普通白木香种质中响应早期伤害的7 个倍半萜合酶基因在健康茎干中几乎不表达,而奇楠种质中除AsTPS2与AsTPS20外,AsTPS13、AsTPS14、AsTPS17、AsTPS23和AsTPS18表达明显,且高于健康白木香,说明健康的奇楠种质和普通白木香中倍半萜合酶基因的表达也存在明显差异。
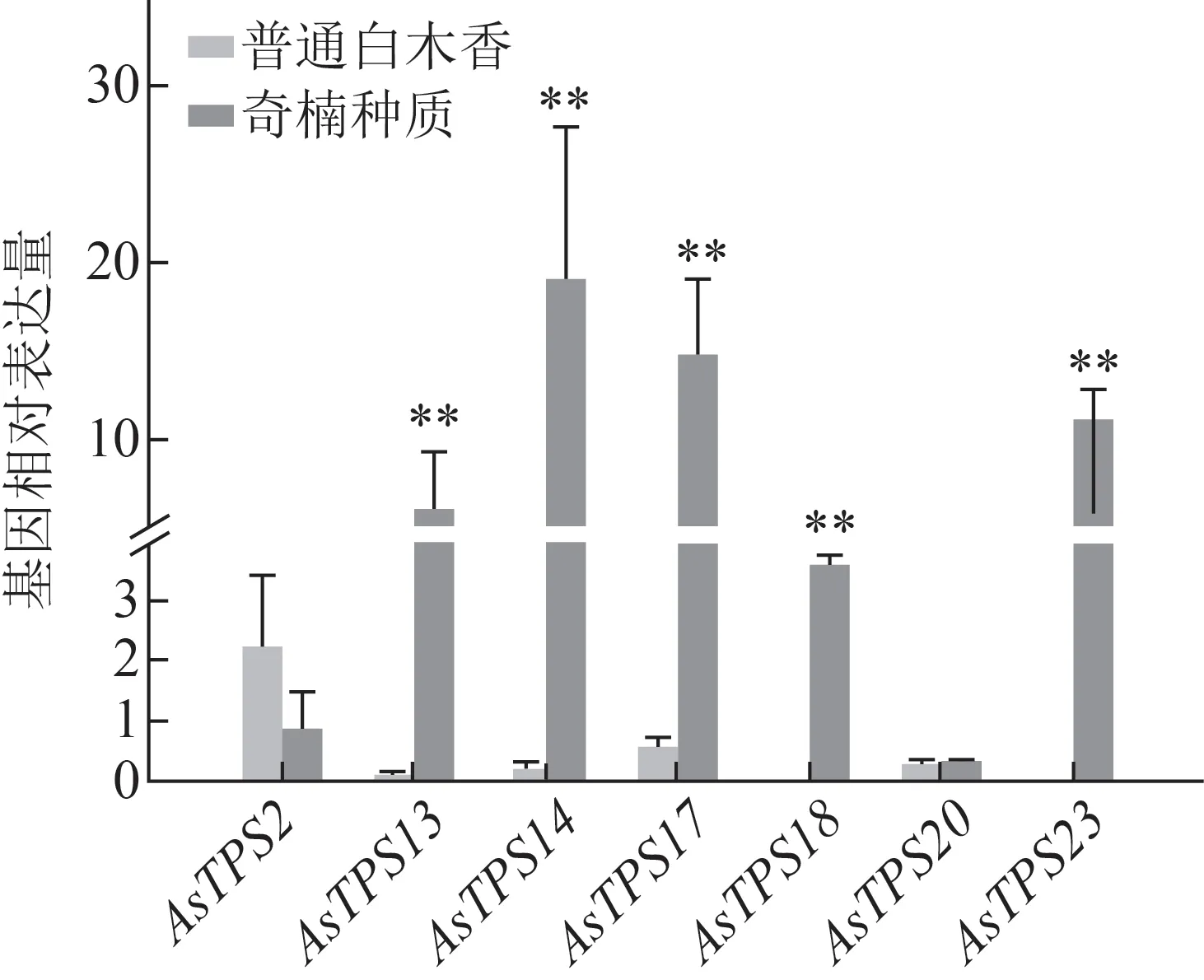
图5 奇楠种质和普通白木香健康茎干内7个倍半萜合酶基因表达对比(, n=3)
4 讨论
倍半萜是沉香的主要成分之一,其含量和组分在一定程度上决定了沉香的含油量和香味[4,12]。目前,奇楠种质生产的奇楠沉香含油量高,香味醇厚,品质明显高于普通白木香种质所结沉香。为了探索2种种质结香差异及筛选优良种质,本研究选取一种市面上大量推广嫁接的奇楠种质,发现其生产的奇楠沉香与普通白木香所结沉香的倍半萜组分有所不同,且共有组分含量差异也较大,说明在相同伤害下,奇楠种质和普通白木香种质诱导合成沉香倍半萜的分子调控机制存在差异,两者倍半萜组分和含量的差异可能是奇楠沉香品质优于普通白木香种质的关键原因。该发现与大麻不同品种间萜类组分不同的研究结果相一致[13]。
倍半萜是沉香属植物受伤害后形成的次生代谢产物,植物中多种因子协同调控其合成[14-17]。倍半萜合酶就是倍半萜合成的关键催化酶,可催化法呢烯焦磷酸(farnesyl pyrophosphate,FPP)形成不同的倍半萜骨架[7]。本研究发现普通白木香种质中伤害诱导结香早期显著诱导高表达的AsTPS2、AsTPS13、AsTPS14、AsTPS17、AsTPS20、AsTPS23基因在奇楠种质中响应强度较低,而AsTPS18基因在奇楠种质中几乎不响应于早期伤害诱导,可见倍半萜合酶基因诱导表达机制在奇楠种质和普通白木香种质中差异显著,表明2 种种质伤害后启动防御反应的机制有所不同,致使诱导合成倍半萜的组分和含量不同。此外,还发现AsTPS13、AsTPS14、AsTPS17、AsTPS23和AsTPS18基因在健康奇楠种质中表达量显著高于健康白木香,说明奇楠种质中倍半萜合酶基因表达更为敏感,这可能是盛传的奇楠种质不伤害也能产生奇楠沉香的原因。倍半萜合酶基因的差异表达机制是奇楠种质和普通白木香种质伤害诱导结香性能差异的关键调控机制,本研究首次从基因表达层面解析2 种种质结香性能差异,对其深入研究有助于完善沉香形成机制,差异表达倍半萜合酶的筛选和论证将为新的分子标记开发和沉香优良结香种质的鉴定提供参考。

