嗜酸粒细胞(Eos)与慢性鼻窦炎伴鼻息肉患者的临床病理特征的关系研究
姜翠菊,蔡永明*,张文渊,姜文锋,殷亚磊,陈皇胜,陈仁辉
(1.深圳市中西医结合医院 耳鼻咽喉科,广东 深圳518104;2.中山大学孙逸仙纪念医院 耳鼻咽喉头颈外科,广东 广州524023)
慢性鼻窦炎伴鼻息肉是临床上常见的耳鼻喉科疾病,临床研究数据显示其是由鼻窦、鼻腔炎性细胞聚集且并发组织重塑的鼻部疾病,由于致病因素较多、发病机制较为复杂,治疗较为困难。临床学者[1-2]认为嗜酸粒细胞(Eos)型和非嗜酸粒细胞(Non-Eos)型两种亚型炎性细胞聚集程度以及种类存在较大差异。Eos型慢性鼻窦炎伴鼻息肉患者首选口服糖皮质激素治疗,且临床学者[3-4]认为术前对慢性鼻窦炎伴鼻息肉患者进行分型能够提供更为有效的治疗方式,且对判断患者预后提供参考。本次研究探讨Eos与慢性鼻窦炎伴鼻息肉患者的临床病理特征的关系,为临床医师进行术前分型提供科学依据。
1 资料与方法
1.1 一般资料回顾性分析2017年1月至2019年1月于深圳市中西医结合医院接受治疗的122例慢性鼻窦炎伴鼻息肉患者的临床资料,根据病理切片是否发生Eos浸润将患者分为试验组和对照组,试验组发生Eos浸润,对照组未发生Eos浸润。试验组患者18例,男性11例,女性7例;病程5个月-38个月,平均病程(23.57±3.69)月。对照组患者104例,男性72例,女性32例;病程3个月-35个月,平均病程(24.83±4.11)月。纳入标准:①患者均符合2012年版《慢性鼻-鼻窦炎诊断和治疗指南》相关诊断标准[5]并确诊;②患者年龄在18-65岁之间;③患者临床资料完整。排除标准:①患者发生囊性纤维化或者真菌性鼻窦炎;②患者有免疫缺陷性疾病或者自身免疫性疾病;③患者合并全身感染类疾病;④分娩期、妊娠期、哺乳期妇女。本次研究经医院伦理委员会审核通过,符合相关伦理标准。
1.2 方法
1.2.1Eos检测方法 采集患者鼻息肉标本并对标本组织进行固定,切片后采用苏木精-伊红(上海浦科生物技术有限公司)进行染色,并选取高倍镜对标本组织炎性细胞进行初步分类并计数,操作由2名临床经验丰富的临床医师进行,计数取平均值;并计算Eos占总炎性细胞的百分比,当百分比<10%则为Non-Eos型慢性鼻窦炎伴鼻息肉,若百分比≥10%则为Eos型慢性鼻窦炎伴鼻息肉。
1.2.2评价标准 临床特征对比:收集患者临床资料,包括性别、年龄、Eos百分比、中性粒细胞百分比、淋巴细胞百分比,对比两组患者数据差异。鼻息肉病变情况:采用Lund-Kennedey评价标准结合鼻内镜检查结果对患者病变程度及病变范围进行评价,包括息肉、水肿、鼻漏3个内容,总分0-5分,分数越低患者病变情况越严重;采用Lund-Mackey评估标准结合CT检查结果对患者鼻窦病变情况进行评价,包括上颌窦、前组筛窦、后组筛窦、额窦、蝶窦、鼻道窦口复合体、蝶筛隐窝;总分0-5分,分数越高患者鼻窦病变越严重。
1.2.3统计学处理 应用SPSS24.0软件对研究数据进行统计学处理,两组计量结果比较采用t检验,计数资料比较用χ2检验;对具有统计学意义的相关因素行多因素logistic回归分析,P<0.05为差异具有统计学意义。
2 结果
2.1 慢性鼻窦炎伴鼻息肉患者临床资料比较对比两组患者性别、年龄、中性粒细胞百分比、淋巴细胞百分比数据对比不具有统计学差异(P>0.05),见表1。
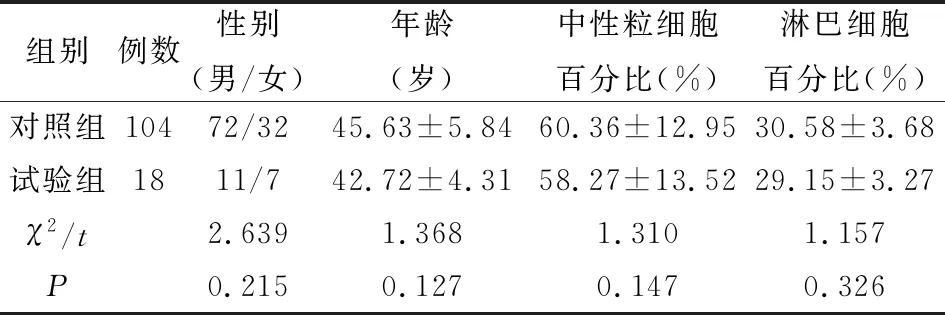
表1 两组慢性鼻窦炎伴鼻息肉患者临床资料比较
2.2 慢性鼻窦炎伴鼻息肉患者内镜检查Lund-Kennedey评分对比试验组鼻漏Lund-Kennedey评分显著高于对照组鼻漏Lund-Kennedey评分,数据对比具有统计学差异(P<0.05),见表2。

表2 两组慢性鼻窦炎伴鼻息肉患者内镜检查Lund-Kennedey评分比较(分)
2.3 慢性鼻窦炎伴鼻息肉患者CT检查Lund- Mackey评分对比试验组上颌窦Lund-Mackey评分显著高于对照组,试验组后组筛窦、鼻道窦口复合体、蝶筛隐窝Lund-Mackey评分明显高于对照组,数据对比具有统计学差异(P<0.05),见表3。
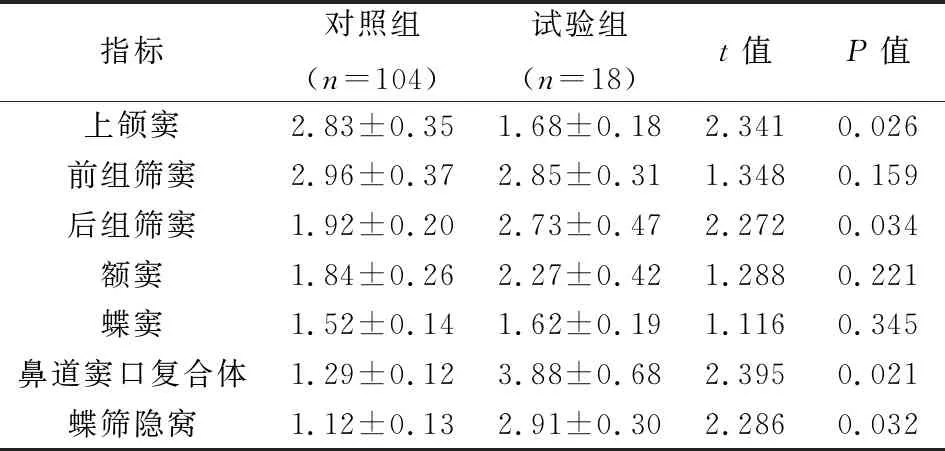
表3 两组慢性鼻窦炎伴鼻息肉患者CT检查Lund- Mackey评分比较(分)
2.4 影响慢性鼻窦炎伴鼻息肉患者发病的多因素logistic回归分析多因素回归分析结果显示,鼻漏、上颌窦、鼻道窦口复合体、蝶筛隐窝病变是导致慢性鼻窦炎伴鼻息肉患者发病的独立危险因素(P<0.05),见表4。
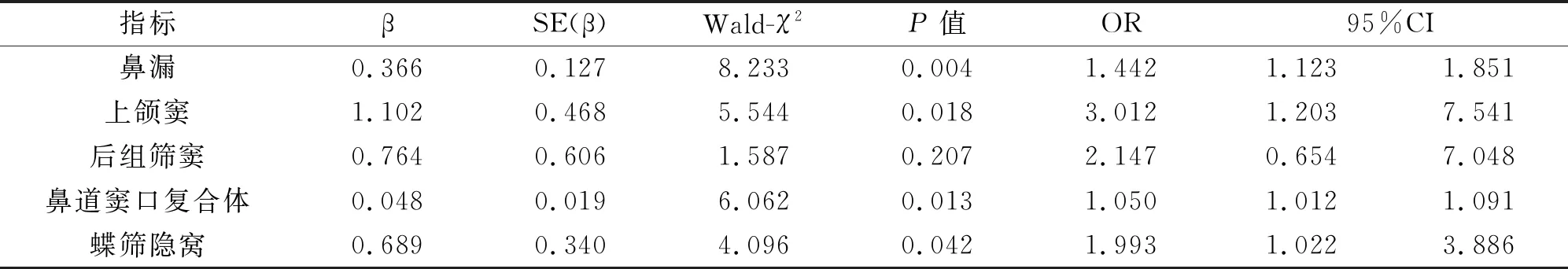
表4 影响慢性鼻窦炎伴鼻息肉患者发病的多因素logistic回归分析
3 讨论
慢性鼻窦炎伴鼻息肉是常见的耳鼻喉科疾病,患者发病后以黏性鼻涕、黏脓性鼻涕、鼻塞、嗅觉丧失、面部肿胀等临床症状为主,对患者的生活质量造成严重影响。临床研究[6-7]数据显示西方发达国家慢性鼻窦炎伴鼻息肉患者一般是由Th2细胞进行介导并发生炎性反应的发病过程,慢性鼻窦炎伴鼻息肉患者发病后一般会发生Eos浸润。目前诊断Eos慢性鼻窦炎伴鼻息肉普遍认可的标准是通过集体组织Eos浸润程度进行评价,且治疗方式一般是根据Eos浸润程度决定[8-9]。临床学者[10-11]认为慢性鼻窦炎伴鼻息肉发病机制较为复杂,且可能是由环境因素、遗传因素、真菌、病毒、变态反应等共同作用的结果,属于慢性炎症性病变的一种,由于局部可能存在活跃的炎症反应,因此患者炎症因子水平显著上升[12]。本次研究探讨Eos与慢性鼻窦炎伴鼻息肉患者的临床病理特征的相关性,为临床医师初步诊断慢性鼻窦炎伴鼻息肉患者提供临床参考。
本次研究两组患者性别、年龄、中性粒细胞百分比、淋巴细胞百分比数据对比不具有统计学差异(P>0.05);试验组Eos百分比显著高于对照组Eos百分比,数据对比具有统计学差异(P<0.05),可能原因是Eos细胞因子以及趋化因子对内皮细胞进行活化,并对Eos进行选择性粘附,从而使Eos细胞因子以及趋化因子在血管中向局部组织聚集,并进一步影响中性粒细胞以及淋巴细胞的数量[13]。两组患者息肉、水肿数据对比不具有统计学差异(P>0.05);试验组鼻漏Lund-Kennedey评分显著高于对照组鼻漏Lund-Kennedey评分,数据对比具有统计学差异(P<0.05),可能原因是患者组织中的Eos正常的凋亡、分化机制造成破坏,机体Eos增殖以及分化速度显著上升,或者Eos凋亡受到一定程度的抑制,导致机体中的Eos大量形成。两组患者前组筛窦、额窦、蝶窦Lund-Mackey评分对比不具有统计学差异(P>0.05);试验组上颌窦Lund-Mackey评分显著高于对照组,试验组后组筛窦、鼻道窦口复合体、蝶筛隐窝Lund-Mackey评分明显高于对照组,数据对比具有统计学差异(P<0.05),可能原因是患者发病后大量的炎性因子聚集于机体的鼻腔粘膜,维持甚至扩大黏膜的炎症反应,导致鳞状化生,并促进血管基质生产、纤维细胞增生,最终形成息肉[14]。多因素回归分析结果显示,鼻漏、上颌窦、鼻道窦口复合体、蝶筛隐窝病变是导致慢性鼻窦炎伴鼻息肉患者发病的独立危险因素(P<0.05)Eos较Non-Eos能够在慢性鼻窦炎伴鼻息肉患者机体中形成更为严重的炎症,且临床学者[15]认为Eos数量的增加更能反应慢性鼻窦炎伴鼻息肉患者的预后,提示临床医师可以根据Eos初步判断慢性鼻窦炎伴鼻息肉患者的预后情况,并对预测预后情况较差的患者给予必要的治疗措施,改善患者预后。

