两种芽孢杆菌共处理对感染黄龙病的柑桔苗的作用
徐媛媛,胡党振,南 京,詹 平,姜 玲
(华中农业大学园艺林学学院/园艺植物生物学教育部重点实验室/国家果树脱毒种质资源室内保存中心/华中地区园艺作物生物学与种质创制重点实验室,武汉,430070)
黄龙病Huanglongbing(HLB)是柑桔生产中最具破坏性的病害之一[1],当前黄龙病已蔓延到全世界53个国家(https://www.cabi.org/isc/datasheet/16567)[2]。我国共有广东、广西、福建、浙江、江西、湖南、云南、贵州、海南和四川等10个省(自治区)300余个县发生黄龙病[3]。据报道,美国佛罗里达州自2005年感染黄龙病后,近期柑桔产量只有1997年的近1/3[4-5]。引起黄龙病的病原菌为韧皮部杆菌(CandidatusLiberibacter spp.),其中,亚洲种(CandidatusLiberibacter asiaticus,CLas)是分布范围最广、危害面积最大的一个种。基因组分析表明,CLas为特殊的营养缺陷型细菌,无法自主合成组氨酸、色氨酸、硫胺素、苯丙氨酸和酪氨酸,必需从宿主细胞获取相应营养[6]。CLas缺乏编码毒素、酶或特殊分泌系统的基因,它通过消耗寄主营养生存,从而打破寄主代谢平衡,干扰植物的运输功能,引起淀粉、蔗糖和葡萄糖的积累,导致感病柑桔叶片韧皮部堵塞,进而在植株上表现出黄化斑驳症状[6-7]。黄龙病是一种系统性的柑桔病害,在柑桔叶、花、果、根系等器官都有症状表现。受黄龙病影响的柑桔根系密度锐减,新根生长受到抑制[8-9]。根据其昆虫媒介亚洲柑桔木虱(Citruspsyllid)以叶片汁液为食的特点,人们认为黄龙病病原优先在叶片定殖和发病[10],但有研究发现病原优先定殖于根部,成为“病原库”,从而使病原的滴度在不同器官、不同季节表现出差异[11]。胼胝质堆积通常被认为是植物阻止病原菌扩散的第一道防御反应[12],同时胼胝质堆积也造成植物韧皮部运输受到抑制[13]。
在与黄龙病几十年的抗争过程中,我国科学家总结出了黄龙病“三板斧”综合防控的措施[3]。其中,茎尖嫁接脱毒是获得健康苗木传统且可靠的方法,也是防控黄龙病的重要措施之一[14]。目前,柑桔优良品种的无病苗木供不应求,急需研究人员改进脱除病原的方法,但茎尖脱毒的效果受到茎尖带病程度的影响,如果先将母本带病率大幅降低,再实施微芽嫁接,则对于提高柑桔的病原脱除效率有极大的帮助。
芽孢杆菌(Bacillus)是土壤和自然界的优势微生物种群,很多种类都具有抑制植物病害的能力,如:枯草芽孢杆菌(B.subtilies)、短小芽孢杆菌(B.pumilus)和解淀粉芽孢杆菌(B.amyloliquefaciens)等[15-16]。芽孢杆菌能产生多种抗菌素和酶,具有广谱抗菌活性和极强的抗病能力,通过竞争、杀菌、促生等多种方式发挥作用[17]。有报道证明,解淀粉芽孢杆菌对植物病害有拮抗作用,如对番茄青枯病[18-19]、马铃薯晚疫病[20]等。使用混合生物控制剂(Biological Control Agent,BCAs)还可以增加不同环境下生物控制的稳定性[21]。这些事例给黄龙病的控制提供了启示。部分芽孢杆菌可以诱导系统抗病性(Induction of systemic resistance,ISR)[22],如:芽孢杆菌B-916可以诱导水稻的抗性[23]。生物控制剂在柑桔生产上的应用,未来依然有巨大潜力。
本研究通过复合芽孢杆菌的持续应用,寻找在柑桔苗木上控制和降低黄龙病病原的方法,达到降低母本植株病原浓度和提高脱毒效率的目的,并通过对生理指标的分析,结合显微观察,对复合芽孢杆菌处理减轻根系褐变进行解析,从而阐明复合芽孢杆菌缓解和控制黄龙病的理论依据,为解决柑桔无病良种繁育的瓶颈问题提供有效的手段。
1 材料与方法
1.1 菌剂的准备选用农业微生物国家重点实验室提供的贝莱斯芽孢杆菌TD2-1(B.velezensisiTD2-1)和解淀粉芽孢杆菌TD2-2(B.amyloliquefaciensTD2-2)用于感病柑桔苗木的处理。两种菌分别进行固体发酵。挑取单菌落,在LB液体培养基中200 转/min、37 ℃培养,分别取TD2-1和TD2-2培养菌液(OD600nm=1)10 mL,加入高压灭菌后的培养基中(培养基包括1 kg麦麸、1 kg米糠、0.4 kg玉米淀粉、0.2 kg豆粕、20 g红糖,按照料水比1∶1.1混匀),30 ℃固体发酵7 d,每天翻动1次。然后,将培养物在60 ℃下干燥,再粉碎为细粉,检测活菌数在200亿个/g。使用时,两种菌剂等量混合均匀,按所需剂量在清水中形成悬浊液,每株用量0.5 L。
1.2 菌剂处理方法南丰蜜桔苗木来源于江西南丰(江西南丰县果业局提供),均为1年生嫁接苗,砧木为枳,种植于大棚内,盆栽基质包含1/3泥炭、1/3蛭石和1/3腐殖土,2018年9月28日定植。处理组有15株苗木,对照组有4株苗木。所有苗木管理条件一致。处理组共进行了15次复合菌剂的灌根,从2018年12月12日起在大棚内1.6 g/L 2次(间隔时间为3周),从2月19日起在大棚外先2.5 g/L 7次(每隔二周处理1次)、后5 g/L 6次(每隔1周处理1次)。对照为清水处理。最后一次处理后24 h进行样品采集,样品贮存于-70 ℃,待用。
沙糖桔苗木为1年生苗,砧木为枳,来源于广西南宁,2018年5月28定植。苗木管理条件一致。处理组共进行了23次复合菌剂的灌根,其中,从2018年12月12日起在大棚内1.6 g/L 2次(间隔时间为3周),从2月19日起大棚外先2.5 g/L 7次(每隔2周1次)、后5 g/L 14次(每周1次)。对照为清水处理。
1.3 黄龙病检测方法从植株东、南、西和北四个方位分别采集叶片或枝皮,用液氮速冻碾磨成粉,用CTAB法提取DNA[24]。
使用OI1/OI2c和P400+/P400-两对引物用于PCR扩增,引物序列见表1。PCR扩增反应总体系为10 μL,其中,包含上下游引物(10 μmol/L)各0.1 μL,2×PCR mix(翊圣生物科技有限公司)5 μL,DNA样品1 μL,ddH2O 3.8 μL。PCR扩增反应程序为95 ℃变性3 min,60 ℃退火30 s,72 ℃延伸1 min,35个循环。用健康的柑桔愈伤组织做负对照,分别用pMD18-16S rDNA质粒和pMD18T-P400质粒做正对照。采用美国Bio-Rad PCR仪进行检测。
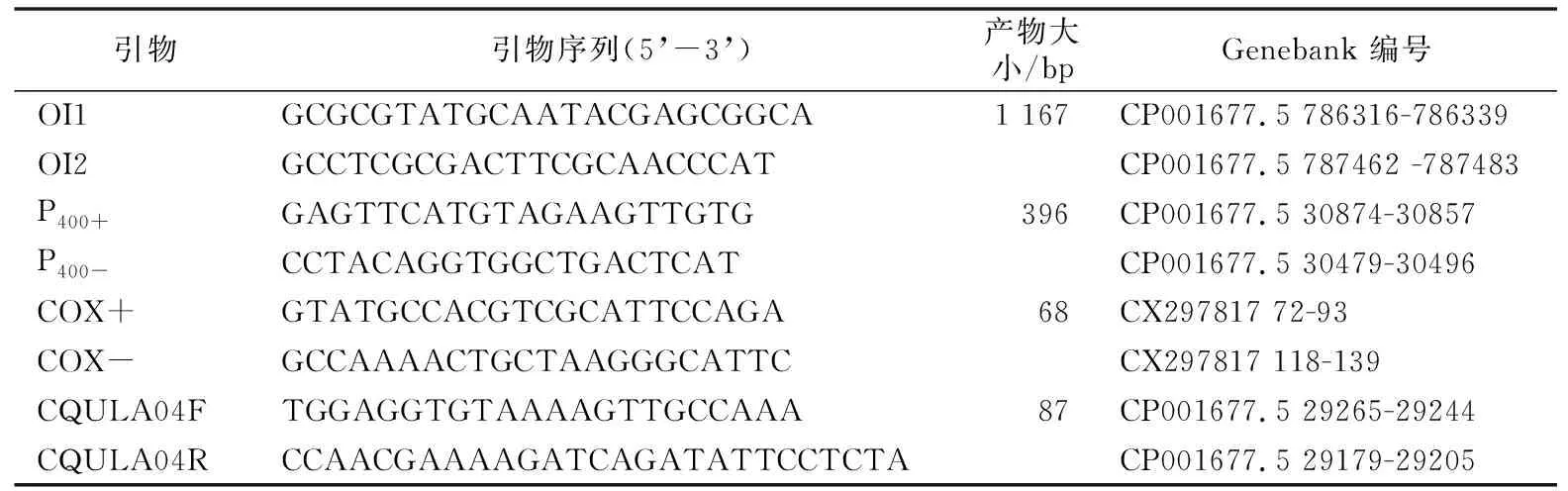
表1 柑桔黄龙病检测所用引物的信息
qPCR扩增在Corbett RG 6000仪器(德国)上进行,内参基因为植物细胞色素氧化酶基因COX[25-26],目的基因为柑桔黄龙病亚洲型病原的核糖体蛋白基因rpLJ/rp1L[25],引物信息见表1。引物由上海生工生物工程股份有限公司合成。qPCR反应程序为94 ℃变性3 min,94 ℃变性5 s,60 ℃退火30 s,72 ℃延伸35 s,40个循环。计算公式:ΔΔCt=(CT1目标基因-CT1看家基因)-(CT0目标基因-CT0看家基因),mRNA相对表达量为2-ΔΔCT[27]。设置3个重复,以健康愈伤组织为负对照。将负对照的2-ΔΔCT值设置为1,若样品的2-ΔΔCT值大于1,则认为样品为黄龙病疑似病株。
1.4 胼胝质含量和防御酶活性的测定胼胝质:2019年11月12日最后一次处理后24 h取样,取样部位为苗木中部接穗第3~5片叶。采用植物胼胝质酶联免疫分析试剂盒(江苏酶免实业有限公司)测定柑桔叶片中胼胝质含量,按照试剂盒说明书进行操作,用多功能酶标仪(TECAN)检测。
防御酶:2019年11月12日最后一次处理后12 h取样,取植株早秋梢上基部起第3-4个叶片,用液氮速冻并于-80 ℃保存。测定时准确称取0.5 g叶片于预冷的研钵中,根据文献[28-29]进行SOD、POD、CAT酶活测定;硫氧还蛋白还原酶(TrxR)使用北京索莱宝公司生产的试剂盒进行测定,TrxR单位活性以每克样品每分钟催化1 μmol DTNB还原为TNB表示。
以上试验处理和对照设置3~5个生物学重复,数据利用t-test进行统计学分析。
1.5 根系扫描电镜观察分别取南丰蜜桔处理组和对照组的根系,2019年11月12日最后一次处理后24 h取样,用清水洗净,切割成3~5 mm的小段,转入2.5%戊二醛溶液中固定,经磷酸缓冲液漂洗和乙醇梯度脱水,然后将样品用导电胶粘贴于样品台上,用离子溅射仪将样品表面镀膜后放入扫描电镜(HITACHI SU8010)腔室进行观察。
1.6 根系石蜡切片观察2019年11月12日在菌剂最后一次处理后24 h取样,分别取南丰蜜桔处理组和对照组的须根和根毛制作石蜡切片,切片及染色方法参考植物显微技术指导书[30]进行。利用德国Leica RM 2016轮转式切片机切片,用奥林巴斯BX53型生物显微镜进行切片观察。
1.7 脂肽类抗生素的RP-HPLC 分析与鉴定将伊枯草菌素A(iturin A)、表面活性素(surfactin)标准样品(标样)溶于色谱纯的无水甲醇配制成1 mg/mL的溶液,置4 ℃冰箱备用。RP-HPLC(反相高效液相色谱)分析系统为Waters分析型高效液相色谱仪,色谱柱为 ZORBAX Eclipse Plus C18(5 μm,4.6 nm×250 nm)。
iturin A的RP-HPLC检测波长为210 nm,柱温为25 ℃;等梯度洗脱,流动相A为10 mmol/L乙酸铵,流动相B为色谱纯乙腈,流动相之比为VA∶VB=65∶35;流速为1.0 mL/min;进样量为10 μL。
surfactin的RP-HPLC检测波长为210 nm,柱温为35 ℃;流动相A为色谱纯乙腈(含0.1%TFA),流动相B为超纯水(含0.1%TFA),起始流动相之比VA∶VB=60∶40,在洗脱前5 min内流动相之比均速变化为VA∶VB=93∶7,此后流动相之比保持不变;流速为1 mL/min;进样量为10 μL。
菌株TD2-2待测样品的准备按文献付瑞敏[31]方法进行。按上述操作进行检测。
2 结果与分析
2.1 两种芽孢杆菌共处理抑制黄龙病病原的效果试验结果看出,南丰蜜桔处理组样品,在菌剂处理前叶脉和枝皮的黄龙病病原阳性率分别为60%和93.33%,综合阳性率为100%;菌剂处理后叶脉和枝皮的阳性率分别为6.67%和53.33%,综合阳性率为53.33%,综合阳性率减少了46.67个百分点,处理前后的差异达到显著水平(p<0.05)。对照组样品,在处理前对应时间点叶脉和枝皮的黄龙病病原阳性率分别为25%和100%,综合阳性率为100%;处理后时间点叶脉和枝皮的阳性率分别为50%和75%,综合阳性率仍为100%。处理前,处理组与对照组的综合阳性率差异无显著性;处理后,处理组与对照组的综合阳性率差异有显著性(p<0.05)(见表2和表3)。
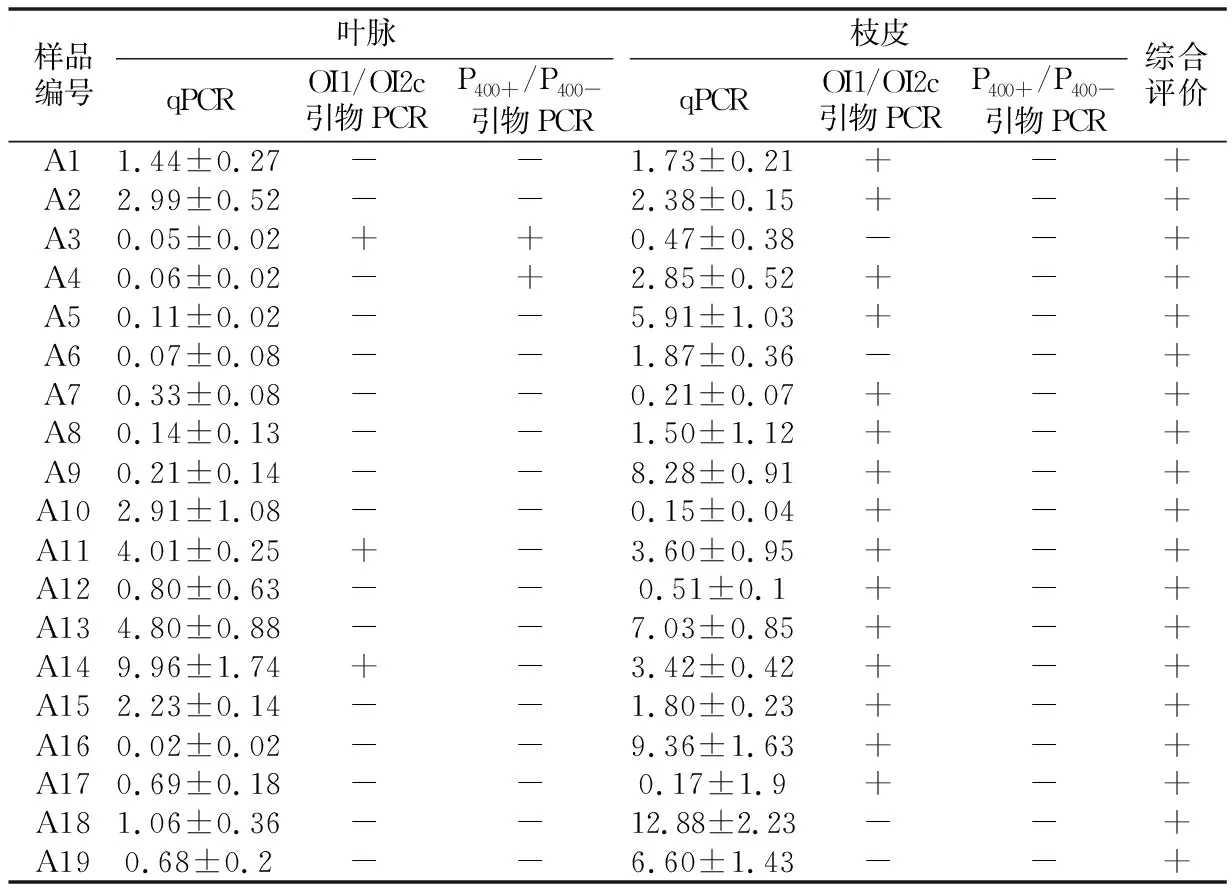
表2 两种芽孢杆菌共用处理前南丰蜜桔黄龙病病原检测结果
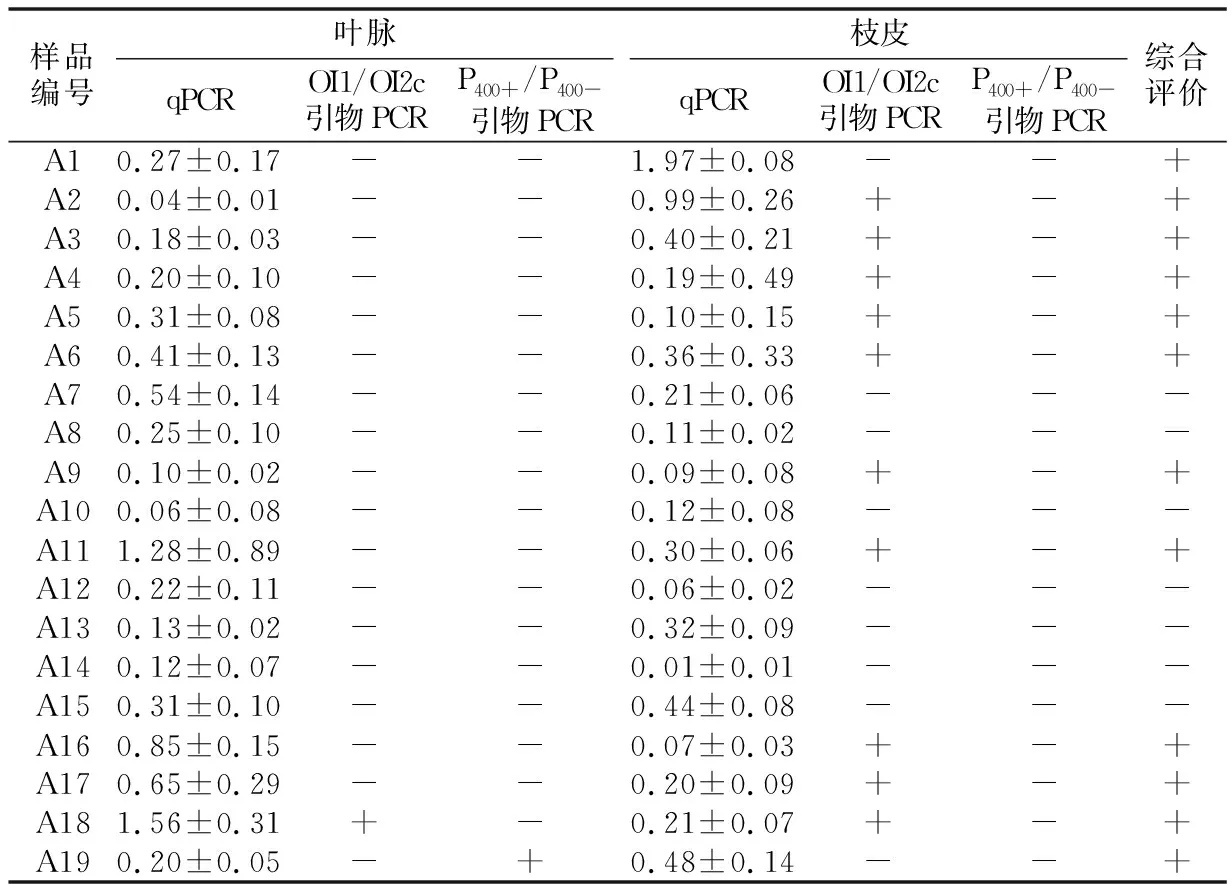
表3 两种芽孢杆菌共用处理后南丰蜜桔黄龙病病原检测结果
2.2 两种芽孢杆菌共处理降低叶片胼胝质含量的效果在菌剂处理后,南丰蜜桔处理组和对照组叶片中胼胝质含量分别为0.80和0.98 mg/g,两者的差异达到显著水平(p<0.05),相比对照组,处理组的胼胝质含量下降了18.37%(见图1)。
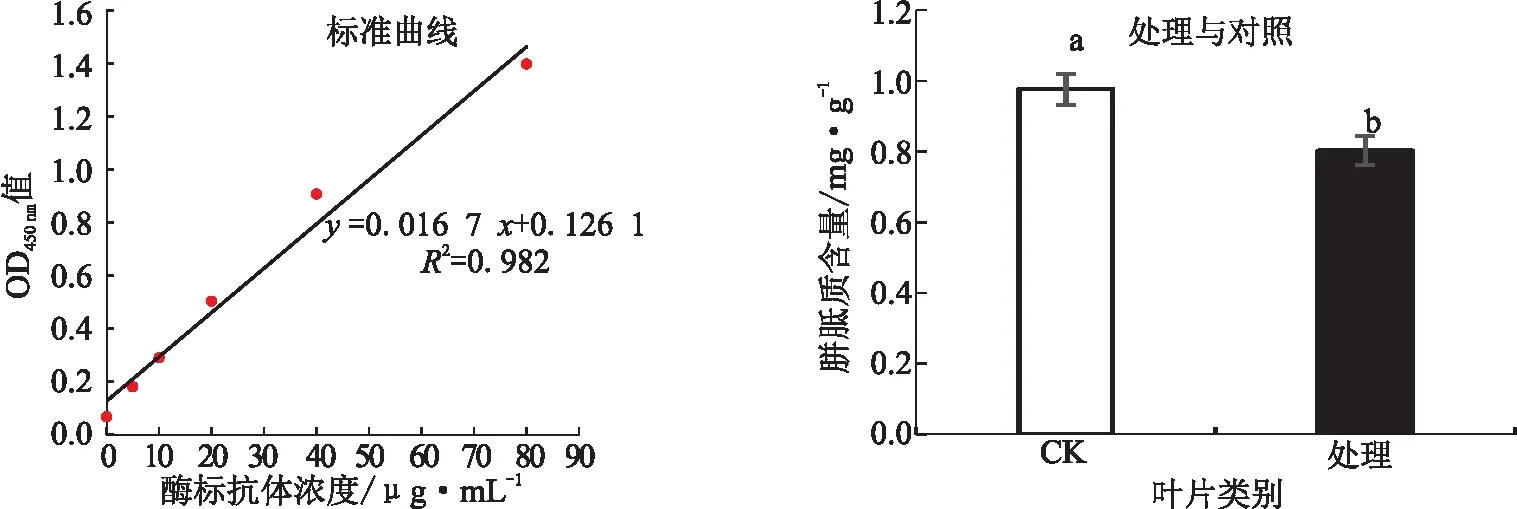
图1 两种芽孢杆菌共处理对 HLB 感病柑橘叶片胼胝质含量的影响
2.3 两种芽孢杆菌共处理对叶片防御酶活性的影响菌剂处理可以提高叶片SOD活性。在处理12 h后,SOD活性比对照组提高了23.0%,且在12~24 h一直保持较高活性。菌剂处理后,在0~24 h内TrxR活性呈升高趋势,在24~48 h一直保持在较高活性水平;在24 h时,TrxR活性为109.1 U/g,与对照组(50.9 U/g)的差异达到显著水平。菌剂处理后,在36 h内CAT活性缓慢升高;在36 h时达到最大值[74.4 ΔA240/(min·gFW)],比对照组[46.41 ΔA240/(min·gFW)]高了60.3%;在36~48 h内,CAT活力又快速下降至44.43 ΔA240/(min·gFW)]。 菌剂处理后,在48 h内POD活性一直平稳升高;在36 h时,POD活性[488.2 ΔA470/(min·gFW)]是对照组[294.0 ΔA470/(min·gFW)]的1.66倍,差异达显著水平;在48 h时,POD活性达到最大值523.5 ΔA470/(min·gFW),比对照组[303.7 ΔA470/(min·gFW)]高了72.4%(见图2)。
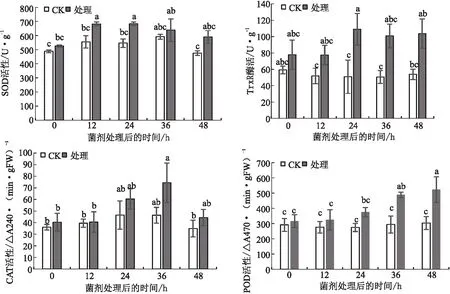
图2 感染黄龙病的南丰蜜桔经两种芽孢杆菌共处理后叶片防御酶活性的变化
2.4 两种芽孢杆菌共处理减轻根系褐变的效果试验结果看出,经菌剂处理后,南丰蜜桔处理前苗木(图3a和3b),处理后苗木(图3c和3d),处理组比对照组苗木生长更旺盛;处理组苗木分枝数多,根系较为发达,根系褐变现象轻(图3e至图3g);对照组苗木生长势相对较弱,新梢分枝少,新生根系较少,根系褐变现象突出(图3h至图3j)。

注:a(处理)和b(对照)为试验前苗木,c(处理)和d(对照)为试验后苗木,e—g为试验后处理根系,h—j为试验后对照根系。
经菌剂处理后,沙糖桔处理前苗木(图4a和4b)和处理后苗木(图4e和4f),图4c和4d分别是图4a和4b局部根系放大,有褐变现象发生。沙糖桔处理组苗木生长更旺盛,根系较为发达,须根数量多,仅有少量褐变根系(见图4h);对照组苗木生长势相对较弱,顶端有黄化叶片,新生根系较少,根系有木栓化和褐变现象(见图4g)。

注:a和b为试验前苗木,c和d是前两者根部放大,均可见到褐色根;e为试验后对照苗木,f为试验后处理苗木,g为试验后对照根系(有木栓化和部分根呈褐色),h为试验后处理根系(根系发达,仅有少量木栓化或褐色根系)。
2.5 两种芽孢杆菌共处理对根系结构的影响扫描电镜观察表明,处理组根系无明显病症,根尖粗壮饱满,根系外表皮细胞排列紧密,表皮光滑平整(图5A-a和图5A-b),在韧皮部筛管和伴胞中仅有少量的物质存在(图5A-c至图5A-d),说明复合芽孢杆菌处理后,筛管和伴胞细胞得到输通。而对照根系的根尖表皮细胞出现坏死,皮层细胞变形塌陷(图5A-e),根系表皮有明显鳞片状开裂和脱落现象,表皮细胞木栓化(图5A-f和图5A-g),韧皮部筛管和伴孢中有大量物质的聚积,在木质部导管细胞中有较多物质的聚集(图5A-h)。

注:电镜照片:两种芽孢杆菌共处理材料,a—d为肉眼观察表现正常的根系,e—h为褐化的根系。石蜡切片:a—d为对照样品,a.正常的根系,b.正常的根毛,c.褐化的根系,d.褐变的根毛。e—h为菌剂处理样品,e.正常的根系,f.正常的根毛,c.褐化的根系,d.褐变的根毛。字母注释:C为木栓层,E为表皮,En为内皮层,Px为初生木质部,Pp为初生韧皮部,X为木质部,Ca为形成层,P为韧皮部,M为髓部。染色结果为植物番红固绿染色结果:木质化的细胞壁及核呈红色,薄壁细胞、细胞质呈绿色。箭头所指字母表明具体的器官或组织。
在复合芽孢杆菌处理和对照材料中,肉眼观察为正常的根系和根毛,石蜡切片观察表明其表皮细胞、皮层、韧皮部、形成层、木质部和髓部组织均表现正常(图5B-a、 b、e 和 f)。在对照样品中,褐变的根系表皮和皮层细胞破裂,皮层细胞形状发生变化,形状不规则(图5B-c),褐变的根毛部分表皮细胞木栓化,皮层细胞排列松散,出现大空洞(图5B-d)。在复合芽孢杆菌处理的样品中,褐变的根系表皮细胞破裂,表皮细胞木栓化,皮层细胞变形(图5B-g),根毛表面只有少量表皮细胞褐化,但皮层、韧皮部、形成层、木质部和髓部组织均表现正常(图5B-h)。因此,复合芽孢杆菌处理刺激更多的新根产生,保持根毛内部结构呈正常状态,根毛破坏程度明显减小。
2.6 菌株TD2-2培养液粗提物的脂肽类抗生素检测在相同条件下,对surfactin标样与样品(菌株TD2-2培养液粗提物)进行RP-HPLC分析的结果表明,surfactin标样在保留时间11.549 min、13.274 min、13.741 min和15.511 min处出现特征峰,而TD2-2粗提物样品在surfactin特征峰出现的保留时间附近也出现峰,由此推测TD2-2粗提物样品中含有surfactin的同系物。在相同条件下,对iturin A标样和样品(菌株TD2-2培养液粗提物)进行RP-HPLC分析的结果表明,iturin A标样在保留时间17.433 min、27.136 min和29.286 min处出现了特异峰,TD2-2粗提物样品的特征峰不在iturin A标准峰位置出现,说明TD2-2粗提物样品中可能没有iturin A,或者iturin A被修饰,位置发生了偏移;同时发现,TD2-2粗提物样品的特征峰稳定地存在于15 min、23 min、25 min左右,推测可能有其他次生代谢物存在(见图6)。
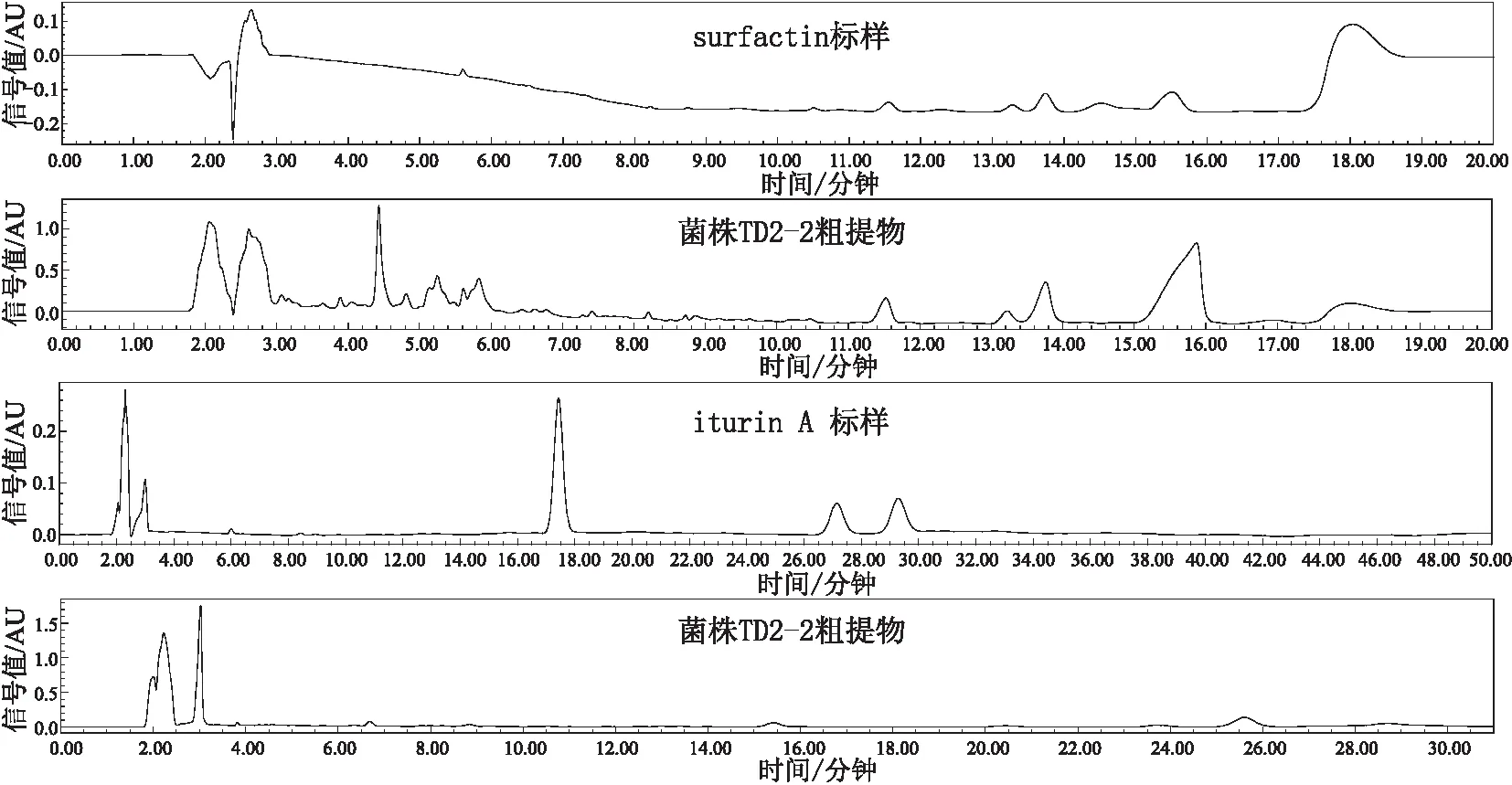
图6 菌株TD2-2次生代谢物的反相高效液相分析
3 讨论
利用贝莱斯芽孢杆菌TD2-1和解淀粉芽孢杆菌TD2-2悬浊液对南丰蜜桔感病苗木进行高强度和持续的灌根处理,降低了黄龙病病原关键基因在叶脉和枝皮中的表达量,黄龙病阳性率明显降低。这项研究对提高后续茎尖嫁接脱毒效率有潜在应用价值。
柑桔感染黄龙病后,胼胝质在叶脉韧皮部中沉积,并且编码胼胝质沉积的相关基因上调[6,11],导致形成层细胞增厚和无序化[8]。解淀粉芽孢杆菌和贝莱斯芽孢杆菌都具有很好的促生作用,解淀粉芽孢杆菌可以分泌多种植物生长因子,对植物产生多种作用[32-33]。本研究发现,两种芽孢杆菌共处理,叶片中胼胝质含量下降,叶脉堵塞现象得到缓解。
提高防御酶的表达,是植株通过ISR来抵御病原菌的主要方式之一。SOD为动植物体内抗氧化物保护酶,在植物抗性反应中起重要作用[34]。POD不仅参与植物体内次生代谢,同时参与体内过氧化产物的清理。
SOD和POD是细胞内清除活性氧系统中的重要酶,能有效地阻止O2-和H2O2在植物体内积累,防止细胞受自由基的毒害。PPO为植物体内酚类物质代谢的参与酶,其氧化产物醌类物质对病原物具有比酚类物质更强的毒性,在植物抗病性方面起着重要的作用[28,35]。曲慧[36]发现,解淀粉芽孢杆菌BP30可以诱导梨果实中POD和PPO的活力提高,从而增加对灰霉病的抗性。对拮抗菌C-02防治棉花黄萎病的研究表明,菌株C-02处理棉苗后,PAL、POD和PPO的活性提高幅度大,提高了棉苗的系统防御能力[29]。本研究通过复合芽孢杆菌处理感病柑桔苗木,诱导4种防御酶活性的提高,提高了柑桔苗木系统防御能力,减少了根系的褐化。
解淀粉芽孢杆菌分泌的抑菌物质丰富,常见的种类分为脂肽物质和聚酮类物质。如:解淀粉芽孢杆菌SQR9可以合成bacillomycin D(杆菌霉素D)和fengycin(芬荠素)两种脂肽,对香蕉枯萎菌有显著的拮抗作用[32]。在成功应用的解淀粉芽孢杆菌FZB42中就发现了3种聚酮类物质——地非西丁、大环内脂和杆菌烯,它们对细菌有强烈的抑制活性[37-38]。贝莱斯芽孢杆菌12-51对棉花黄萎病有拮抗作用[39]。本试验证明,解淀粉芽孢杆菌TD2-2可以产生表面活性素等次生代谢物。TD2-2对柑桔苗木黄龙病的缓解可能与其产生的表面活性素的杀菌作用密切相关。

