血清脂肪酸合酶、上皮钙黏素、再生蛋白4水平在早期胃癌中的诊断价值及与淋巴结转移的关系
陈艳红,谢云霞,刘涛
调查显示,中国胃癌发病率居恶性肿瘤前4位[1],因早期症状具有隐匿性,导致多数病人确诊时已处于中晚期,且80.0%病人存在局部淋巴结转移现象,5年生存率仅30%~40%[2]。胃镜检查在早期胃癌(early gastric cancer,EGC)诊断中具有一定价值,但其属侵入性操作,大部分人对此检查有恐惧心理。近年来,随分子生物学及检测技术进步,血清肿瘤标志物检测因操作简单、费用便宜等优势被逐渐应用于临床实际。脂肪酸合酶(Fatty acid synthase,FAS)作为一种代谢性致癌基因,其表达与肿瘤细胞的分化程度、侵袭及转移等均密切相关[3]。上皮钙黏素(E-cadherin)作为介导细胞-细胞间黏附的钙依赖性跨膜蛋白,黏附减弱是导致肿瘤发生、进展的关键因素之一[4]。再生蛋白4(regenerating islet-derived 4,REG4)在结直肠腺癌、腺瘤中表达显著上升,并与结肠癌的分化程度、分期及淋巴结转移相关[5],但其在胃癌中鲜有报道。鉴于此,本研究以血清FAS、E-cadherin、REG4水平为观察指标,探讨其在胃癌病人中的诊断价值及与淋巴结转移的关系。具体分析如下。
1 资料与方法
1.1 一般资料选取郑州大学第一附属医院2014年1月至2016年8月收治的早期胃癌病人88例作为观察组,其中男52例,女36例;年龄(55.74±5.18)岁,范围为32~69岁;采用免疫组化法分析淋巴转移情况:淋巴结转移病人35例,无淋巴结转移病人53例;另选取同期胃良性疾病病人80例作为对照组,其中男47例,女33例;年龄(56.15±4.79)岁,年龄范围为34~67岁。两组基本资料(年龄、性别)比较差异无统计学意义(P>0.05),具有可比性。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 选取标准
1.2.1 纳入标准 (1)观察组均符合以下标准:均经病理诊断、胃镜检查确诊为胃癌;术前临床分期为I a~I b期;均接受手术治疗;Karnofsky(KPS)评分≥70分;(2)两组临床资料均完整,且病人及近亲属同意与签署承诺书。
1.2.2 排除标准 (1)观察组预计生存时间<12个月者;(2)肝肾等重要脏器器质性病变者;(3)妊娠期或哺乳期女性;(4)非原发性胃癌者;(5)凝血机制紊乱或活动性出血者;(6)术前接受放疗、化疗或手术治疗者;(7)认知功能障碍或精神行为异常者。
1.3 观察指标(1)均于病理确诊前后1周内采集各病人的血清样本并进行检测,分析对比两组血清FAS、E-cadherin、REG4水平。其中血清检测方法为:空腹取3 mL静脉血,离心12 min,3 000 r/min,分离取血清,采用酶联免疫吸附试验检测血清E-cadherin、REG4、FAS水平,试剂盒购自上海臻科生物科技有限公司,严格按照试剂盒说明书操作。
(2)术后随访36个月,方式包括来院复查,电话微信随访及重点病人定期上门随访,获取其疾病情况及生存资料。
1.4 统计学方法采用SPSS 22.0软件分析处理数据。计量资料采用±s表示,组间比较采用成组t检验。计数资料用例(%)表示,组间比较采用χ2检验。此外,通过logistic多因素回归进行影响因素分析。采用ROC曲线进行诊断价值分析。采用Kaplan-Meier生存曲线+log-rank检验进行生存资料分析。P<0.05表示差异有统计学意义。
2 结果
2.1 两组血清FAS、E-cadherin、REG4水平比较观察组血清FAS、REG4水平高于对照组,E-cadherin水平低于对照组(P<0.001),见表1。
表1 两组脂肪酸合酶(FAS)、上皮钙黏素(E-cadherin)、再生蛋白4(REG4)水平比较/±s
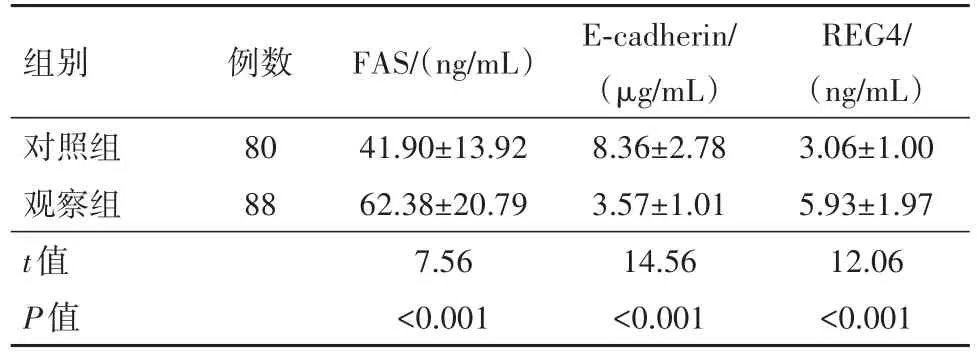
表1 两组脂肪酸合酶(FAS)、上皮钙黏素(E-cadherin)、再生蛋白4(REG4)水平比较/±s
组别对照组观察组t值P值例数80 88 FAS/(ng/mL)41.90±13.92 62.38±20.79 7.56<0.001 E-cadherin/(μg/mL)8.36±2.78 3.57±1.01 14.56<0.001 REG4/(ng/mL)3.06±1.00 5.93±1.97 12.06<0.001
2.2 血清FAS、E-cadherin、REG4对早期胃癌的诊断价值
2.2.1 血清FAS、E-cadherin、REG4指标的单独应用 血清FAS、E-cadherin、REG4三指标对早期胃癌有较高诊断价值,ROC-AUC分别为0.735、0.793、0.747。其中,E-cadherin的灵敏度较高,FAS和REG4的特异度较高。见表2。
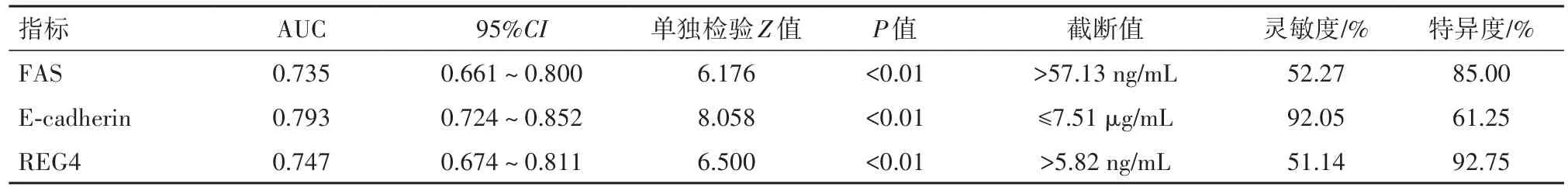
表2 血清脂肪酸合酶(FAS)、上皮钙黏素(E-cadherin)、再生蛋白4(REG4)对早期胃癌诊断价值的ROC分析结果
2.2.2 血清FAS、E-cadherin、REG4指标的联合应用 采用临床实用的综合联合诊断模式:仍使用三指标各自的诊断截断值,三个指标同为阳性或阴性时做阳或阴性诊断,否则进行复测。若复测结果不变,则结合专业实践及医师观点进行诊断并侧重考虑:阳性诊断参考E-cadherin指标(其灵敏度较高),阴性诊断参考FAS和REG4指标(其特异度较高)。结果:以本研究样本实测计算得:三指标的联合应用对早期胃癌的诊断价值:灵敏度和特异度分别为93.18%(82/88)、93.75%(75/80)。显然该联合模式,其诊断效能均比单一指标均有明显提高。
2.3 有无淋巴结转移病人临床特征比较以观察组为分析样本。有淋巴结转移病人分化程度、肿瘤最大径、浸润深度与无淋巴结转移病人相比,差异有统计学意义(P<0.001);两者年龄、性别、肿瘤部位、病理类型差异无统计学意义(P>0.05),见表3。
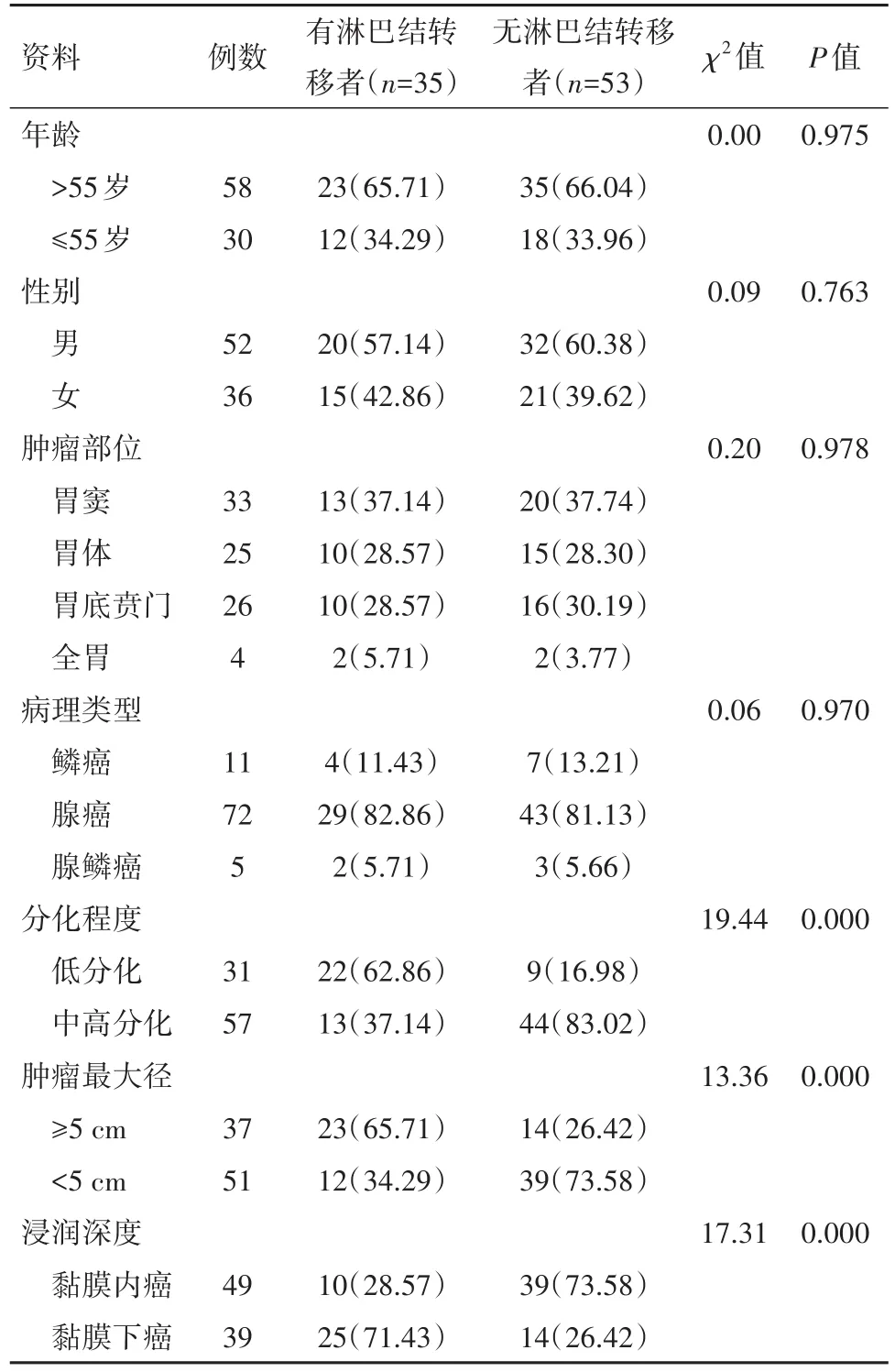
表3 早期胃癌88例有无淋巴结转移病人临床特征/例(%)
2.4 有无淋巴结转移病人血清FAS、E-cadherin、REG4水平以观察组为分析样本,有淋巴结转移病人血清FAS、REG4水平高于无淋巴结转移病人,E-cadherin水平低于无淋巴结转移病人(P<0.001),见表4。
表4 早期胃癌88例有无淋巴结转移病人血清脂肪酸合酶(FAS)、上皮钙黏素(E-cadherin)、再生蛋白4(REG4)水平比较/±s
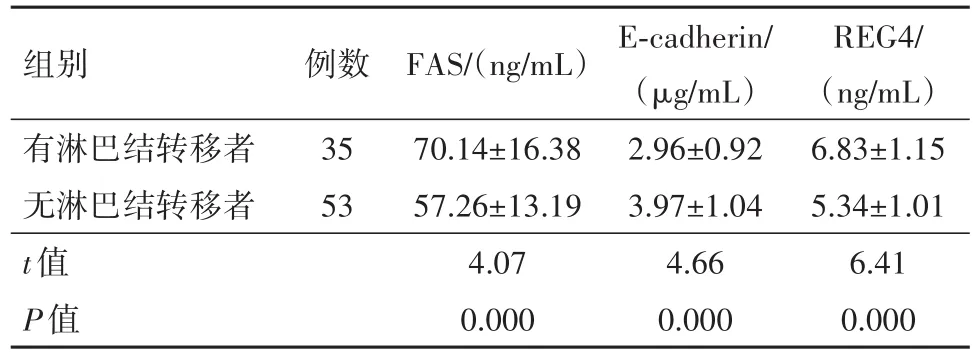
表4 早期胃癌88例有无淋巴结转移病人血清脂肪酸合酶(FAS)、上皮钙黏素(E-cadherin)、再生蛋白4(REG4)水平比较/±s
组别有淋巴结转移者无淋巴结转移者t值P值例数35 53 FAS/(ng/mL)70.14±16.38 57.26±13.19 4.07 0.000 E-cadherin/(μg/mL)2.96±0.92 3.97±1.04 4.66 0.000 REG4/(ng/mL)6.83±1.15 5.34±1.01 6.41 0.000
2.5 早期胃癌淋巴结转移的影响因素仍以观察组为分析样本,以早期胃癌是否发生淋巴结转移作为因变量(1=发生淋巴结转移,0=否),将分化程度、肿瘤最大径、浸润深度、血清FAS、E-cadherin、REG4作为自变量,建立非条件Logistic回归模型。为提高统计效率并使回归结果清晰,将部分为连续数值的自变量,按观察组均值进行分段(分层),转化成两分类变量。各变量赋值参见表5。回归过程采用逐步后退法,以进行自变量的选择和剔除,设定α剔除=0.10,α入选=0.05。回归结果显示:分化程度(低分化)、肿瘤最大径(≥5 cm)、浸润深度(黏膜下癌)、血清FAS(升高)、E-cadherin(降低)、REG4(升高)均是早期胃癌淋巴结转移的危险影响因素(P<0.05,OR>1),见表5。
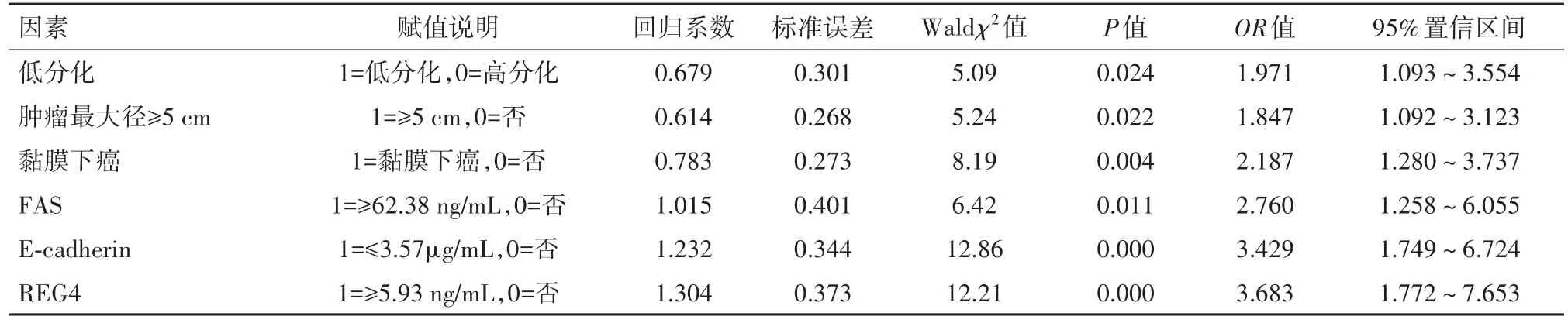
表5 早期胃癌淋巴结转移的影响因素
2.6 生存分析进一步探讨FAS、E-cadherin、REG4三指标对早期胃癌病人预后的关系,对本研究病人随访3年,获取其生存资料,并以观察组FAS、E-cadherin、REG4三指标的均值分别分为对应指标的高表达组和低表达组,建立Kaplan-Meier乘积生存模型,行两组生存率的logrank检验。分析显示:FAS、E-cadherin、REG4高表达组、低表达组的生存资料对比,均差异有统计学意义(χ21=5.27,P1=0.022;χ22=6.17,P2=0.013;χ23=10.92,P3=0.001)。
3 讨论
数据表明,我国每年死于胃癌人数约高达17万,而研究发现,早期胃癌病人术后生存率可由30.0%~40.0%提高至80.0%~90.0%[6]。血清生物学标志物是近年肿瘤诊断常用手段,具有敏感性高、操作便捷等优势,但癌胚抗原、多种糖类抗原等血清标志物仅能反映早期胃癌发病机制中某一方面,故探寻特异性、敏感性更高的早期胃癌血清标志物是当前亟需解决问题。
FAS主要产物为软脂酸,参与合成细胞膜所需的磷脂及肺泡表面活性物质、细胞内信号传导及蛋白质酰化[7]。国外相关报道指出,FAS表达在肿瘤发生早期阶段、癌前病变形成中发挥重要作用,且≥70.0%早期胃癌病人出现FAS过度表达现象[8]。本研究结果显示,血清FAS水平在早期胃癌病人中呈异常高表达状态,并是早期胃癌淋巴结转移的独立危险因素,与Allina等[9]研究相似。研究也认为,内源性脂肪酸是肿瘤细胞生长的能量、物质来源,而FAS作为脂肪酸合成步骤中的关键酶,能激活磷脂酰肌醇3-激酶(PI3K/Akt激酶)信号通路-固醇调节原件结合蛋白(SREBPs)调控途径[10],提高SREBP-1水平,进而刺激FAS表达增多,抑制早期胃癌肿瘤细胞凋亡,调控细胞周期,促进肿瘤细胞增殖、侵袭及迁移,形成恶性循环,充分说明FAS参与早期胃癌的发生、侵袭及转移。进一步对比不同血清FAS水平病人3年生存率可知,血清FAS高表达者3年总生存率明显低于低表达者,与税明才、熊标[11]观点相符,提示FAS有望成为评估早期胃癌生存率的重要血清生物标志物,为临床预后评估提供数据指导。
E-cadherin是上皮间质转化过程中的关键蛋白,其水平下调或缺失,可降低肿瘤细胞间紧密连接,诱导肿瘤细胞向周围组织浸润及远处转移[12-13]。谭生权等[14]通过酶联免疫吸附试验检测158例早期胃癌病人、158例体检健康者血清E-cadherin水平,结果显示,血清E-cadherin水平在早期胃癌病人中表达下调,支持本研究观点。E-cadherin缺失可启动胰岛素样生长因子1(IGF1)信号通路,激活βcatenin,提高癌基因IFITM表达,同时其还能诱导STAT3磷酸化,调控胃癌细胞增殖、凋亡及分化等多个生物过程[15],有力佐证了血清E-cadherin在胃癌发生、发展中具有一定促进作用。ROC曲线进一步证明,E-cadherin以7.51 μg/mL为最佳截断值,诊断早期胃癌的AUC最大(0.793)、灵敏度最高(92.05%),提示E-cadherin可作为诊断早期胃癌的敏感性肿瘤标志物,为临床及早检出早期胃癌高危人群提供科学依据。进一步经ROC曲线证明,采用临床常用三指标综合联合应用模式,对早期胃癌诊断效能均较单一指标有明显提高,且灵敏度和特异度分别可达93.18%(82/88)、93.75%(75/80),提示联合检测血清FAS、E-cadherin、REG4水平有助于提高早期胃癌的诊断灵敏度及特异度,为临床鉴别提供重要依据。
此外,经K-M曲线分析得出,血清E-cadherin表达下调可增加死亡风险,影响胃癌病人总生存率,说明血清E-cadherin在预测胃癌病人预后方面具有一定价值,建议临床监测血清E-cadherin水平,有助于延长病人生存时间。
经体外实验发现,肿瘤细胞可通过自分泌或旁分泌将REG4转移至胞外,抑制细胞凋亡,推测REG4通过抗凋亡机制,发挥促进肿瘤细胞生长、增殖作用[16]。朱燕、黄淑玲[17]研究指出,REG4在早期胃癌病人中出现水平上调趋势,并经ROC曲线进一步分析发现,REG4对早期胃癌的诊断特异性高达92.75%,表明REG4参与早期胃癌的发生、发展,有望成为诊断早期胃癌特异性血清标志物。REG4表达水平升高,可增强蛋白-1(AP-1)转录因子活性,激活下游靶基因表达,活化EGFR/AKT/AP-1信号传导通路,促进Bcl-2、Bcl-XL等活性及表达明显增加,有助于加快胃癌病人肿瘤细胞有丝分裂及增殖速度,强化肿瘤侵袭力及抗凋亡能力,进而参与细胞基质降解、异常黏附、肿瘤新生血管形成等多个环节[18]。通过Logistic多因素回归分析显示,血清REG4表达上调是早期胃癌淋巴结转移的独立危险因素,与杜琳等[19-20]研究相似,充分证实血清REG4异常高表达可促进早期胃癌病人临床病理特征进展,可作为淋巴结转移胃癌病人不良预后的预测因子。
综上可知,血清FAS、E-cadherin、REG4水平可考虑作为诊断早期胃癌的潜在有效肿瘤标志物,其水平异常表达是早期胃癌淋巴结转移的独立危险因素。

