金丝桃苷下调微小RNA-199a对脂多糖诱导的人肺泡上皮细胞的影响
申玲君,张海瑞,邵伟,冯振霞,邬超
急性肺损伤(acute lung injury,ALI)是肺部损伤引起的全身炎性反应,其严重时可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),严重威胁患者生命健康[1]。研究发现一些中药和中药单体防治急性肺损伤效果显著[2-3]。金丝桃苷是一种重要的天然产物,在各种植物中分布广泛,金丝桃苷具有抗氧化、抗肿瘤、保护心/脑缺血、保肝、免疫调节等作用[4]。研究发现金丝桃苷具有效改善博来霉素诱导的小鼠肺纤维化作用,且其机制可能与抑制胶原分泌、抑制炎症反应有关[5]。金丝桃苷能够抑制肺炎支原体肺炎小鼠的损伤[6]。金丝桃苷可能通过抑制Toll样受体4(toll-like receptors 4,TLR4)和NOD样受体蛋3(NOD-like receptor protein 3,NLRP3)通路减轻脂多糖(lipopolysaccharide,LPS)所致的急性肾损伤[7]。然而金丝桃苷对急性肺损伤的影响及机制尚不清楚。研究表明肺泡上皮细胞损伤、炎性细胞浸润是ALI的病理特点,炎性细胞、肺泡上皮细胞和血管内皮细胞在ALI中发挥重要作用[8]。本研究自2020年1―5月以人肺泡上皮细胞(HPAEpiC)为研究对象,探讨金丝桃苷对LPS诱导的HPAEpiC细胞的凋亡和炎症因子影响及可能的机制。
1 材料与方法
1.1 材料HPAEpiC购自上海康朗生物科技有限公司;胎牛血清、DMEM培养基购自美国Gibco公司;LPS购自美国Sigma公司;金丝桃苷购自上海源叶生物科技有限公司;四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium assay,MTT)试剂盒购自上海晶抗生物工程有限公司;细胞周期检测试剂盒购自上海贝博生物公司;膜联蛋白V-异硫氰酸荧光素/碘化丙锭(Annexin V-FITC/PI)凋亡检测试剂盒购自北京冬歌博业生物科技有限公司;酶联免疫吸附试验(ELISA)购自上海钰博生物科技有限公司;荧光定量试剂盒购自上海经科化学科技有限公司;RIPA蛋白裂解液、二辛可宁酸(BCA)试剂盒购自北京凯瑞基生物科技有限公司。
1.2 细胞处理与分组人肺泡上皮细胞HPAEpiC在含10%胎牛血清的DMEM培养液37℃、5%二氧化碳培养箱培养,在细胞生长至汇合度为80%左右时,用1 μg/mL LPS处理,作为模型组,正常培养的细胞作为对照组;分别用 2.5 μmol/L、5.0 μmol/L、10.0 μmol/L 金丝桃苷和1 μg/mL LPS处理 HPAEpiC,分别为低、中、高剂量药物组。
将anti-miR-NC、anti-miR-199a转染至HPAEpiC中,分别为anti-miR-NC组、anti-miR-199a组;将miRNC、miR-199a转染至HPAEpiC后再用10.0 μmol/L金丝桃苷和1 μg/mL LPS处理,分别作为高剂量药物组+miR-NC组、高剂量药物组+miR-199a组。
1.3 MTT检测细胞增殖在各组细胞培养至48 h时,每孔分别加入20 μL的MTT溶液,继续孵育4 h后弃上清液,每孔加入DMSO 150 μL,振荡反应10 min使沉淀溶解,用酶标仪于波长570 nm处检测吸光度(OD)值。
1.4 流式细胞仪检测细胞周期收集细胞,用预冷的PBS洗涤3次,离心沉淀细胞,弃上清;然后重悬细胞,加入预冷的80%乙醇固定;用PBS洗涤细胞3次,加入核糖核酸酶A(RNase A),37℃孵育30 min,加入碘化啶(PI)染色液,4℃染色15 min,上机检测激发波长488 nm处红色荧光,用流式细胞仪和DNA细胞周期分析软件对细胞周期进行分析。
1.5 流式细胞术检测细胞凋亡细胞培养48 h后用预冷的PBS漂洗2次,然后加入10 μL的Annexin V-FITC,再加入5 μL的PI,混匀后避光孵育10 min,用流式细胞仪检测细胞凋亡率。
1.6 酶联免疫吸附试验(ELISA)检测肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)水平各组细胞培养48 h后取上清,具体按照试剂盒操作进行检测。
1.7 实时荧光定量PCR(RT-qPCR)检测miR-199a表达水平各组细胞培养48 h后提取细胞总RNA,将RNA反转录成cDNA,进行PCR扩增,反应条件为94 ℃ 30 s,55 ℃ 30 s;72 ℃ 45 s,共40个循环;60 ℃延长5 min。相对表达量采用2−ΔΔCt法计算。miR-199a以U6为内参,miR-199a正向引物序列:5'-ACACTCCAGCTGGGCCCAGTGTTCAGACTAC-3',反向引物序列:5'-TGGTGTCGTGGAGTCG-3';U6正向引物序列:5'-CTCGCTTCGGCAGCACA-3',反向引物序列:5'-AACGCTTCACGAATTTGCGT-3'。
1.8 蛋白质印迹(Western blotting)法检测半胱天冬蛋白酶3(Cleaved-caspase3)、半胱天冬蛋白酶3前体(pro-caspase3)蛋白表达提取细胞总蛋白,BCA试剂盒进行定量。聚丙烯酰胺凝胶电泳后将蛋白转移至PVDF上。用5%脱脂牛奶室温封闭90 min,加入相应的一抗,4℃孵育过夜,PBS洗涤3次;再加入二抗室温孵育2 h,PBS洗涤3次,在暗室中曝光显影,定影,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的灰度值,以目的条带和甘油醛-3-磷酸脱氢酶(GAPDH)条带的比值作为蛋白表达水平。
1.9 统计学方法采用SPSS 20.0软件进行统计学分析,计量资料用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 金丝桃苷对LPS诱导的HPAEpiC细胞活力的影响与对照组(0.81±0.04)相比,模型组细胞OD值(0.35±0.02)降低(P<0.05);与模型组相比,低、中、高剂量药物组细胞OD值[(0.49±0.02)、(0.60±0.03)、(0.72±0.03)]升高,且呈剂量依赖性(P<0.05);与anti-miR-NC组(0.36±0.02)相比,anti-miR-199a组细胞OD值(0.64±0.03)升高(P<0.05);与高剂量药物组+miR-NC(0.72±0.03)相比,高剂量药物组+miR-199a组细胞 OD 值(0.42±0.02)降低(P<0.05)。
2.2 金丝桃苷对LPS诱导的HPAEpiC细胞周期的影响与对照组相比,模型组G0-G1期细胞所占比例升高,S期细胞所占比例降低(P<0.05);与模型组相比,低、中、高剂量药物组G0-G1期细胞所占比例降低,S期细胞所占比例升高,且呈剂量依赖性(P<0.05);与anti-miR-NC组相比,anti-miR-199a组G0-G1期细胞所占比例降低,S期细胞所占比例升高(P<0.05);与高剂量药物组+miR-NC相比,高剂量药物组+miR-199a组G0-G1期细胞所占比例升高,S期细胞所占比例降低(P<0.05);各组G2-M期细胞所占比例无明显变化(P>0.05)。见表1。
表1 金丝桃苷对HPAEpiC细胞周期的影响/±s

表1 金丝桃苷对HPAEpiC细胞周期的影响/±s
注:①与对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量药物组相比,P<0.05;④与中剂量药物组相比,P<0.05。⑤与antimiR-NC组相比,P<0.05。⑥与高剂量药物组+miR-NC相比,P<0.05。
组别对照组模型组低剂量药物组中剂量药物组重复次S G2-M 33.53±1.00 33.23±0.72 33.30±0.70 33.69±0.43 G0-G1 33.17±1.10 49.20±1.13①46.15±0.80②42.81±0.64②③38.41±0.54②③④49.21±1.19 40.79±0.63⑤33.30±1.27 17.57±0.44①20.55±0.68②23.50±0.47②③28.48±0.50②③④17.54±0.45 26.11±0.61⑤33.11±0.73 33.25±0.69 33.10±0.76 33.06±0.77 32.33±0.65 0.81 0.602高剂量药物组anti-miR-NC anti-miR-199a高剂量药物组+miR-NC高剂量药物组+miR-199a F值P值数 3 3 3 3 3 3 3 3 3 38.44±0.51 48.29±0.73⑤⑥135.49 0.000 28.50±0.52 19.38±0.42⑤⑥222.27 0.000
2.3 金丝桃苷对LPS诱导的HPAEpiC凋亡的影响与对照组(8.02±0.32)%相比,模型组细胞凋亡率(24.20±0.43)%升高(P<0.05);与模型组相比,低、中、高剂量药物组细胞凋亡率[(20.51±0.40)%、(17.67±0.37)%、(12.63±0.32)%]降低,且呈剂量依赖性(P<0.05);与anti-miR-NC组(24.26±0.35)%相比,anti-miR-199a组细胞凋亡率(14.36±0.29)%降低(P<0.05);与高剂量药物组+miR-NC(12.65±0.32)%相比,高剂量药物组+miR-199a组细胞凋亡率(22.09±0.34)%升高(P<0.05)。
2.4 各分组处理对LPS诱导的HPAEpiC炎症因子的影响与对照组相比,模型组TNF-α、IL-1β水平升高(P<0.05);与模型组相比,低、中、高剂量药物组TNF-α、IL-1β水平降低,且呈剂量依赖性(P<0.05);与anti-miR-NC组相比,anti-miR-199a组TNF-α、IL-1β水平降低(P<0.05);与高剂量药物组+miR-NC相比,高剂量药物组+miR-199a组TNF-α、IL-1β水平升高(P<0.05)。见表2。
表2 各分组处理HPAEpiC中炎症因子影响/(ng/L,±s

表2 各分组处理HPAEpiC中炎症因子影响/(ng/L,±s
注:TNF-α为肿瘤坏死因子-α,IL-1β为白细胞介素-1β。①与对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量药物组相比,P<0.05。④与中剂量药物组相比,P<0.05。⑤与antimiR-NC组相比,P<0.05。⑥与高剂量药物组+miR-NC相比,P<0.05。
IL-1β 101.70±3.77 474.90±6.54①377.49±4.47②329.49±2.30②③242.51±3.85②③④478.18±5.66 274.44±2.39⑤242.03±2.61 427.83±4.78⑤⑥2622.50 0.000组别对照组模型组低剂量药物组中剂量药物组高剂量药物组anti-miR-NC anti-miR-199a高剂量药物组+miR-NC高剂量药物组+miR-199a F值P值重复次数3 3 3 3 3 3 3 3 3 TNF-α 69.43±4.26 411.49±10.02①343.26±5.69②286.83±4.32②③171.55±5.76②③④413.17±7.13 222.58±3.25⑤172.36±4.96 381.13±3.41⑤⑥1348.53 0.000
2.5 各分组处理对LPS诱导的HPAEpiC中miR-199a的影响与对照组(0.96±0.07)相比,模型组miR-199a表达水平(2.63±0.13)升高(P<0.05);与模型组相比,低、中、高剂量药物组miR-199a表达水平降低[(2.06±0.09)、(1.63±0.08)、(1.28±0.08)],且呈剂量依赖性(P<0.05);与anti-miR-NC组(2.62±0.12)相比,anti-miR-199a组 miR-199a表达水平(1.19±0.08)降低(P<0.05);与高剂量药物组+miR-NC(1.30±0.09)相比,高剂量药物组+miR-199a组miR-199a表达水平(2.21±0.12)升高(P<0.05)。
2.6 各分组处理对LPS诱导的HPAEpiC中Cleaved-caspase3和pro-caspase3蛋白表达的影响与对照组相比,模型组Cleaved-caspase3表达水平升高,pro-caspase3表达水平降低(P<0.05);与模型组相比,低、中、高剂量药物组Cleaved-caspase3表达水平降低,pro-caspase3表达水平升高,且呈剂量依赖性(P<0.05);与anti-miR-NC组相比,anti-miR-199a组Cleaved-caspase3表达水平降低,pro-caspase3表达水平升高(P<0.05);与高剂量药物组+miR-NC相比,高剂量药物组+miR-199a组Cleavedcaspase3表达水平升高,pro-caspase3表达水平降低(P<0.05)。见图1,表3。

图1 Cleaved-caspase3和pro-caspase3蛋白的表达
表3 各分组处理HPAEpiC中半胱天冬蛋白酶3(Cleavedcaspase3)和半胱天冬蛋白酶3前体(pro-caspase3)蛋白表达/±s
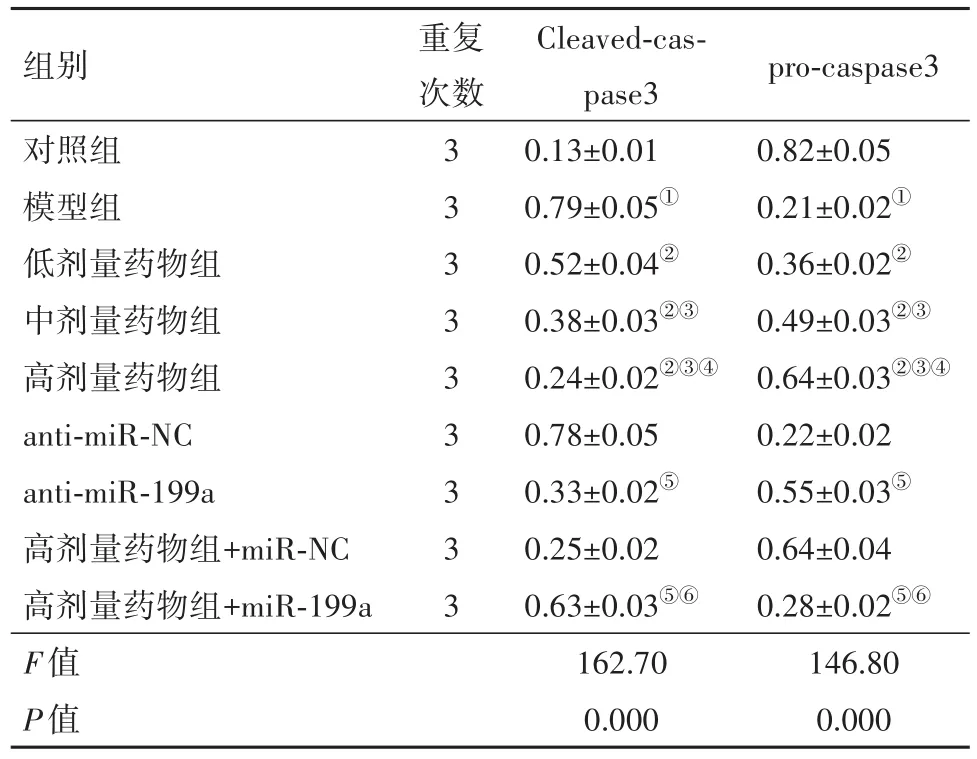
表3 各分组处理HPAEpiC中半胱天冬蛋白酶3(Cleavedcaspase3)和半胱天冬蛋白酶3前体(pro-caspase3)蛋白表达/±s
注:①与对照组相比,P<0.05。②与模型组相比,P<0.05。③与低剂量药物组相比,P<0.05;④与中剂量药物组相比,P<0.05。⑤与antimiR-NC组相比,P<0.05。⑥与高剂量药物组+miR-NC相比,P<0.05。
pro-caspase3 0.82±0.05 0.21±0.02①0.36±0.02②0.49±0.03②③0.64±0.03②③④0.22±0.02 0.55±0.03⑤0.64±0.04 0.28±0.02⑤⑥146.80 0.000组别对照组模型组低剂量药物组中剂量药物组高剂量药物组anti-miR-NC anti-miR-199a高剂量药物组+miR-NC高剂量药物组+miR-199a F值P值重复次数3 3 3 3 3 3 3 3 3 Cleaved-caspase3 0.13±0.01 0.79±0.05①0.52±0.04②0.38±0.03②③0.24±0.02②③④0.78±0.05 0.33±0.02⑤0.25±0.02 0.63±0.03⑤⑥162.70 0.000
3 讨论
急性肺损伤是临床重大呼吸系统疾病之一,其发病机制复杂,肺泡炎性细胞浸润是其重要病理改变;研究发现中医药可防治急性肺损伤,研究其发病机制可为急性肺损伤临床治疗及药物研发提供方向和参考[9-10]。研究报道金丝桃苷能够保护过氧化氢诱导的A549细胞氧化损伤[11]。金丝桃苷可保护肾脏免于衰老和损伤[12]。金丝桃苷可抑制LPS诱导的人脐静脉内皮细胞炎症和细胞凋亡[13]。金丝桃苷通过激活PPAR-γ可减轻急性肝损伤小鼠和LPS诱导的RAW264.7细胞中的炎症[14]。本实验结果显示,低中、高剂量金丝桃苷处理后,LPS诱导的HPAEpiC中细胞OD值升高,G0-G1期细胞所占比例降低,S期细胞所占比例升高,细胞凋亡率降低,TNF-α、IL-1β水平降低,Cleaved-caspase3表达水平降低,pro-caspase3表达水平升高,且呈剂量依赖性。表明金丝桃苷可剂量依赖地抑制LPS诱导的HPAEpiC凋亡和炎症反应。
微小RNA(microRNA,miRNA)是一种非编码RNA,miRNA可能参与其发病过程,为早期诊断和预后判断提供新的思路[15]。miR-199a是一种新型基因调节剂,在炎症和肺损伤中具有重要作用,研究报道LPS可以上调肺泡巨噬细胞中miR-199a的表达,miR-199a的下调可能通过抑制过度的炎症反应和抑制肺组织中细胞凋亡,减轻败血症诱导的急性肺损伤[16]。SNHG12过表达通过靶向miR-199a抑制了氧葡萄糖剥夺/复氧后脑微血管内皮细胞的凋亡和炎症反应[17]。本实验结果显示,LPS诱导的HPAEpiC中miR-199a高表达,抑制miR-199a表达可抑制LPS诱导的HPAEpiC细胞凋亡和炎症因子的释放。与前人研究结果相符。且本实验还发现低中、高剂量金丝桃苷处理后,LPS诱导的HPAEpiC中miR-199a表达水平降低,且miR-199a过表达逆转了金丝桃苷提取物对LPS诱导的HPAEpiC细胞凋亡和炎症因子的作用。
综上所述,金丝桃苷可能通过下调miR-199a抑制LPS诱导的HPAEpiC细胞凋亡和炎症反应。

