利拉鲁肽对膝骨关节炎大鼠炎症反应的影响
史纪元,武世勋,王涛,刘时璋,易智,傅蔷
骨关节炎(osteoarthritis,OA)是一种常见的关节疾病,已成为人类致残的主要原因之一[1-3]。炎症是骨关节炎的主要生理病理过程,并且软骨细胞和滑膜细胞过度生产许多可溶性炎症介质,例如细胞因子、趋化因子、生长因子、脂肪因子、前列腺素、白三烯调节剂等[4]。鉴于炎症在骨关节炎中的重要作用,新的抗炎疗法已经广泛开展,与炎症有关的分子是治疗骨关节炎的潜在靶标。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是肠内分泌L细胞产生的肠降血糖素激素,GLP-1通过胰高血糖素样肽-1受体(GLP-1R)结合和诱导来调节葡萄糖和能量稳态[5]。GLP-1不仅调节血糖水平,而且与炎症等各种病理生理过程密切相关。因此,利拉鲁肽等GLP-1R激动剂对炎症相关疾病的治疗具有较高的潜在价值。Chen等[6]提出用利拉鲁肽激活GLP-1R可通过减少炎症介质的释放和调节磷酸肌醇3-激酶(PI3K)/AKT信号转导保护软骨细胞免受内质网(ER)应激、细胞凋亡和炎症。因此,GLP-1R是骨关节炎的潜在治疗靶标,而利拉鲁肽可能具有较高的临床应用价值。GLP-1R激活腺苷酸环化酶(AC)以产生环状单磷酸腺苷(cAMP),进而激活蛋白激酶A(PKA)和cAMP反应元件结合蛋白(CREB),从而调节炎症相关基因的表达[7-8]。关节腔内注射单碘乙酸盐(MIA)会导致软骨样病变的关节软骨丧失,可用于制作啮齿类动物的骨关节炎模型[9]。本研究自2019年4―11月探讨GLP-1类似物利拉鲁肽对MIA诱导的膝骨关节炎大鼠模型炎症反应的改善作用,及其对膝关节软骨组织的影响。
1 材料与方法
1.1 材料
1.1.1 实验试剂 GLP-1类似物利拉鲁肽购自和诺德(中国)制药有限公司。用于诱导大鼠骨关节炎的单碘乙酸盐(MIA)购自美国Sigma-Aldrich公司。一抗兔抗 GLP-1R、PKA、磷酸化 PKA(Thr197)、CREB、磷酸化CREB(Ser 133)、聚集蛋白聚糖(aggrecan)、Ⅱ型胶原(collagen Ⅱ)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、基质金属蛋白酶-13(MMP-13)和含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶4(ADAMTS-4)从英国Abcam公司购买。正常兔抗IgG、兔抗甘油醛3-磷酸脱氢酶(GAPDH)和辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自美国Cell Signaling Technology公司。A/G琼脂糖蛋白珠购自美国Santa Cruz Biotechnology公司。苏木精-伊红(HE)染色试剂盒购自北京索莱宝科技有限公司。免疫组织化学试剂盒购自生工生物工程(上海)股份有限公司。
1.1.2 实验动物 60只成年雄性SD大鼠来自陕西省人民医院实验动物中心[SYXK(陕)2016-006],体质量为(233.23±14.82)g。将大鼠饲养在温度为25℃、相对湿度为55%、光暗周期为12 h的笼中。不限制大鼠饮食。本研究中对于大鼠的处理符合动物伦理学相关标准。
1.2 方法
1.2.1 膝骨关节炎模型的建立及给药 将60只大鼠平均分为模型组、假手术组和利拉鲁肽组,每组20只。在参考文献所述方法的基础上做适当修改用于建立膝骨关节炎大鼠模型[10-12]:使用50 mg/kg戊巴比妥钠腹膜内注射麻醉大鼠,在模型组和利拉鲁肽组中,将4 mg MIA溶解于40 μL无菌盐水中并通过大鼠左膝关节髌韧带内侧注入,共处理4周。假手术组大鼠关节腔内注射相同体积的生理盐水。利拉鲁肽组的大鼠在用MIA处理的基础上,皮下注射 50 μg·kg-1·d-1的利拉鲁肽进行治疗,共4周。模型组和假手术组大鼠注射相同体积的生理盐水。给药结束后,腹膜内注射50 mg/kg戊巴比妥钠并处死大鼠。收集大鼠左膝关节标本并分离滑膜组织和软骨标本。
1.2.2 免疫沉淀 收集并研磨大鼠软骨组织,然后在含有焦磷酸钠和蛋白酶抑制剂的裂解缓冲液中(美国Sigma-Aldrich公司)在冰上裂解30 min。将裂解物以10 000g离心15 min,并收集上清液。将含有等量蛋白质的上清液与2.5 mg GLP-1R或正常IgG抗体在4℃下孵育过夜。然后在4℃下使用蛋白A/G琼脂糖珠进行免疫沉淀4 h。然后洗涤珠子,并煮沸5 min使其变性。随后使用蛋白质印迹分析免疫沉淀物。
1.2.3 苏木精-伊红(HE)染色 大鼠给药完成后,分离膝关节组织,并制作4 μm厚石蜡切片,采用苏木精-伊红(HE)染色试剂盒根据说明书进行染色。
1.2.4 蛋白质印迹法(Western blotting)分析 使用包含焦磷酸钠和蛋白酶抑制剂的RIPA裂解缓冲液(放射免疫沉淀,北京欣华绿源科技有限公司)提取软骨组织的总蛋白。根据制造商的说明,使用二辛可宁酸(BCA)蛋白含量测定试剂盒(上海碧云天生物技术有限公司)对蛋白质浓度进行定量。使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分离蛋白及免疫沉淀物,然后将其转移到聚偏二氟乙烯(PVDF)膜上。将膜在封闭缓冲液中于室温孵育2 h,然后在Tris缓冲盐水和Tween 20(TBST)溶液中洗涤3次(每次5 min),然后与一抗在4℃孵育过夜。将一抗在封闭缓冲液中以1∶2 000的比例稀释。用TBST洗涤3次(每次5 min)后,将膜与HRP标记的山羊抗兔IgG(1∶2 000)抗体在37℃孵育1 h。然后将膜用TBST洗涤3次(每次5 min),并通过增强化学发光法(ECL,上海碧云天生物技术有限公司)进行显影。GAPDH作为内参。
1.2.5 免疫组织化学分析 使用免疫组织化学(IHC)染色评估各组的GLP-1R表达水平。将软骨组织制备4 μm厚石蜡切片,3%过氧化氢(H2O2)封闭10 min,5%牛血清白蛋白(BSA)封闭30 min,然后将切片脱蜡并复水。将切片与兔抗GLP-1R(1∶500)在4℃孵育过夜,并在37℃与山羊抗兔二抗孵育1 h。将切片在磷酸盐缓冲盐水(PBS)缓冲液中洗涤3次,然后在3,3-二氨基联苯胺(DAB)溶液中孵育3 min。苏木精用于复染细胞核。使用光学显微镜观察图像,并使用Image-Pro Plus 6.0软件进行分析,使用积分吸光度值表示GLP-1R的水平。
1.3 统计学方法使用SPSS 18.0软件用于数据分析。观测资料为计量资料,以±s描述,组间比较使用单因素方差分析(ANOVA)及两两比较Tukey检验。P<0.05表示差异有统计学意义。
2 结果
2.1 骨关节炎大鼠模型的建立建模后解剖大鼠膝关节,如图1所示,对照组大鼠关节正常。建模组大鼠关节明显肿大,软骨明显变黄,表面粗糙,表明建模成功。如图2所示,HE染色显示,假手术组大鼠关节组织未见明显病理改变。模型组大鼠关节软骨层存在明显的缺损,表层可见炎性细胞浸润,软骨下层血管增生明显并伴有大量结缔组织渗透。而利拉鲁肽组大鼠关节病变程度明显减轻。
2.2 利拉鲁肽对大鼠体质量的影响在用利拉鲁肽处理21 d和28 d后,利拉鲁肽组大鼠的体质量明显低于其他组[21 d:对照组(282.13±12.32)g、模型组(280.22±11.24)g、利拉鲁肽组(264.18±12.76)g;28 d :对照组(292.89±10.64)g、模型组(290.14±16.13)g、利拉鲁肽组(273.54±15.33)g;P<0.05],而模型组和假手术组大鼠体质量差异无统计学意义(P>0.05)。这说明利拉鲁肽给药可能导致机体体质量减轻。
2.3 利拉鲁肽对膝骨关节炎大鼠膝关节软骨组织GLP-1R表达的影响Western blotting检测(图3),与假手术组相比,模型组大鼠膝关节软骨组织中GLP-1R的表达水平明显下调[(1.12±0.11)比(0.34±0.04)],而利拉鲁肽组的GLP-1R蛋白相对表达量(0.87±0.07)明显高于模型组(P<0.05)。免疫组化结果(图4)与Western blotting一致,模型组大鼠的GLP-1R积分光密度明显低于假手术组[(548.54±36.54)比(1 042.87±69.43)],而利拉鲁肽组的GLP-1R积分光密度(834.21±53.27)明显高于模型组(P<0.05)。

图3 蛋白质印迹法(Western blotting)检测各组大鼠膝关节软骨组织中GLP-1R的表达
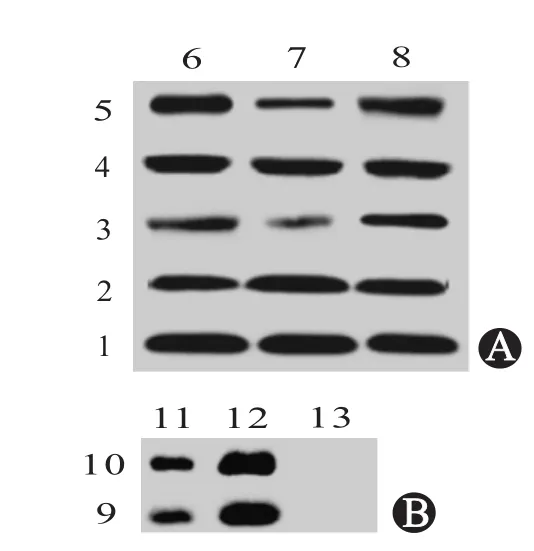
图5 蛋白质印迹法(Western blotting)检测各组大鼠膝关节软骨组织中PKA和CREB的磷酸化情况:A为PKA和CREB的磷酸化;B为免疫沉淀蛋白印迹
2.4 利拉鲁肽对膝骨关节炎大鼠膝关节软骨组织PKA/CREB信号通路的影响结果显示,与假手术组相比,模型组大鼠膝关节软骨组织中PKA和CREB的磷酸化情况均被显著抑制(P<0.05),然而利拉鲁肽处理可显著提高PKA和CREB的磷酸化水平(P<0.05)(图5A)。采用免疫沉淀检测蛋白质之间的相互作用,结果发现GLP-1R参与了PKA/CREB途径,表明PKA/CREB信号通路介导利拉鲁肽对膝骨关节炎的治疗作用(图5B)。

图6 蛋白质印迹法(Western blotting)检测各组大鼠膝关节软骨组织中aggrecan和collagen Ⅱ的表达
2.5 利拉鲁肽对膝骨关节炎大鼠膝关节软骨组织aggrecan和collagen Ⅱ表达的影响关节软骨主要由蛋白多糖(主要为aggrecan)和collagen Ⅱ组成,本研究结果显示,与假手术组[aggrecan):(1.21±0.07);collagen Ⅱ:(1.14±0.07)]相比,模型组大鼠膝关节软骨组织中的 aggrecan(0.41±0.03)和 collagen Ⅱ(0.37±0.02)蛋白水平显著降低(P<0.05)。与模型组相比,利拉鲁肽组的aggrecan(1.12±0.07)和collagen Ⅱ(1.02±0.06)蛋白水平均显著上调(P<0.05)。见图6。
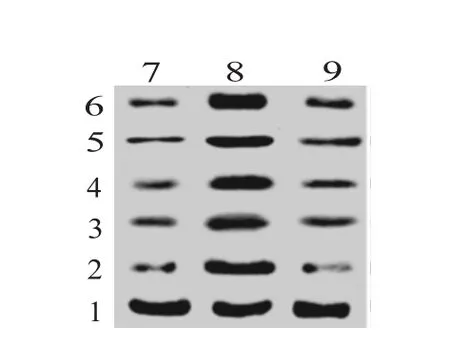
图7 蛋白质印迹法(Western blotting)检测各组大鼠膝关节软骨组织中TNF-α、IL-1β、IL-6、MMP-13和ADAMTS-4的表达
2.6 利拉鲁肽对膝骨关节炎大鼠膝关节软骨组织炎症反应的影响本研究使用Western blot来检测炎症相关蛋白 TNF-α、IL-1β、IL-6、MMP-13和 ADAMTS-4的表达。结果显示,与假手术组相比,模型组大鼠的的 TNF-α、IL-1β、IL-6、MMP-13和 ADAMTS-4蛋白表达水平均显著上调,而利拉鲁肽处理可显著抑制膝骨关节炎大鼠膝关节软骨组织中上述因子的上调(P<0.05)。见图7,表1。
表1 各组大鼠膝关节软骨组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、基质金属蛋白酶-13(MMP-13)和含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶4(ADAMTS-4)的表达水平/±s
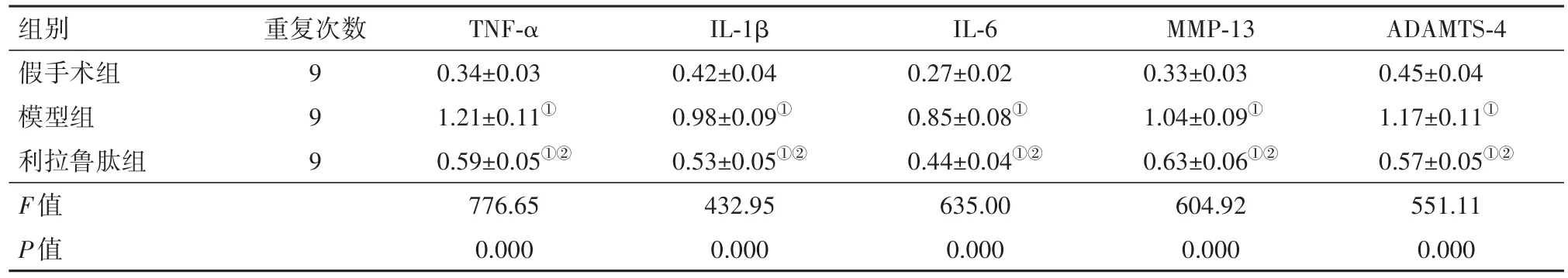
表1 各组大鼠膝关节软骨组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、基质金属蛋白酶-13(MMP-13)和含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶4(ADAMTS-4)的表达水平/±s
注:①与假手术组比较,P<0.05。②与模型组比较,P<0.05。
组别假手术组模型组利拉鲁肽组F值P值ADAMTS-4 0.45±0.04 1.17±0.11①0.57±0.05①②551.11 0.000重复次数9 9 9 TNF-α 0.34±0.03 1.21±0.11①0.59±0.05①②776.65 0.000 IL-1β 0.42±0.04 0.98±0.09①0.53±0.05①②432.95 0.000 IL-6 0.27±0.02 0.85±0.08①0.44±0.04①②635.00 0.000 MMP-13 0.33±0.03 1.04±0.09①0.63±0.06①②604.92 0.000
3 讨论
先前的研究表明,炎症在骨关节炎的发展中起着重要作用,而骨关节炎通常与低度滑膜炎密切相关[13]。此外,在类风湿关节炎患者血清、早期骨关节炎和终末期疾病滑膜中发现先天免疫应答中产生的细胞因子如TNFα、IL-6和IL-1β等均明显上调[14]。本研究也发现了膝骨关节炎大鼠模型的软骨组织中炎症相关蛋白TNF-α、IL-1β、IL-6、MMP-13和ADAMTS-4的上调。因此,在骨关节炎早期阻断炎症途径可能在一定程度上延缓或抑制疾病的进展,这为开发抗关节炎药物提供了基础。例如,Ran等人研究发现复方五味子素B可抑制核因子-κB(NF-κB)和促分裂原活化蛋白激酶(MAPK)信号通路从而成为治疗骨关节炎的潜在治疗剂[15]。
炎症是由许多上游和下游分子介导的。多项研究均证实GLP-1/GLP-1R可发挥较好的抗炎功能,它们已被用作炎症相关疾病的治疗靶标。GLP-1是一种肠降血糖素激素,由L细胞产生,通过与GLP-1R结合来调节葡萄糖和能量稳态[5]。GLP-1R是一种G蛋白偶联受体,广泛分布在星形细胞、神经元和内皮细胞中[5]。Chen等人发现GLP-1R也在软骨细胞中表达,并且与软骨的变性有关。此外,还发现在骨关节炎大鼠模型中GLP-1R的表达明显降低[16]。本研究发现,与对照组相比,单碘乙酸酯给药诱导的膝骨关节炎大鼠的膝关节软骨组织中GLP-1R的表达较低,这说明GLP-1R在骨关节炎发育中具有潜在作用和关键作用。
前人研究显示,PKA/CREB信号通路和相关的活性成分可能是介导GLP-1/GLP-1R信号抗炎作用的主要信号分子[6]。在膝骨关节炎大鼠膝关节的软骨组织中,炎症相关蛋白的上调伴随着GLP-1R和PKA/CREB通路的下调。其他研究报道,GLP-1受体激动剂Exendin-4可激活PKA[17]。本研究在膝骨关节炎大鼠模型中使用了GLP-1的类似物利拉鲁肽来上调GLP-1R信号,发现利拉鲁肽可以通过上调GLP-1R来激活PKA/CREB途径并抑制炎症。据报道,CREB与组蛋白乙酰转移酶(HATs)家族的成员CREB的结合蛋白(CBP)结合,并催化组蛋白乙酰化,从而将染色质从闭合状态转换为开放状态,这种变化促进了RNA聚合酶Ⅱ和基础转录因子与开放DNA的结合并启动抗炎细胞因子如IL-10和双重特异性磷酸酶 1(DUSP1)的转录[18]。这些数据表明,CREB信号的激活在抗炎反应中起着重要作用,其中GLP-1R参与了这一过程。
关节软骨是一种胶原纤维构成的软骨,在关节活动中起到重要作用,包括减少骨摩擦、润滑作用、缓冲震动、增加关节灵活性等。关节软骨细胞外基质主要由蛋白多糖aggrecan和collagen Ⅱ等大分子组成,aggrecan和collagen Ⅱ的降解可直接引起关节软骨组织破坏[19]。本研究结果发现模型组大鼠膝关节软骨组织中的aggrecan和collagen Ⅱ蛋白水平显著降低,而利拉鲁肽处理的软骨组织中两种蛋白的表达均显著上调。说明利拉鲁肽对关节软骨组织具有保护作用。多项研究证实,IL-1β可在体外诱导骨关节炎[20]。还有研究发现,IL-1β可诱导软骨细胞中aggrecan和collagen Ⅱ的下调[21]。MMP-13参与骨关节炎软骨退变,其对collagen Ⅱ具有强大的水解作用[22]。ADAMTS-4是与关节疾病相关的ADAMTS家族聚集蛋白聚糖酶[23]。敲除ADAMTS-4会减弱由炎症介质引起的软骨细胞中aggrecan的降解,从而发挥骨关节保护作用[24-25]。基于上述结果,本研究证实利拉鲁肽通过抑制膝骨关节炎大鼠膝关节软骨组织中炎症相关因子的上调来发挥软骨组织保护作用。
总之,本研究发现在单碘乙酸诱导的膝骨关节炎大鼠模型中,GLP-1R蛋白水平显著降低,同时伴随着PKA/CREB通路的下调、关节软骨组分aggrecan和collagen Ⅱ的下调以及炎症相关蛋白TNF-α、IL-1β、IL-6、MMP-13和ADAMTS-4的上调。本研究还发现GLP-1R与PKA/CREB信号通路存在相互作用,利拉鲁肽可以激活PKA/CREB信号、上调关节软骨组分的表达并抑制炎症相关蛋白的表达。这些数据共同表明,利拉鲁肽在骨关节炎大鼠模型中具有较好的治疗作用。此外,本研究还发现利拉鲁肽在治疗期间可能引起体质量减轻,先前的研究也表明利拉鲁肽给药可导致机体体质量减轻[26],这可能与其在体质量调节中的机制密切相关。然而,这种体质量减轻是否对骨关节炎大鼠有不良影响还有待进一步研究。
(本文图1,2,4见插图2-1)

