藜麦CqSAP8基因克隆及其在非生物胁迫下的表达分析
陈 阳,郭占斌,武 悦,张 春,韩凤霞,单飞彪
(1 巴彦淖尔市农牧业科学研究所, 内蒙古临河 015000;2 内蒙古益稷生物科技有限公司,呼和浩特 010050;3 巴彦淖尔市现代农牧事业发展中心, 内蒙古临河 015000)
胁迫相关蛋白(stress associated protein, SAP)是一类具有A20/AN1结构特征的锌指蛋白,广泛存在于真核生物中。植物SAP是一个多基因家族,不同物种SAP家族基因数目不等。拟南芥、水稻[1]、番茄[2]、棉花[3]、苹果[4]和黄瓜[5]等物种中分别鉴定出14、18、13、37、30和12个SAP家族基因。2004年水稻OsiSAP1是植物中首个被报道的SAP家族基因,该基因受干旱、低温、高盐等非生物胁迫诱导表达,且正向调控转基因植物的抗性[6]。近年来,随着不同物种中SAP家族基因陆续被克隆和功能分析,其机理主要包括3个角色,即泛素连接酶[7]、氧化还原感受器[8-9]和基因表达调控因子[10]。
植物SAP具有多种生物功能,主要参与非生物胁迫的响应。多种非生物胁迫可以快速诱导植物SAP基因的表达,例如拟南芥AtSAP9在NaCl胁迫和甘露醇模拟的渗透胁迫处理1 h的表达量均显著增加,且分别在1 h和3 h达到最大值[11]。香蕉MaSAP1在NaCl和冷处理6 h的表达量增加到最大值,在PEG-6000干旱胁迫12 h表达量达到最高值[12]。大豆基因组中共鉴定出27个SAP基因,其中13个SAP基因在干旱处理1 h表达量显著上调,14个SAP基因在盐胁迫2 h的表达量增加显著[13]。SAP基因的过表达可以显著提高受体的非生物胁迫抗性。MusaSAP1[14]、香雪球LmSAP[9]、苹果MdSAP15[4]、杨树PtSAP13[15]等基因可以提高转基因植株的抗性,包括干旱、高盐、重金属等非生物胁迫。另外,SAP家族基因还参与植物的生长发育。Wang等[16]发现青蒿AaSAP1可以正向调控腺毛的发育,从而有效提高青蒿素的产量。小麦TaSAP7-B启动子包含一个dCAPS标记SNP-260,该标记与小麦植株重量、花序梗长度、倒数第二节间长度、株穗数和千粒重等农艺性状显著关联,为以后分子标记辅助选择小麦优良品种奠定基础[17]。
藜麦营养丰富且全面,含有多酚、皂苷、黄酮等特殊化学成分,近年来作为一种新兴的保健型食品越来越受到消费者的青睐[18]。藜麦具有较高的非生物胁迫抗性,适应性强,在中国多个省份均有种植[19-20]。近年来,关于藜麦的研究主要集中在表型和生理生化方面[21-22]。随着藜麦高质量基因组数据的公布,藜麦功能基因组学和生物信息学的研究得到极大促进。迄今为止,尚未有藜麦SAP家族基因克隆和胁迫应答方面的报道。本研究从藜麦中克隆胁迫相关蛋白基因CqSAP8,分析其编码的蛋白质序列和结构特征,通过序列比对和构建进化树分析CqSAP8的亲缘关系,利用qRT-PCR技术分析该基因的组织特异性以及在干旱、盐胁迫下的表达模式,为进一步研究CqSAP8基因功能和信号传导途径奠定基础。
1 材料和方法
1.1 试验材料
实验材料为藜麦19M2,由内蒙古益稷生物科技有限公司提供。参照时丕彪等[23]的方法对藜麦进行水培种植,六叶期对幼苗分别进行20% PEG-6000、200 mmol/L NaCl、42 ℃高温、4 ℃低温和100 μmol/L ABA处理,分别在处理0、1、3、6、12和24 h剪取叶片,迅速置于液氮冷冻,-80 ℃冰箱保存。
1.2 试验方法
1.2.1 藜麦RNA的提取和反转录利用RNA提取试剂盒TaKaRa MiniBEST Plant RNA Extraction Kit提取藜麦总RNA,利用TaKaRa PrimeScriptTM 1st Strand cDNA Synthesis Kit试剂盒合成cDNA第一链。
1.2.2 藜麦CqSAP8的克隆根据GenBank上公布的藜麦基因CqSAP8(登录号XM_021916348)序列信息,利用Primer Premier 5.0设计特异性扩增引物(表1),以干旱胁迫处理0 h样品cDNA为模板进行PCR扩增,退火温度为58 ℃。PCR产物经1%琼脂糖凝胶电泳检测,构建到pEASY-Blunt Cloning Vector载体上并转化到大肠杆菌中,挑取阳性克隆送生工生物工程(上海)股份有限公司测序。

表1 引物信息
1.2.3 生物信息学分析利用在线软件ProtParam tool(https://web.expasy. org/protparam/)分析CqSAP8蛋白的理化性质,利用ProtScale(https://web. expasy.org/protscale/)分析CqSAP8蛋白质的亲/疏水性;分别用NCBI CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)网站分析CqSAP8蛋白的保守结构域和二级结构;利用DNAMAN软件进行多序列比对;利用MEGA 软件采用邻接法构建系统进化树。
1.2.4 藜麦CqSAP8基因表达分析根据藜麦CqSAP8基因序列设计荧光定量PCR特异性引物(表1),以EF1α为内参基因,使用Roche Lightcycler 96进行荧光定量PCR分析。反应体系20 μL(参照TaKaRa TB Green Fast qPCR Mix试剂盒),反应程序:95 ℃预变性3 min,95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸15 s,40个循环。设置3个生物学重复,采用2-ΔΔCT法计算藜麦CqSAP8基因的相对表达量。
2 结果与分析
2.1 CqSAP8基因的克隆
以藜麦幼苗叶片cDNA为模板,利用特异性引物进行PCR扩增,获得781 bp的扩增条带(图1)。回收扩增条带并连接到pEASY-Blunt载体上,转化到大肠杆菌中提取质粒进行测序。测序结果表明CqSAP8基因CDS全长528 bp,编码175个氨基酸。

M. DL2000;1. CqSAP8图1 CqSAP8的PCR扩增Fig.1 PCR amplification of CqSAP8
2.2 CqSAP8蛋白序列与理化性质分析
Expasy分析表明CqSAP8蛋白分子式为C802H1299N229O258S14,相对分子质量为18.73 kD,理论等电点为7.46。CqSAP8蛋白由19种氨基酸构成(图2),其中赖氨酸数目最多,共计16个(9.1%),其次是丙氨酸和缬氨酸,分别为15个(8.6%)和14个(8.0%),组氨酸、蛋氨酸和酪氨酸数目最少,均为3个(1.7%)。CqSAP8蛋白质的不稳定系数为38.14。利用ProtScale分析CqSAP8蛋白质的亲/疏水性(图3),最大值和最小值分别位于第75位的苏氨酸(+1.700)和第143位的丝氨酸(-2.733),亲水性平均系数为-0.357。以上结果说明CqSAP8属于稳定的亲水性蛋白质。

图2 CqSAP8基因的ORF序列及其编码的氨基酸序列Fig.2 The ORF sequence and the deduced amino acid sequence of CqSAP8 gene

图3 CqSAP8亲疏水性分析Fig.3 Hydrophobicity analysis of CqSAP8
2.3 CqSAP8蛋白结构分析
通过NCBI网站上的CD Search搜索CqSAP8的保守域(图4,A),发现位于N端第16至39位的zf-A20保守域和C端第116至153位的ZnF_AN1保守域,说明CqSAP8属于典型的SAP家族成员。利用SOPMA预测CqSAP8蛋白的二级结构(图4,B),结果显示CqSAP8蛋白包含4种结构,即由56个氨基酸残基构成的α螺旋、5个氨基酸残基构成的β转角、16个氨基酸残基构成的延伸链和98个氨基酸残基构成的无规则卷曲。
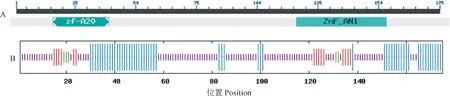
A.CqSAP8蛋白的保守域分析; B. CqSAP8蛋白质的二级结构:蓝色.α螺旋;红色.延伸链;紫色.无规则卷曲;绿色.β转角图4 CqSAP8蛋白的结构分析A. Analysis of CqSAP8 conserved domain; B. Secondary structure of CqSAP8 protein: Blue. Alpha helix; Red. Extended strand; Purple. Random coil; Green. Beta turnFig.4 The structure analysis of CqSAP8 protein
2.4 CqSAP8蛋白的同源比对及系统进化分析
在NCBI数据库通过同源比对获得水稻OsSAP8(Oryzasativa,XP_015643189.1)、苜蓿MtSAP8(Medicagotruncatula,XP_024632562.1)、烟草NtSAP8(Nicotianatabacum, XP_016464057.1)等SAP8蛋白的氨基酸序列,发现不同物种SAP8蛋白均含有保守的zf-A20和ZnF_AN1结构域(图5)。序列比对发现,藜麦CqSAP8与甜菜BvSAP8、菠菜SoSAP8序列一致性最高,分别达到了89.66%和89.47%,与谷子SiSAP8序列一致性最低(60.23%)。系统进化树分析表明(图6),不同物种SAP8蛋白根据双子叶植物和单子叶植物聚类分为2组,其中藜麦CqSAP8与同属藜科的菠菜SoSAP8、甜菜BvSAP8分布在同一分支,亲缘关系较近。

*和▽分别代表zf-A20和ZnF_AN1结构域的保守氨基酸图5 藜麦CqSAP8与其他物种SAP8蛋白质的氨基酸序列比对分析* and ▽ represent the conserved amino acid of zf-A20 and ZnF_AN1, respectivelyFig.5 Amino acid sequence alignment of Chenopodium quinoa CqSAP8 with SAP8 proteins from other species

图6 CqSAP8与其他植物SAP家族成员的进化树分析Fig.6 Phylogenetic tree analysis between CqSAP8 and SAP family members of other plants
2.5 CqSAP8基因的组织特异性表达分析
qRT-PCR分析表明(图7),藜麦CqSAP8基因在根、茎、叶、花和种子中均有表达,但存在显著的组织特异性,在种子中表达量最高,显著高于其他组织,其次是叶、花和根,在茎中表达量最低。
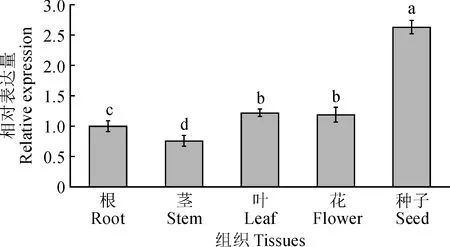
不同字母表示差异显著(P<0.05)图7 CqSAP8的组织表达特性分析Different letters indicate significant differences (P<0.05)Fig.7 The expression characteristics of CqSAP8 in tissues
2.6 CqSAP8基因在不同非生物胁迫下的表达特性
qRT-PCR结果显示(图8),PEG胁迫处理1 h后,藜麦CqSAP8基因的表达量开始显著增加,12 h达到最大值,为对照的13.09倍,24 h表达量略微下降,但不显著。CqSAP8基因受盐胁迫诱导上调表达,在处理3 h达到一个小高峰,随后表达量有所降低,在12 h达到最大值,是未处理时的3.5倍。高温和低温处理均能诱导CqSAP8不同程度地上调表达,分别在12和6 h达到最大峰值,分别为对照的17.47和3.91倍。以上结果表明,CqSAP8基因响应多种非生物胁迫应答。另外,为了解CqSAP8基因对多种非生物胁迫的响应是否依赖于ABA,采用100 mmol/L ABA对藜麦幼苗进行处理, 3 h内CqSAP8表达量增加不显著,6和12 h的表达量分别是对照的5.10和6.22倍,24 h的表达量急剧升高,达到对照的53.62倍。

不同小写字母表示同一胁迫不同时间差异显著(P<0.05)图8 CqSAP8在不同非生物胁迫下的相对表达Different letters indicate significant differences with same stress under different stress time (P<0.05)Fig.8 Relative expression of CqSAP8 under different abiotic stresses
3 讨 论
SAP是锌指蛋白家族中的一类蛋白,其特点是具有A20结构域和(或)AN1结构域,A20锌指结构域含有CX2-4CX11CX2C保守序列[24],AN1锌指结构域包含CX2CX9-12CX1-2CX4CX2HX5HXC和CX4CX9-12CX1-2CX4CX2HX5HXC两种类型的保守序列[25]。大多数SAP蛋白同时具有A20结构域和AN1结构域。本研究从藜麦克隆CqSAP8基因,其编码蛋白含有1个位于N段的A20保守域和1个位于C段的AN1保守域,属于典型的SAP蛋白组合类型。CqSAP8蛋白的AN1结构域的保守序列属于CX2CX9-12CX1-2CX4CX2HX5HXC类型,与AtSAP5的AN1结构域类型一致。Kang等[7]发现AtSAP5具有泛素连接酶活性,而且其活性依赖C端的AN1结构域。CqSAP8是否具有泛素连接酶活性,以及其活性是否依赖AN1结构域,有待于进一步验证,为后续研究CqSAP8功能提供方向。
CqSAP8基因碱基数目较少,全长528 bp,编码175个氨基酸,无内含子。不同植物中SAP家族成员不含内含子或内含子数目较少。例如苹果基因组中含有30个SAP基因,其中25个无内含子,5个含有1个内含子[4]。Zhang等[13]鉴定出27个大豆SAP基因,不含内含子和含有一个内含子的基因数目分别为18个和9个。研究表明,无内含子或内含子少的基因在转录过程中可以减少RNA修饰,从而快速表达[26-27]。在PEG和NaCl胁迫下,藜麦CqSAP8基因均在1 h的表达增加量达到极显著。以上结果说明藜麦CqSAP8由于基因片段小,且不含内含子,基因的表达快速响应干旱和盐胁迫。
已有研究表明,植物SAP是一类参与非生物胁迫应答和调控的锌指蛋白,属于植物逆境信号传导途径中的上游调控因子,通过正向或负向调控下游功能基因的表达,影响植物的抗逆性[28]。拟南芥AtSAP5的表达量在高盐、干旱和冻害等胁迫下不同程度地上调表达,35S∷AtSAP5转基因株系中干旱胁迫响应相关基因的表达量增加,抗旱性提高[7]。本研究发现CqSAP8基因受干旱、高盐、高温和低温胁迫诱导上调表达(P<0.05),说明CqSAP8基因参与多种非生物胁迫的响应。CqSAP8基因均在干旱和高温胁迫的12 h表达量达到最大值,分别是对照的13.09和17.47倍,而高盐和低温胁迫下的最大表达量均为对照的3.91倍,推测CqSAP8基因在调控藜麦干旱和高温胁迫方面发挥更重要的作用。CqSAP8在ABA胁迫下3 h内的表达量增加不显著,24 h急剧升高,说明CqSAP8在非生物胁迫前期的响应不依赖ABA。藜麦CqSAP8基因在非生物胁迫下的调控机理及功能仍需要深入研究,后续通过转基因和基因编辑手段分析下游调控基因网络,观察植株在非生物胁迫下的抗性表现,从而揭示藜麦CqSAP8基因的作用机理。

