不同灌水处理下滨海盐碱地土壤-玉米阳离子变化规律及相关关系研究
王航,周青云,张宝忠,尹林萍
不同灌水处理下滨海盐碱地土壤-玉米阳离子变化规律及相关关系研究
王航1,3,周青云1,2,3*,张宝忠2,尹林萍1,2,3
(1.天津农学院 水利工程学院,天津 300392;2.中国水利水电科学研究院 流域水循环模拟与调控国家重点实验室,北京 100083;3.中美生态农业与水环境保护国际联合研究中心,天津 300392)
【】探讨不同灌水处理下滨海盐碱地土壤-玉米系统阳离子变化规律及相关关系。采用田间试验研究了滨海盐碱地不同滴灌方式对根系层土壤K+、Ca2+、Na+和作物体内K+/Na+的影响,共设计4个处理,每个处理3次重复,分别为灌水定额10 mm常规滴灌处理(LI10)、灌水定额20 mm常规滴灌处理(LI20)、灌水定额10 mm膜下滴灌处理(FI10)、灌水定额20 mm膜下滴灌处理(FI20)。分别建立作物K+/Na+、Ca2+和根系层土壤K+、Ca2+、Na+的回归模型。灌水后膜下滴灌处理土壤Na+相对量降幅远大于常规滴灌处理;膜下滴灌较大灌水量处理全生育期茎中K+/Na+均较大,生育前期膜下滴灌处理叶片K+/Na+均较大;常规滴灌处理相对膜下滴灌处理根系层土壤K+/Na+和Ca2+质量分数均对根系K+/Na+的影响较大;常规滴灌和膜下滴灌处理根系层土壤Ca2+的增大通过抑制根系层土壤K+/Na+的增大从而抑制根系K+/Na+的增大。在滨海盐碱地使用滴灌技术可以有效改善土壤和玉米体内阳离子分布,其中膜下滴灌相比常规滴灌技术更有利于提高玉米抗盐碱性。
滨海盐碱地;滴灌方式;土壤阳离子;玉米阳离子;回归模型
0 引 言
【研究意义】盐分是威胁世界各地农业生产力的重要非生物环境胁迫因素。渗透期(早期/短期响应)和离子阶段(后期/长期响应),在细胞、器官和整个植物水平都观察到盐分胁迫的有害影响[1]。滨海地区农田土壤长期遭受海水和高矿化度地下水的影响,土壤盐碱化严重[2],已经成为制约地区农业可持续发展的主要因素。
【研究进展】Na+是盐碱化土壤的主要危害离子之一,根系层土壤Na+质量分数的增加会降低许多植物对土壤Ca2+、K+和Mg2+的吸收,并影响植物K+/Na+的比例[3]。研究表明[4-6],植物体内较高的K+/Na+显著提高作物的耐盐性,提高作物产量。阳离子被土壤交换复合物吸附的强度遵循Ca2+>K+>Na+,在湿润时期,二价阳离子更可能被固定在地表层中,钠盐非常易溶,并且在土壤剖面中更具流动性,钠盐质量分数的变化会影响其他盐的溶解度,从而导致土壤剖面阳离子组成发生变化[7]。Ca2+易与土壤胶体结合,灌水对Ca2+的淋洗程度远小于对K+和Na+的淋洗程度,根系层土壤中残留较多的Ca2+影响了作物对K+和Na+的吸收[8-9],从而影响作物体内的K+/Na+。
植物中的Na+毒性是多方面的,包括渗透胁迫[10],对3',5'-双磷酸核苷酸酶、H+-ATPase酶、淀粉合成酶等重要酶的抑制[11-13]以及与K+的竞争,Na+可以在一定程度上替代K+,比如Na+可以替代液泡中K+的渗透功能[14]。在大多数陆生植物中,K+是必需的无机元素,而K+的绝大部分作用无法被Na+替代[15]。K+在植物对生物(疾病和害虫)和非生物胁迫(如干旱、盐分、寒冷和涝渍)的响应中起着重要作用[16]。
【切入点】灌水后土壤中大量的K+和Na+以游离态的形式存在,Na+由于其水化半径较大[9],与K+相比更容易随水分迁移,不同灌水方式下K+、Ca2+和Na+在土壤剖面的分布各不相同,土壤盐分离子组成的差异对作物体内盐分离子的分布产生重要影响,盐碱地中的这种差异对作物的耐盐性提出了更高的要求。根系层土壤中K+、Ca2+和Na+的量对作物体内K+、Ca2+和Na+的相对量产生重要影响[17-18],然而很少有学者对其进行定量研究,【拟解决的关键问题】本文通过研究滨海盐碱地不同灌水处理下根系层土壤和作物体内K+、Ca2+和Na+之间的关系,建立数学关系,以期为滨海盐碱地的治理提供一定的理论依据。
1 材料与方法
1.1 研究区概况
田间试验于玉米生育期(2018年5—8月)进行,试验基地位于天津市津南区葛沽镇(N38°98′,E117°38′),该区地处华北平原东北部,海河流域下游,属海积与河流冲积形成的平原区,为典型盐碱化地区。年均降水量556.4 mm,多集中在6—8月,年均蒸发量为1 809.6 mm;年均日照时间2 659.0 h,年均无霜期206 d,地下水埋深1 m,矿化度为5 g/L,1 m土层土质多为黏壤土。
1.2 试验设计
试验包括4个灌水处理,分别为灌水定额10 mm常规滴灌处理(LI10)、灌水定额20 mm常规滴灌处理(LI20)、灌水定额10 mm膜下滴灌处理(FI10)、灌水定额20 mm膜下滴灌处理(FI20),每个处理设置3个重复,每个小区面积为8.3 m×9.3 m;玉米全生育期灌水量及灌溉定额如表1所示,春玉米(郑丹958)的种植模式如图1所示,行距为60 cm,株距为30 cm,滴灌带间距为60 cm,滴头间距为30 cm;灌溉方式为常规滴灌和膜下滴灌,覆膜方式为1膜2管2行半覆膜,膜宽为80 cm,滴头布置在玉米茎秆处,滴头流量为1.38 L/h。各处理在玉米1/2行距处取样,取土深度为0~20 cm和20~40 cm,取0~20 cm和20~40 cm土样离子量平均值作为根系层土壤离子量;每隔15 d左右取样,遇到灌水则加测,在灌水后1~2 d进行取样。玉米全生育期内日均气温及参考作物蒸散量如图2所示,阳离子成分本底值及土壤性质如表2所示,灌溉水为淡水,其矿化度小于1 g/L。
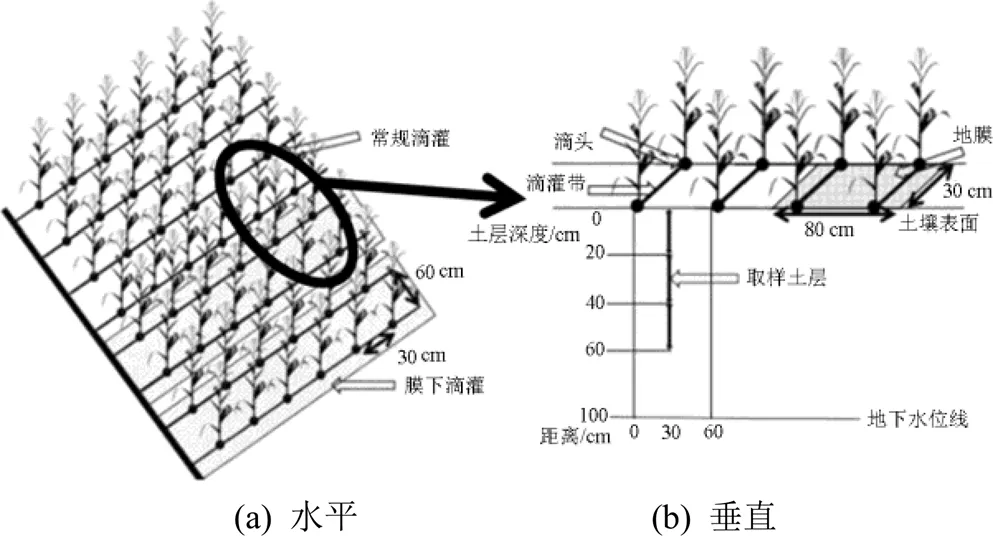
图1 田间试验平面布置
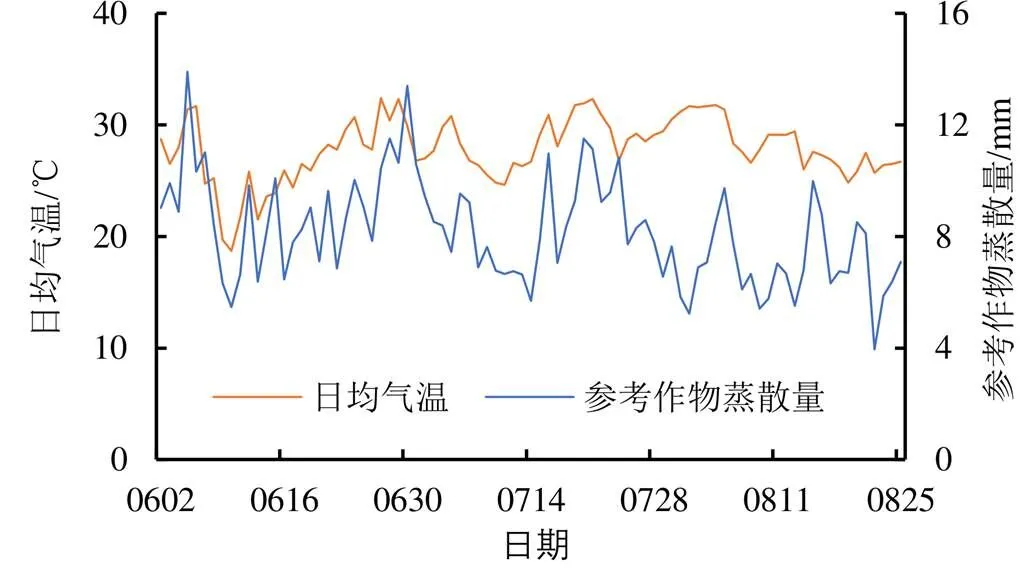
图2 玉米全生育期内日均气温及参考作物蒸散量
1.3 土壤及玉米阳离子测定方法
在实验室将土样自然风干后过1 mm土壤筛,配制成水土比为5∶1的土壤浸提液;玉米植株取样时间与土壤取样时间一致,每个处理取6株长势均匀、具有代表性的玉米植株,样品处理干净后,置烘箱105 ℃杀青30 min后80 ℃烘干至恒质量,将干物质用研磨机研磨后过50目筛,保存于密封袋内。玉米阳离子待测液采用硝酸-高氯酸消解的方法制备。准确称取样品粉末0.5 g,置于250 mL锥形瓶中,加入8 mL硝酸-高氯酸(3∶1)混合液,摇匀,静置6 h,然后放置在电热板上加热消解,保持微沸,持续加热至消解液呈无色透明,冷却后加入去离子水配制的0.5 %稀硝酸5 mL,转入25 mL容量瓶中,用去离子水洗涤锥形瓶,洗液合并于容量瓶中,定容至容量瓶刻度,作为供试品溶液。用火焰分光光度计(FP 640)测定土壤和玉米水溶性Na+、K+质量分数,用EDTA络合滴定法测定土壤和玉米水溶性Ca2+、Mg2+质量分数。
1.4 数据处理
钠吸附比()计算式为:

采用Microsoft Excel 2019软件对数据进行整理;运用IBM SPSS Statistics 24统计软件进行相关性分析;相关图表制作采用Microsoft Excel 2019软件完成。
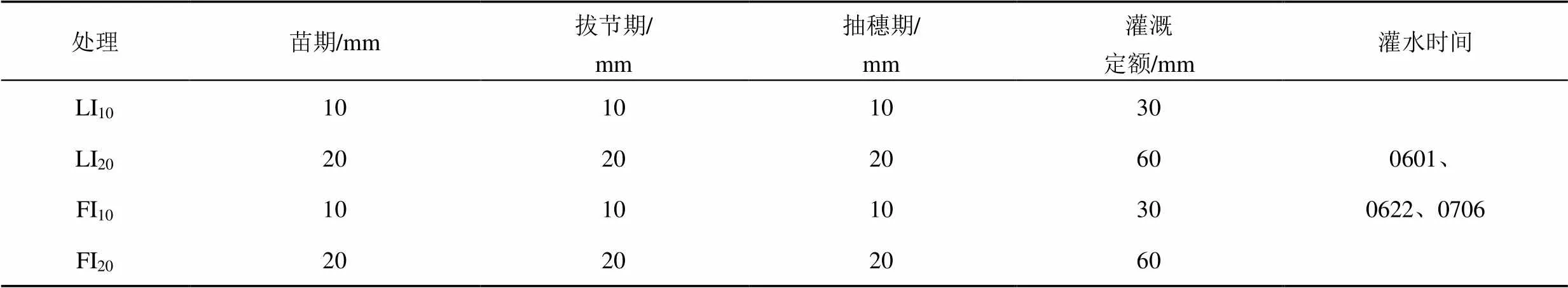
表1 玉米全生育期灌水量和灌水时间
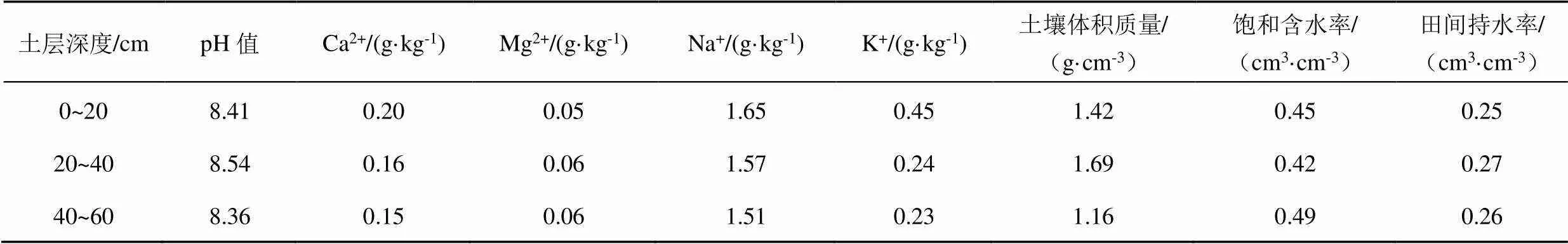
表2 阳离子成分本底值及土壤性质
2 结果与分析
2.1 土壤阳离子量及SAR随生育期的变化规律
不同处理土壤阳离子量及随生育期的变化规律如图3所示。因Mg2+平均量为0.06 g/kg,不到土壤阳离子总量的3%,对土壤性质影响可忽略不计,故未分析土壤Mg2+量随生育期变化规律。图3表明,各处理全生育期均表现出土壤Na+质量分数最大,其次为K+和Ca2+,全生育期根系层土壤变化趋势和土壤Na+变化趋势一致,生育期结束后各处理根系层土壤均显著降低,其中FI20处理降幅最大,达到73.8%,LI10处理降幅最小,仅为40.4%。6月22日和7月6日灌水后各处理土壤K+质量分数均不同程度减小,LI10处理土壤Na+质量分数减小,较大的降水量进一步促进了Na+质量分数的减小,其余处理土壤Na+质量分数则均不同程度增大,导致各处理均不同程度增大,其中FI10处理和FI20处理增幅较大,由于降水的淋洗,LI10处理和LI20处理增幅不明显。生育前期到生育中期,各处理土壤K+表现出先减小后增大的趋势,土壤Ca2+均表现出先增大后减小的趋势,第1次灌水后LI10处理和FI10处理土壤Ca2+质量分数增幅较大;第1次灌水后有23 mm降水,LI20处理土壤Na+、和Ca2+质量分数均显著减小,LI10处理土壤Na+质量分数和则在下个日期才减小,原因可能为第1次灌水之前的降水显著降低了LI10处理的土壤Na+质量分数和,导致第1次灌水后LI10处理土壤Na+质量分数和下降产生一定的滞后性。降水显著降低了LI10处理和LI20处理根系层土壤Na+、、K+和Ca2+质量分数,其中生育中期的降水显著降低LI10处理土壤Na+、、K+和Ca2+质量分数,生育后期的降水则显著降低LI20处理土壤Na+、、K+和Ca2+质量分数。土壤各离子质量分数变化不能充分反映不同灌水方式对土壤中离子组成的影响,有必要对土壤中离子的相对量进一步分析,以探究不同灌水方式对土壤性质的影响。
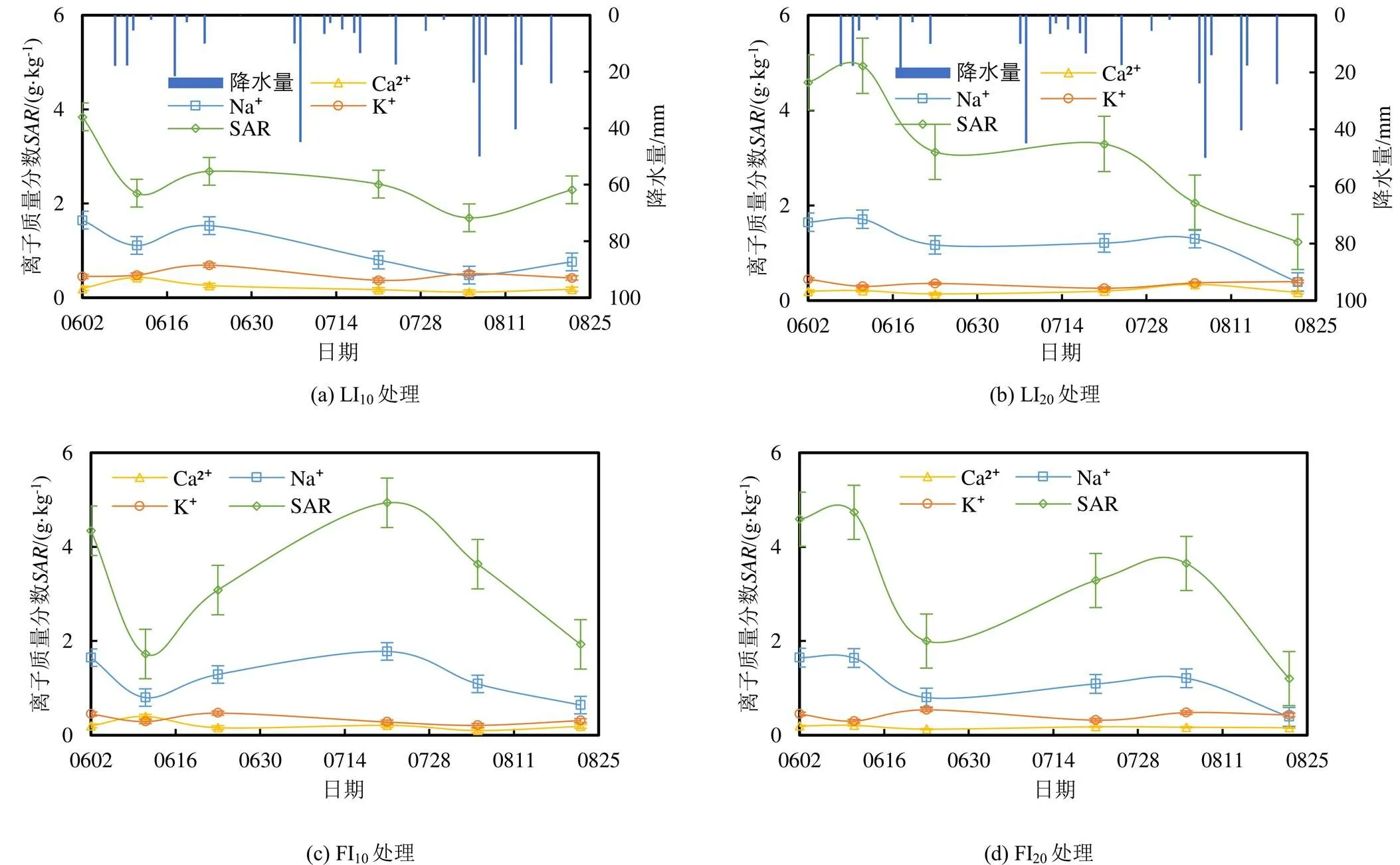
图3 不同处理土壤阳离子量及SAR随生育期的变化规律
2.2 土壤离子相对量随生育期的变化规律
分别计算K+、Na+和Ca2+量占阳离子总量的百分比获得不同阳离子的相对量,根系层土壤各个阳离子的相对量反映了土壤中阳离子的组成情况,对土壤性质产生重要影响。土壤中K+、Na+和Ca2+量占土壤阳离子总量的97%以上,其相互作用对土壤的理化性质产生重要影响。如图4所示,灌水后各灌溉处理土壤Na+和K+相对量随时间呈相反的趋势,一直延续到生育期结束;土壤Ca2+相对量则较稳定。LI20处理和FI20处理土壤Na+相对量随时间呈先减小后增大再减小的趋势,其中6月22日灌水后FI20处理土壤Na+相对量降幅达到28.1%,LI20处理降幅仅为8.2%;LI10处理和FI10处理土壤Na+相对量随时间呈先增大后减小的趋势。生育初期各处理土壤K+和Na+相对量大致相当,生育期结束后各处理K+相对量均不同程度增加,LI20处理和FI20处理土壤K+相对量增幅最大,分别达到284.8%和207.5%,显著提高了土壤K+/Na+,降低了土壤Na+毒性,根系层土壤逐渐由Na+性土壤转化成K+性土壤,显著改善了土壤性质。生育期结束后LI20处理和FI20处理土壤K+相对量均大于Na+相对量,LI10处理和FI10处理K+相对量均小于Na+相对量。
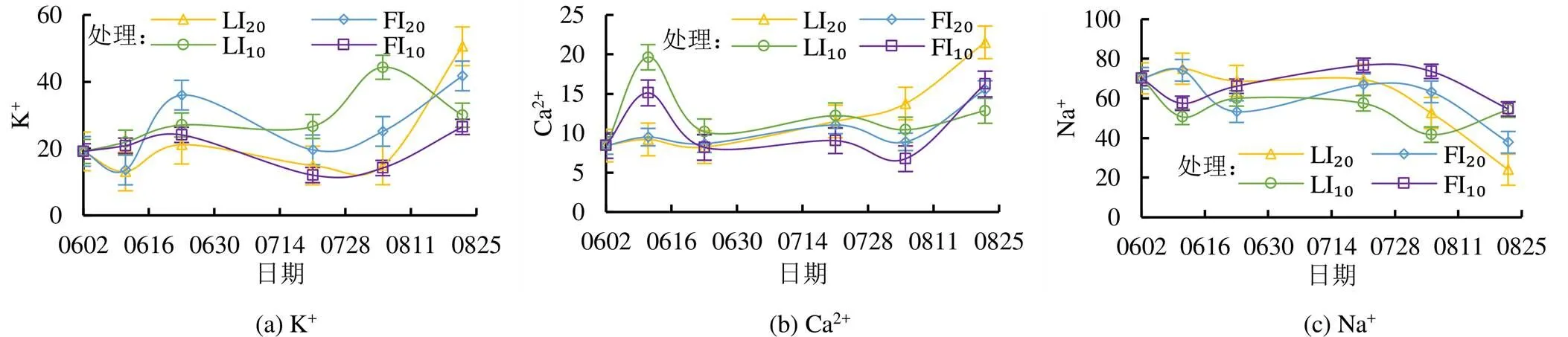
图4 土壤离子相对量随生育期的变化
2.3 玉米体内K+/Na+随生育期的变化规律
维持植物体内K+/Na+稳态在植物细胞对盐胁迫的耐受性中起关键作用[15-16]。如图5所示,各处理玉米茎和叶中K+/Na+随时间均呈逐渐减小的趋势,且降幅逐渐减小,根中K+/Na+则均较小,维持在2~4之间;土壤中Na+的过量积累导致玉米根系对K+的吸收受到破坏,显著降低根系中K+/Na+[19-20]。LI20和FI20处理玉米全生育期均表现出茎中K+/Na+高于叶,LI10和FI10处理生育后期茎中K+/Na+高于叶;全生育期各个处理叶中K+/Na+变幅较小但差异较大,茎中K+/Na+变幅较大且差异较大,生育前期茎中K+/Na+表现出FI20处理>LI20处理>LI10处理>FI10处理,生育后期茎中K+/Na+表现出FI20处理>FI10处理>LI20处理>LI10处理,FI20处理全生育期茎中K+/Na+均较大,生育后期FI10处理和LI10处理茎中K+/Na+均逐渐减小,FI20处理和LI20处理茎中K+/Na+均逐渐增大。叶中K+/Na+是作物耐盐性的重要指标之一,提高生育前期叶片K+/Na+有利于提高作物耐盐性。LI10处理生育前期叶中K+/Na+较小,生育后期叶中K+/Na+远远大于其他处理;FI10处理和FI20处理生育中期叶中K+/Na+变幅较小且基本相等,LI20处理和LI10处理叶中K+/Na+变幅较大且LI10处理叶中K+/Na+远远大于LI20处理。LI10处理和LI20处理全生育期根中K+/Na+均先增大后减小,FI10处理和FI20处理则均先减小后增大;FI10处理全生育期根中K+/Na+均较小;生育中期相同灌水量下,LI处理根中K+/Na+均大于FI处理。
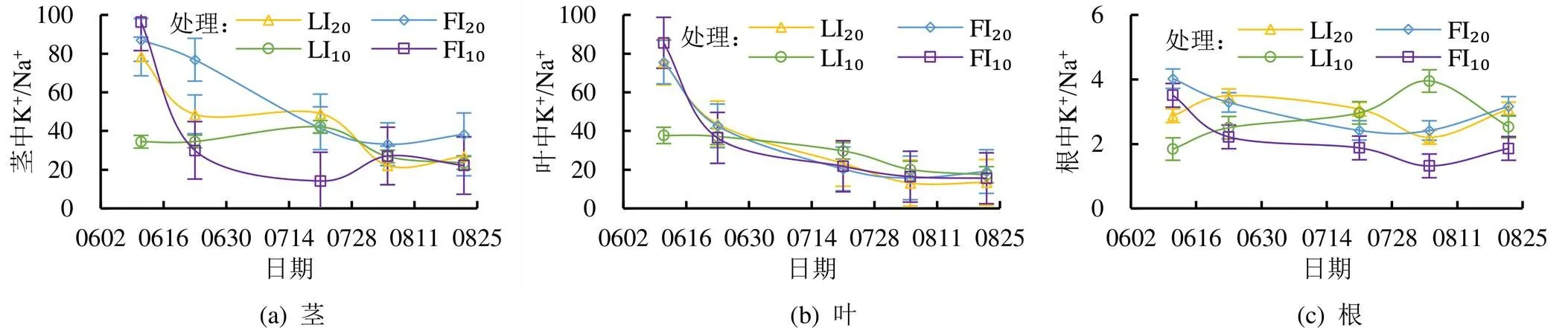
图5 不同灌水处理对玉米体内K+/Na+的影响
2.4 玉米根系K+/Na+与土壤K+、Ca2+、Na+关系
作物中K+/Na+大小是耐盐性的指标之一,不同处理创造不同的玉米根际环境,导致根系对K+和Na+的吸收程度不同,通过对LI处理和FI处理全生育期玉米根系中K+/Na+与根系层土壤中K+、Ca2+和Na+进行回归拟合,可定量分析土壤中不同离子对玉米根系K+/Na+的影响。
根系层土壤K+/Na+反映了根系层土壤K+和Na+相对量以及土壤性质,通过对LI处理和FI处理作物根系K+/Na+与根系层土壤K+/Na+和Ca2+质量分数进行回归拟合,得到回归模型为:
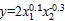
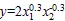
式(2)和式(3)的相关系数分别为0.85和0.93,其中表示根系K+/Na+,1表示根系层土壤K+/Na+,2表示根系层土壤Ca2+质量分数。由以上二式可得,不同灌水方式下土壤K+/Na+一定时,根系K+/Na+随着土壤Ca2+质量分数的增大而减小;Ca2+质量分数一定时,根系K+/Na+随着土壤K+/Na+的增大而增大;由于土壤中K+/Na+均小于1,LI处理下根系层土壤K+/Na+对根系K+/Na+的影响较大。
Ca2+是土壤质量的重要指标,也是植物细胞质膜和细胞内膜系统的重要组成部分,根系Ca2+质量分数在离子吸收的选择性,特别是根中K+/Na+的选择方面有着重要的作用[6]。为进一步探讨根系层土壤Ca2+质量分数对根系K+/Na+、Ca2+质量分数和根系层土壤K+/Na+的影响,分别建立回归模型,见图6。由图6(a)可知,根系K+/Na+随着根系层土壤Ca2+质量分数的增大而减小,Ca2+产生渗透调节时可提高作物的耐盐性,然而过高的Ca2+质量分数往往产生特定离子毒性[21],通过对LI处理和FI处理根系K+/Na+和根系层土壤Ca2+质量分数进行回归拟合,得到回归模型如式(4)、式(5):
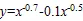

式(4)和式(5)的相关系数分别为:0.97和0.92。其中,表示根系K+/Na+;表示根系层土壤Ca2+质量分数;0.1和0.5分别为LI和FI处理的Ca2+胁迫系数,胁迫系数越大,根系层土壤中Ca2+对根系K+/Na+的抑制作用越强。根系层土壤Ca2+质量分数相同时,LI处理根系中K+/Na+较大,FI处理则较小。LI处理受土壤蒸发和降水的影响较大,根系层土壤K+和Na+短时间内变化程度较大,导致根系细胞离子吸收和运输能力较强[22],由于细胞中的K+对盐胁迫具有抵抗作用,所以根系细胞对K+的吸收相对较多。
对LI处理和FI处理根系层土壤Ca2+质量分数和根系Ca2+质量分数回归拟合(图6(b)),相关系数达到0.98,根系Ca2+质量分数随根系层土壤Ca2+质量分数的增大而增大;对根系层土壤Ca2+质量分数和根系层土壤K+/Na+回归拟合(图6(c)),相关系数为0.62,根系层土壤K+/Na+随着根系层土壤Ca2+质量分数的增大先减小后增大;由式(2)和式(3)得,根系K+/Na+随着根系层土壤K+/Na+的增大而增大,而由图6(b)—图6(c)可知,根系层土壤K+/Na+随着根系层土壤Ca2+质量分数的增大先减小后增大,而根系K+/Na+随着根系层土壤Ca2+质量分数的增大而逐渐减小,由此可得,根系层土壤Ca2+的增大通过抑制根系层土壤K+/Na+的增大从而抑制根系K+/Na+的增大。
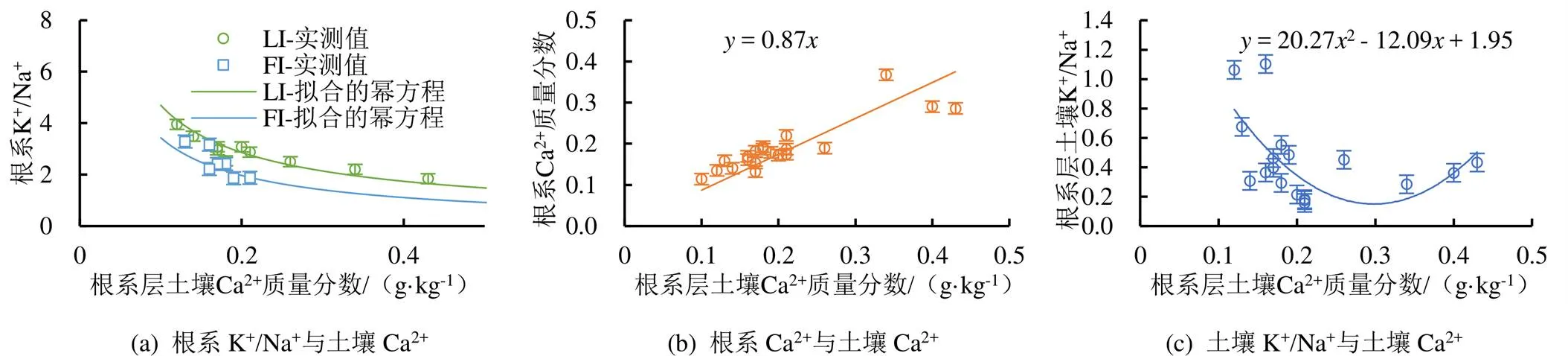
图6 根系层土壤Ca2+质量分数对根系K+/Na+、Ca2+质量分数和根系层土壤K+/Na+的影响
2.5 根茎叶K+/Na+相关性分析
根茎叶中K+/Na+的相关性反映了K+和Na+在不同器官迁移的相互关系,如表3所示,除LI10处理外,其余处理根茎叶K+/Na+相关性均达显著水平(<0.05),其中茎和根之间相关性均达极显著水平(<0.01)。各处理根和茎K+/Na+相关性大小为:LI20处理>FI20处理>FI10处理>LI10处理,灌水量越大,根和茎之间K+/Na+相关性越强。各处理茎和叶之间K+/Na+相关性大小为:FI20处理>LI10处理>FI10处理>LI20处理,FI处理下灌水量越大,相关性越强;LI处理下灌水量越小,相关性越强。
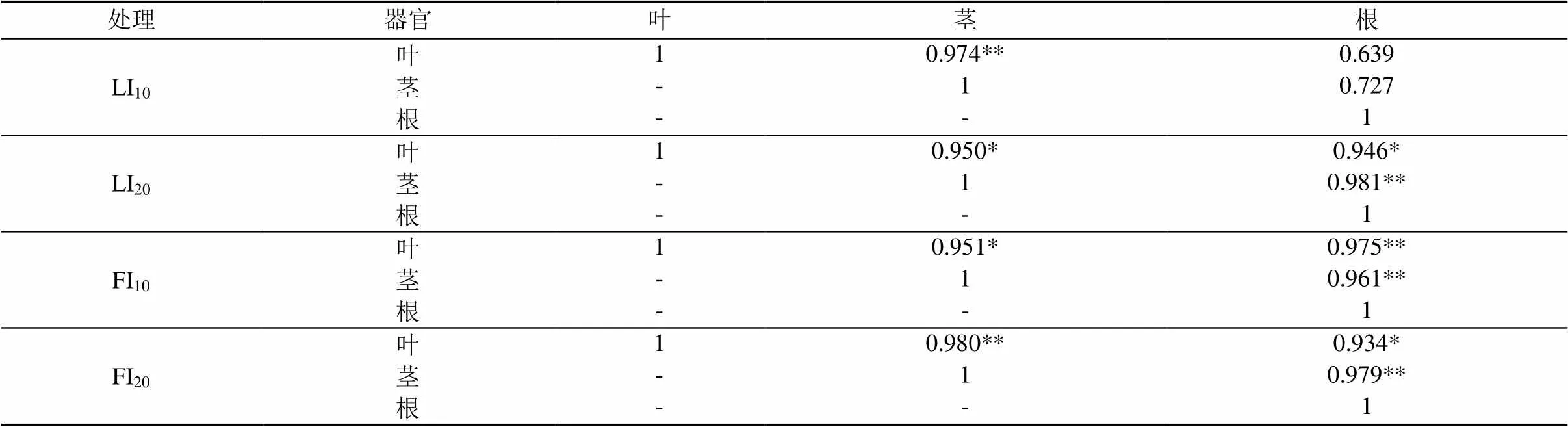
表3 不同处理根茎叶K+/Na+相关性分析
注 *在0.05级别(双尾),相关性显著;**在0.01级别(双尾),相关性显著。
3 讨 论
Na+和K+均为单价离子,但由于其物理和化学性质的差异导致灌水后其在土壤中的迁移规律不一致,Na+和K+相对量的大小是土壤性质的重要指标[23]。灌水、降水及蒸发对土壤中Na+的影响较大,由于土壤中Na+和K+存在拮抗作用[19],Na+的变化易导致K+变化,所以灌水后各处理土壤Na+和K+绝对量和相对量随时间均呈相反的趋势,一直延续到生育期结束。一方面Ca2+易吸附在土壤胶体颗粒表面,灌水对Ca2+的淋洗程度较小,另一方面Ca2+在不同土层之间迁移能力较弱,土层Ca2+量较为稳定[24]。灌水后FI处理可以有效保存土壤水分,对Na+产生有效淋洗,灌水量越大的处理淋洗效果越好,灌水量较小时则对LI处理和FI处理根系层土壤淋洗效果差别不明显;较丰富的降水量有利于降低LI处理根系层土壤Na+的绝对量和相对量,灌水量越大,降幅也越明显。生育前期较大的灌水量有利于降低LI处理和FI处理根系层土壤K+/Na+,从而为作物营养生长阶段的生长发育提供有利的土壤条件。因此,在农业生产实践中一方面要关注在作物全生育期通过提高FI处理的灌水量提高根系层土壤K+的相对量,另一方面要关注种植春玉米时考虑在作物生育前期适当提高LI处理的灌水量,春玉米生育后期可适当减少灌水量。
由于Na+与K+被植物吸收时存在竞争作用[14],玉米生长发育对K+的需求随着生育期的进程逐渐减小,随着Na+的不断积累,Na+与K+竞争进入茎和叶中的能力逐渐增强。玉米植株叶片对盐胁迫最为敏感[24],幼嫩叶片的渗透调节能力大于成熟叶片的渗透调节能力[25-26],叶片盐胁迫调节机制主要是进行Na+排泄[27],但叶片的这种负反馈调节机制是有限的,长期盐碱土壤环境导致叶片对Na+的排泄受阻从而导致叶片中K+/Na+较小,且随着生育期进程逐渐减小。盐分胁迫影响作物对水分的吸收[26],生育前期较大的灌水量改善了作物根际水分环境,促进了根中K+向茎和叶中迁移,提高茎和叶的K+/Na+;灌水量较大的处理影响茎和叶中K+/Na+的主要因素是灌水,灌水量较小的处理则是茎和叶为应对水分和盐碱胁迫对K+和Na+的不同需求[24];FI处理灌水量较大时能在降水量较少的时期维持根系层土壤适宜的水分状况,从而维持叶片较高的K+/Na+。生育后期降水量较丰富时LI处理较大的灌水量显著改善了根系层土壤水分状况,提高了作物叶片K+/Na+。当作物受到盐分胁迫时,作物从叶片中排除Na+是应对其盐分胁迫的一种有效方式[27-29],叶片中的盐分一部分从叶片表面进行排泄并随着降水被淋洗,另一部分会再循环到根系中[30],所以根系K+/Na+和叶片K+/Na+具有显著相关性;茎作为根叶离子运输的通道,受灌水量的影响较大,较大的灌水量有利于作物蒸腾,从而提高作物对K+的运输能力。茎和叶之间的离子运输主要取决于叶片对离子的需求,FI处理下叶片蒸腾能力较强,较大的灌水量有利于茎叶之间K+和Na+的运输,LI处理灌水量越小作物对水分亏缺越敏感,作物叶片通过提高K+/Na+来应对水分亏缺和盐分胁迫,从而对茎中的K+/Na+依赖性更强。
灌水后随着土壤中硫酸钙和碳酸钙的溶解,土壤中较大的Ca2+质量分数提高了其交换能力,进一步促进了土壤胶体上吸附的Na+释放到土壤溶液中,根系对Na+吸收较大导致其K+/Na+较小;另一方面钙盐的低溶解度意味着它很容易在土壤溶液中沉淀,这也增加了土壤中可溶性Na+的相对比例。根系K+/Na+与土壤中K+/Na+和Ca2+质量分数密切相关,不同灌水方式创造不同的根际环境,根系层土壤水分盐分的差异导致作物根系对K+/Na+的吸收程度不同,从而导致作物的耐盐性不同。Ca2+是土壤质量的重要指标[31-33],但土壤中过高的Ca2+质量分数会影响植物对土壤中K+的吸收;Ca2+是植物耐盐性的第一道防线[11],土壤中的Ca2+质量分数较大时则可以促进根系细胞维持较高的Ca2+质量分数。LI处理根系层土壤水分受气象因素影响较大,降水和蒸发均对根系层土壤K+和Na+的组成产生影响,根系层土壤K+和Na+质量分数不断发生变化,根系对K+和Na+渗透胁迫和离子毒性的反应更加灵敏,所以根系K+/Na+对根系层土壤中K+/Na+的反应也较FI处理更敏感。
4 结 论
1)灌水显著改善土壤性质,灌水后膜下滴灌处理土壤Na+相对量降幅远大于常规滴灌处理。
2)各灌溉处理玉米茎和叶中K+/Na+随生育期进程均逐渐减小,根中K+/Na+较稳定;膜下滴灌较大灌水量处理全生育期茎中K+/Na+均较大,生育前期膜下滴灌处理叶片K+/Na+均较大。
3)建立的作物根系K+/Na+与根系层土壤K+/Na+、Ca2+的回归模型和根系Ca2+与根系层土壤K+/Na+、Ca2+的回归模型相关系数均达0.85以上。常规滴灌处理相对膜下滴灌处理根系层土壤K+/Na+和Ca2+质量分数均对根系K+/Na+的影响较大;常规滴灌和膜下滴灌处理根系层土壤Ca2+的增大通过抑制根系层土壤K+/Na+的增大从而抑制根系K+/Na+的增大。
[1] MUCHATE N S, NIKALJE G C, RAJURKAR N S, et al. Plant salt stress: Adaptive responses, tolerance mechanism and bioengineering for salt tolerance[J]. The Botanical Review, 2016, 82(4): 371-406.
[2] 李攻科, 王卫星, 曹淑萍, 等. 天津滨海土壤盐分离子相关性及采样密度研究[J]. 中国地质, 2016, 43(2): 662-670.
LI Gongke, WANG Weixing, CAO Shuping, et al. Correlation of soil salt ions and sampling densities in Tianjin coastal area[J]. Geology in China, 2016, 43(2): 662-670.
[3] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: A review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324-349.
[4] RUS A M, ESTAÑ M T, GISBERT C, et al. Expressing the yeast HAL1 gene in tomato increases fruit yield and enhances K+/Na+selectivity under salt stress[J]. Plant, Cell & Environment, 2001, 24(8): 875-880.
[5] VOLKOV V, AMTMANN A. Thellungiella halophila, a salt-tolerant relative of Arabidopsis thaliana, has specific root ion-channel features supporting K+/Na+homeostasis under salinity stress[J]. The Plant Journal, 2006, 48(3): 342-353.
[6] GHARS M A, PARRE E, DEBEZ A, et al. Comparative salt tolerance analysis between Arabidopsis thaliana and Thellungiella halophila, with special emphasis on K+/Na+selectivity and proline accumulation[J]. Journal of Plant Physiology, 2008, 165(6): 588-599.
[7] ROGEL J A, ARIZA F A, SILLA R O. Soil salinity and moisture gradients and plant zonation in Mediterranean salt marshes of Southeast Spain[J]. Wetlands, 2000, 20(2): 357-372.
[8] 朱义, 何池全, 杜玮, 等. 盐胁迫下外源钙对高羊茅种子萌发和幼苗离子分布的影响[J]. 农业工程学报, 2007, 23(11): 133-137.
ZHU Yi, HE Chiquan, DU Wei, et al. Effects of exogenous calcium on the seed germination and seedling ions distribution of Festuca arundinacea under salt-stress[J]. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(11): 133-137.
[9] PARSONS J W. Humus chemistry—genesis, composition, reactions[J]. Soil Science, 1983, 135(2): 129-130.
[10] TARCZYNSKI M C, JENSEN R G, BOHNERT H J. Stress protection of transgenic tobacco by production of the osmolyte mannitol[J]. Science, 1993, 259(5094): 508-510.
[11] MUNNS R. Physiological processes limiting plant growth in saline soils: Some dogmas and hypotheses[J]. Plant, Cell & Environment, 1993, 16(1): 15-24.
[12] MURGUÍA J R, BELLÉS J M, SERRANO R. A salt-sensitive 3'(2'), 5'-bisphosphate nucleotidase involved in sulfate activation[J]. Science, 1995, 267(5195): 232-234.
[13] 李春俭. 高级植物营养学[M]. 北京: 中国农业大学出版社, 2008: 136-138.
LI Chunjian. Mineral nutrition of higher plants[M]. Beijing: China Agricultural university Press, 2008: 136-138.
[14] PASCAL Mäser, MARKUS Gierth, JULIAN Schroeder. Molecular mechanisms of potassium and sodium uptake in plants[J]. Plant and Soil, 2002, 247(1): 43-54.
[15] BHANDAL I S, MALIK C P. Potassium estimation, uptake, and its role in the physiology and metabolism of flowering plants[J]. International Review of Cytology, 1988, 110: 205-254.
[16] WANG M, ZHENG Q, SHEN Q, et al. The critical role of potassium in plant stress response[J]. International Journal of Molecular Sciences, 2013, 14(4): 7 370-7 390.
[17] MUNNS R. Comparative physiology of salt and water stress[J]. Plant, Cell & Environment, 2002, 25(2): 239-250.
[18] KOPITTKE P M, BLAMEY F P C, KINRAIDE T B, et al. Separating multiple, short-term, deleterious effects of saline solutions on the growth of cowpea seedlings[J]. The New Phytologist, 2011, 189(4): 1 110-1 121.
[19] DEINLEIN U, STEPHAN A B, HORIE T, et al. Plant salt-tolerance mechanisms[J]. Trends in Plant Science, 2014, 19(6): 371-379.
[20] BHASKAR Gupta, BINGRU Huang. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization[J]. International Journal of Genomics, 2014, 70: 15-26.
[21] LIU T Z, ZHUANG L L, HUANG B R. Metabolic adjustment and gene expression for root sodium transport and calcium signaling contribute to salt tolerance in Agrostis grass species[J]. Plant and Soil, 2019, 443(1/2): 219-232.
[22] ALSHAMMARY S F, QIAN Y L, WALLNER S J. Growth response of four turfgrass species to salinity[J]. Agricultural Water Management, 2004, 66(2): 97-111.
[23] JALALI M, ARIAN T M, RANJBAR F. Selectivity coefficients of K, Na, Ca, and Mg in binary exchange systems in some calcareous soils[J]. Environmental Monitoring and Assessment, 2020, 192(2): 1-14.
[24] HU Anyan, YU Zhaoyu, LIU Xiuhua, et al. The effects of irrigation and fertilization on the migration and transformation processes of main chemical components in the soil profile[J]. Environmental Geochemistry and Health, 2019, 41 (6): 2 631-2 648.
[25] MEINOLF Lindhauer, HANS Haeder, HELMUT Beringer. Osmotic potentials and solute concentrations in sugar beet plants cultivated with varying potassium/sodium ratios[J]. Ztschrift Für Pflanzenernhrung Und Bodenkunde, 1990, 153(1): 25-32.
[26] LINDHAUER M G, HAEDER H E, BERINGER H. Osmotic potentials and solute concentrations in sugar beet plants cultivated with varying potassium/sodium ratios[J]. Zeitschrift Für Pflanzenernährung Und Bodenkunde, 1990, 153(1): 25-32.
[27] HICHEM H, MOUNIR D, NACEUR E A. Differential responses of two maize (Zea mays L.) varieties to salt stress: Changes on polyphenols composition of foliage and oxidative damages[J]. Industrial Crops and Products, 2009, 30(1): 144-151.
[28] JOHANSON J G, CHEESEMAN J M, ENKOJI C. Uptake and distribution of sodium and potassium by corn seedlings II. ion transport within the mesocotyl[J]. Plant Physiology, 1983, 73(1): 159-164.
[29] PORCEL R, AROCA R, AZCON R, et al. Regulation of cation transporter genes by the arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests improved salt tolerance due to reduced Na^+ root-to-shoot distribution[J]. Mycorrhiza, 2016, 26(7): 673-684.
[30] DREW M C, LÄUCHLI A. Oxygen-dependent exclusion of sodium ions from shoots by roots of Zea mays (cv pioneer 3906) in relation to salinity damage[J]. Plant Physiology, 1985, 79(1): 171-176.
[31] JOHANSON J G, CHEESEMAN J M. Uptake and distribution of sodium and potassium by corn seedlings I. role of the mesocotyl in `Sodium exclusion'[J]. Plant Physiology, 1983, 73(1): 153-158.
[32] CHEESEMAN J M. Mechanisms of salinity tolerance in plants[J]. Plant Physiology, 1988, 87(3): 547-550.
[33] SCHUBERT S, LÄUCHLI A. Na+exclusion, H+release, and growth of two different maize cultivars under NaCl salinity[J]. Journal of Plant Physiology, 1986, 126(2/3): 145-154.
[34] DUSSERRE J, CHOPART J L, DOUZET J M, et al. Upland rice production under conservation agriculture cropping systems in cold conditions of tropical Highlands[J]. Field Crops Research, 2012, 138: 33-41.
[35] SAHIN Anapali. A laboratory study of the effects of water dissolved gypsum application on hydraulic conductivity of saline-sodic soil under intermittent ponding conditions[J]. Irish Journal of Agricultural & Food Research, 2005, 44: 297-303.
Irrigation Affects the Translocation of Cations from Soil to Maize Roots in Saline-alkaline Soil
WANG Hang1,3, ZHOU Qingyun1,2,3*, ZHANG Baozhong2, YIN Linping1,2,3
(1. College of Water Conservancy Engineering, Tianjin Agricultural University, Tianjin 300392, China; 2. State Key Laboratory of Simulation and Regulation of Water Cycle in River Basin, China Institute of Water Resources and Hydropower Research, Beijing 100083, China; 3. Sino-US International Joint Research Center for Ecological Agriculture and Water Environment Protection, Tianjin 300392, China)
【】Soil salinity is an abiotic stress hindering agricultural production worldwide, especially in coastal areas where the groundwater is usually shallow. The aim of this paper is to study experimentally how irrigation affects translocation of major cations from soil to the roots of maize in saline-alkaline soils.【】The experiments were conducted at a maize field in a coastal saline-alkali region. We compared four irrigation methods: conventional drip irrigation with irrigation amounts of 10 mm (LI10) and 20 mm (LI20) respectively, and mulched drip irritation with the same irrigation amounts (FI10and FI20). In each treatment, we measured the changes in K+, Ca2+and Na+in both the rhizosphere and roots, from which we derived regression models to analyze how the irrigation method and irrigation amount modulated the cations contents in soil and their translocation to the maize roots.【】Mulched drip irrigation reduced Na+content in the rhizosphere more significantly than the conventional drip irrigation. Increasing irrigation amount in the mulched drip irrigation increased K+/Na+content in the maize stem in the whole growth season, but only increased their content in the leaves at early growth stage. Conventional drip irrigation affected the relationship between the concentrations of K+/Na+and Ca2+in the rhizosphere and the K+/Na+content in the roots more than the mulched drip irrigation. The increase in Ca2+in the rhizosphere due to irrigation was likely to have made K+/Na+less mobile in soil, thereby reducing their translocation from soil to roots and benefiting the crop growth as a result.【】Drip-irrigating maize in coastal saline-alkali soil can effectively improve the translocation of cations from soil to crop roots, especially the mulched drip irrigation, thereby ameliorating salinity stress to the crop. It can thus be used as an improved irrigation technology for crop production in such regions.
coastal saline soil; drip irrigation; cation translocation; mulching; maize
1672 - 3317(2021)12 - 0036 - 08
S274.1
A
10.13522/j.cnki.ggps.2021114
王航, 周青云, 张宝忠, 等. 不同灌水处理下滨海盐碱地土壤-玉米阳离子变化规律及相关关系研究[J]. 灌溉排水学报, 2021, 40(12): 36-43.
WANG Hang, ZHOU Qingyun, ZHANG Baozhong, et al.Irrigation Affects the Translocation of Cations from Soil to Maize Roots in Saline-alkaline Soil[J].Journal of Irrigation and Drainag, 2021, 40(12): 36-43.
2021-03-31
国家自然科学基金项目(51609170);国家重点研发计划项目(2019YFC0409203);天津市研究生科研创新项目(2019YJSS101)
王航(1997-),男,山西吕梁人。硕士研究生,主要从事节水灌溉理论与新技术研究。E-mail: 1845196651@qq.com
周青云(1980-),女,山西河津人。副教授,硕士生导师,主要从事节水灌溉理论与新技术方面的研究。E-mail: zhouqyand@126.com
责任编辑:韩 洋

