氯吡格雷基因对急性冠脉综合征患者血小板反应性及主要心血管事件的影响*
李艳丽,李晓烨,陈 灿,潘 雯,李晓宇,吕迁洲
(复旦大学附属中山医院药剂科,上海 200032)
急性冠状动脉综合征(ACS)是冠心病的一种严重类型,通常由于冠状动脉粥样硬化斑块破裂、血流减少、血栓形成导致[1]。根据指南推荐[2-3],阿司匹林和氯吡格雷双联抗血小板治疗可以预防ACS患者经皮冠状动脉介入(PCI)支架植入后的主要心血管不良事件(MACE)。然而,有研究报道有5%~15%的ACS患者出现心肌梗死、脑卒中甚至死亡等临床终点事件,这主要是由于个体对氯吡格雷反应的差异性造成的[4]。氯吡格雷是一种无活性的前体药物,通过肠道吸收,在体内需要依赖肝脏细胞色素P450(CYP450)酶催化转化成活性代谢产物,再与血小板表面腺苷酸环化酶偶联的腺苷二磷酸(ADP)受体P2Y12结合,选择性地抑制血小板聚集[5]。其中,CYP450酶系统中的CYP2C19是影响氯吡格雷疗效的主要基因。有研究表明,CYP2C19等位基因(*2/*2、*2/*3、*3/*3)功能降低可能与支架内血栓形成和MACE的风险增加有关[6-7],其导致的氯吡格雷代谢减慢也被证明可以降低ACS患者服用负荷剂量氯吡格雷的抗血小板活性[8]。另有研究发现,外排泵P-糖蛋白(P-gp)通过ABCB1编码的细胞外膜和细胞内膜转运药物,可能通过影响吸收而导致氯吡格雷反应的变异性[9]。此外,编码基因中的对氧磷酶1(PON1)参与了氯吡格雷活化过程中的水解反应,因此其基因多态性也影响氯吡格雷生物活化[10]。本研究旨在探讨ACS患者氯吡格雷相关代谢基因多态性与其临床抗血小板作用和MACE的关系。
1 资料与方法
1.1一般资料
1.1.1纳入与排除标准 纳入标准:(1)明确诊断为ACS的患者,包括急性ST段抬高型心肌梗死、非ST段抬高型心肌梗死和不稳定性心绞痛;(2)年龄大于或等于18岁;(3)接受阿司匹林和氯吡格雷双重抗血小板治疗;(4)胸痛大于或等于10 min,心电图ST段和T波改变,心脏生物标志物升高。排除标准:(1)对阿司匹林或氯吡格雷过敏或有禁忌的患者;(2)年龄小于18岁或未签署知情同意书;(3)出血和出血性疾病病史;(4)伴有严重肝或肾功能不全;(5)同时使用西洛他唑或加糖蛋白Ⅱb/Ⅲa受体拮抗剂。
1.1.2一般资料 收集2019年1-12月在本院心脏重症监护室就诊的170例诊断为ACS的患者临床资料。所有患者均表现为胸痛、不适、气短、头晕、恶心、出汗等症状,并伴随心脏生物标志物肌钙蛋白、肌酸激酶水平升高和心电图T波、ST段改变。所有患者均行PCI手术。本研究经本院伦理委员会审核批准,所有患者均签署了书面知情同意书。
1.2方法
1.2.1治疗方法 所有患者行PCI术前均给予负荷剂量的氯吡格雷(300 mg)和阿司匹林(300 mg),然后维持75 mg/d的氯吡格雷联合100 mg/d的阿司匹林抗血小板治疗。所有患者入院时同时服用低分子肝素、血管紧张素转化酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)、他汀类、β受体阻滞剂、质子泵抑制剂(PPI)和硝酸酯类等药物。
1.2.2基因检测 患者入院后采集大约2 mL的全血样本,置于含有抗凝剂乙二胺四乙酸(EDTA)的真空采集器中,用于氯吡格雷基因检测。采用QIAamp 血液DNA提取试剂盒(德国Qiagen公司)分离每例患者的DNA,基于Sequence Mass Array平台进行基因单核苷酸多态性(SNP)检测。CYP2C19*2、CYP2C19*3、ABCB1和PON1 Q192R LOF基因分别为681G>A(rs4244285)、636G>A(rs4986893)、3435C>T(rs1045642)和575A>G(rs662)的点突变。根据不同基因型所编码的酶对氯吡格雷的不同药物代谢动力学特征将野生基因型(*1/*1)归为快代谢型(EM),将突变杂合基因型(*1/*2、*1/*3)归为中间代谢型(IM),将突变纯合基因型(*2/*2、*2/*3、*3/*3)归为慢代谢型(PM)[11]。
1.2.3血小板聚集抑制率测定 负荷剂量氯吡格雷给药5 d后,采集大约4 mL的全血样本,通过血栓弹力图分析仪(TEG,美国Heomescope公司)测定血小板聚集抑制率(IPA),采用计算机记录振幅的变化。凝血强度振幅的最大变化被定义为最大凝血强度(MA)。根据加入血样诱导剂的不同,MA可分为凝血酶诱导的最大凝血强度(MAThrombin)、20 μmol/L ADP诱导的最大凝血强度(MAADP)和纤维蛋白原诱导的最大凝血强度(MAFibrin)。ADP诱导的IPA(%)=(MAADP-MAFibrin)/(MAThrombin-MAFibrin)×100%,其中IPA<30%为氯吡格雷治疗后血小板高反应性(HPR)组,IPA≥30%为氯吡格雷治疗后血小板低反应性(LPR)组[12]。同时将花生四烯酸(AA)诱导的IPA<50%定义为阿司匹林抵抗。
1.2.4随访与临床终点事件 所有纳入患者于PCI术后12个月内进行定期门诊和电话随访。主要观察随访患者MACE的发生率,包括心源性死亡、心血管死亡率、心肌梗死、缺血性脑卒中和病变血管的血运重建。

2 结 果
2.1患者的基本特征 在所有纳入的患者中,有21例患者失访,最终研究的样本量为149例,其中男118例(79.19%),女31例(20.81%);年龄31~90岁,平均(65.29±11.23)岁。在PCI术后12个月的随访中,21例(14.09%)患者再次入院接受血管重建术,3例(2.01%)患者发生缺血性脑卒中事件。见表1。
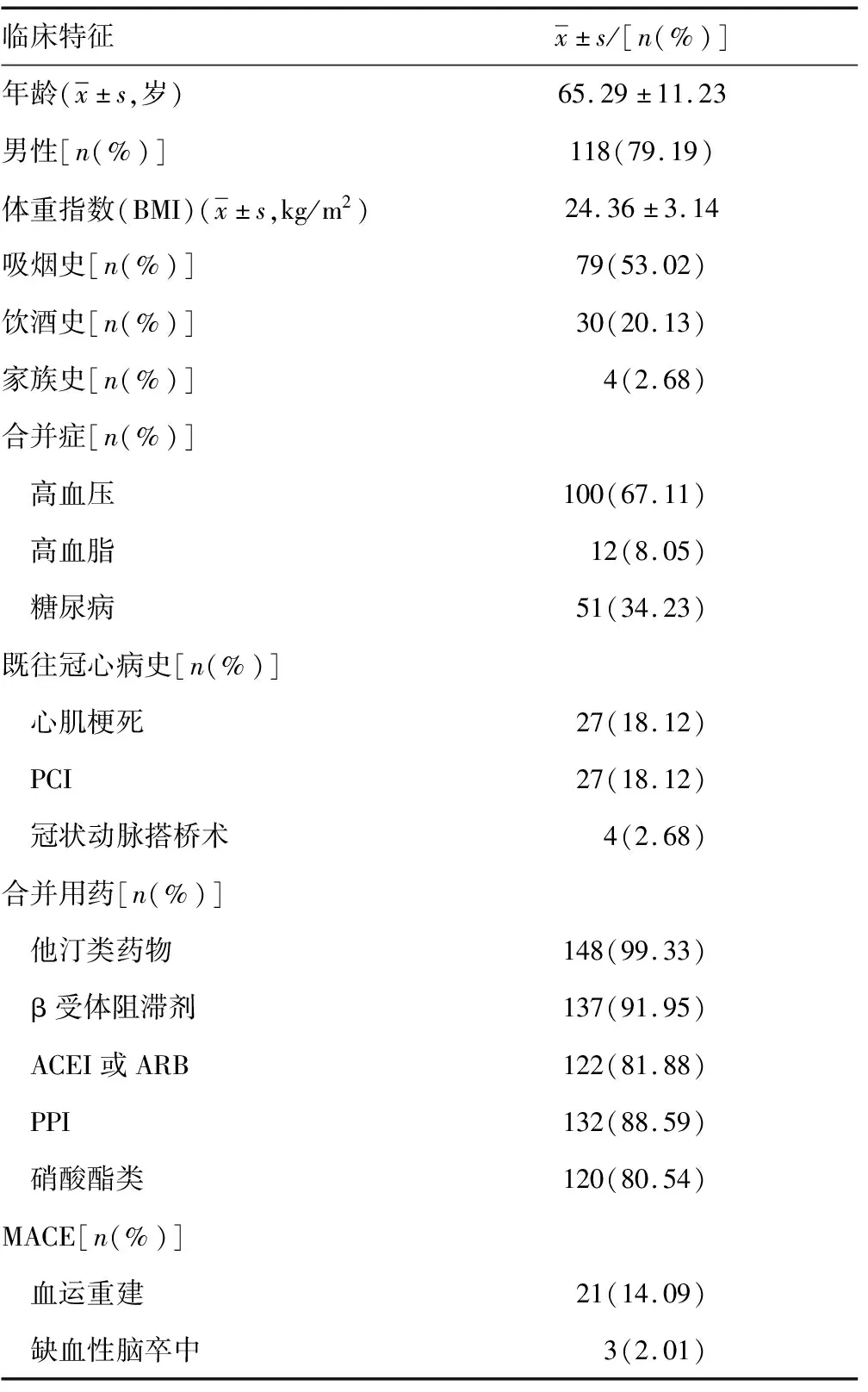
表1 纳入ACS患者的临床特征(n=149)
2.2患者的基因型分布和等位基因的频率分布 本研究对与氯吡格雷临床疗效相关的4种基因型进行了检测,包括CYP2C19*2(rs4244285)、*3(rs4986893)、ABCB1 C3435T(rs1045642)和PON1 Q192R(rs662)。除PON1 Q192R(rs662)外,所有研究群体的遗传变异均处于Hardy-Weinberg平衡状态(P>0.05),见表2。

表2 患者的基因型分布和等位基因的频率分布(n=149)
2.3单因素分析预测HPR的风险因素 入选的149例患者中,HPR组23例(15.44%),LPR组126例(84.56%),HPR组与LPR组患者相比,AA诱导的IPA显著降低(P<0.05)。在CYP2C19*2、CYP2C19*3、ABCB1、PON1 Q192R LOF等位基因存在时,两组差异有统计学意义(P<0.05),其他指标差异均无统计学意义(P>0.05),见表3。
2.4多因素logistic回归分析预测HPR的风险因素 将单因素分析中,P<0.15的变量(性别、BMI、AA-IPA、合并ACEI或ARB、合并硝酸酯类、基因型CYP2C19*2、CYP2C19*3、ABCB1、PON1 Q192R LOF)作为协变量,HPR为因变量进行logistic回归分析。结果显示,AA-IPA、CYP2C19*2、CYP2C19*3 LOF等位基因为发生HPR的危险因素。见表4。

表4 多因素logistic回归分析预测HPR的风险因素
2.5多因素logistic回归分析预测MACE的风险因素 在12个月的随访中,主要的MACE包括因血运重建而再次住院和缺血性脑卒中事件,患者为24例(16.11%)。在多变量logistic回归分析中,阿司匹林抵抗(AA-IPA<50%)和ADP-IPA<30%与MACE之间差异无统计学意义(P>0.05)。CYP2C19*2 LOF等位基因与PCI术后12个月内MACE的高风险相关(OR=3.112,95%CI1.048~9.241,P=0.041)。见表5。
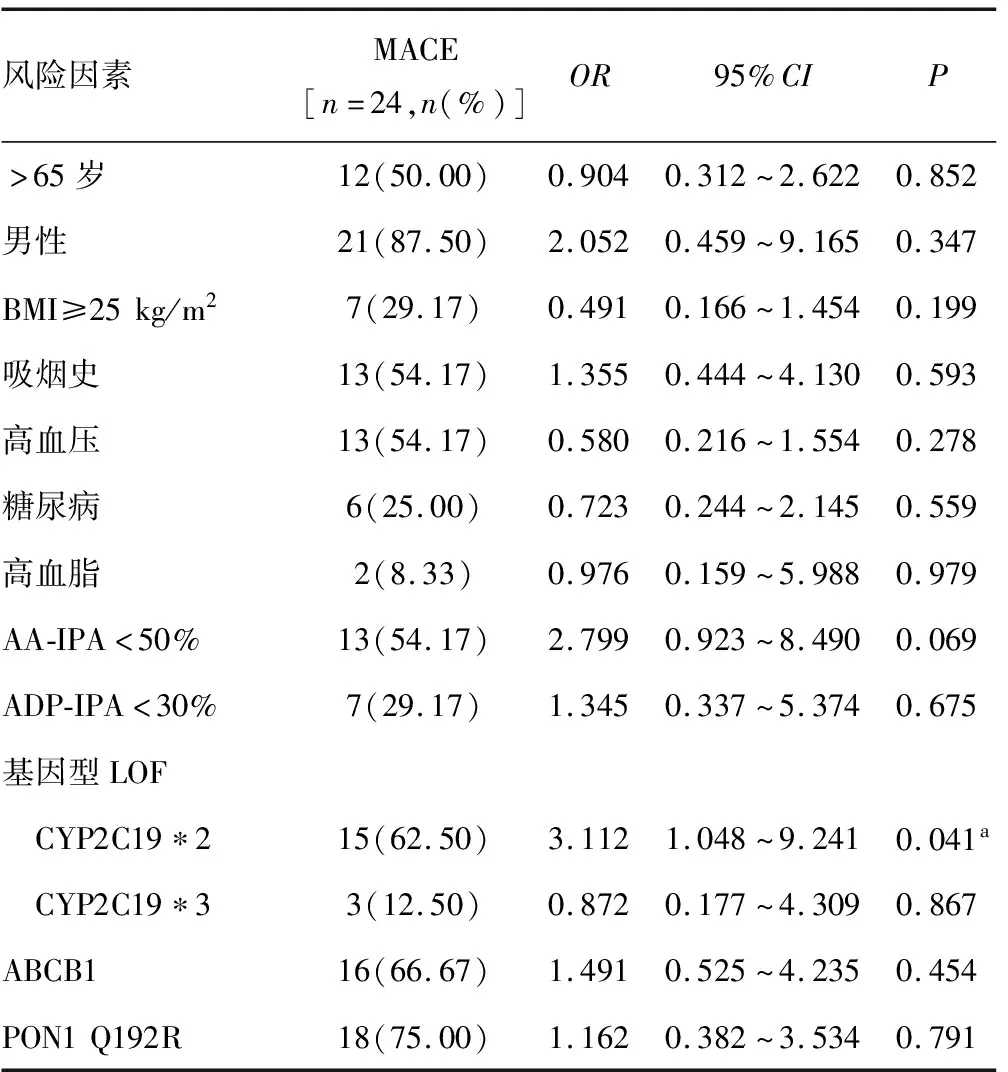
表5 多因素logistic回归分析预测MACE的风险因素
3 讨 论
目前,PCI术后的标准双联抗血小板(阿司匹林联合氯吡格雷)治疗已成为ACS患者的主要治疗方案,可减少心血管不良事件的发生率。研究发现,氯吡格雷的个体差异性对患者治疗后的血小板反应性具有重要意义。常规进行氯吡格雷相关基因检测对ACS患者的个体化治疗方案具有一定的指导意义。本研究对149例行PCI术的ACS患者进行了氯吡格雷基因型检测,采用血栓弹力图(TEG)检测PCI术后患者的氯吡格雷治疗后血小板反应性。
氯吡格雷作为一种前体药物,需要经过细胞P450酶的两步氧化反应才能转化为有活性的代谢产物而发挥作用,其中CYP2C19基因编码的酶蛋白是氯吡格雷代谢的关键酶,CYP2C19基因多态性与氯吡格雷抵抗有密切关系[13]。研究表明,CYP2C19 LOF等位基因会导致ADP诱导的IPA降低,增加支架血栓的风险[14]。在本研究中,CYP2C19*2 LOF等位基因的发生率(36.91%)较高,但CYP2C19*3、ABCB-C3435T和PON1 Q192R LOF等位基因的发生率均与以往研究相似。另外,PON1 Q192R(rs662)LOF等位基因的发生(MAF为46.97%)差异有统计学意义(P<0.05),可能与研究人群的差异有关。
HPR的发生是遗传因素、细胞因素和临床因素等多因素共同作用的结果,其中遗传因素——基因多态性起到了关键性作用。本研究将年龄、性别、BMI、吸烟史、饮酒史及合并高血压、高血脂和糖尿病在内的心血管危险因素作为ACS发生的相关危险因素。在单因素分析中,AA-IPA、CYP2C19*2、CYP2C19*3、ABCB1 TT和PON1 Q192R LOF等位基因在两组患者中差异有统计学意义(P<0.05)。将P<0.15的相关因素经logistic回归分析发现,CYP2C19*2和CYP2C19*3是HPR的独立风险因素。
CYP2C19是催化氯吡格雷生物转化不可缺少的药物代谢酶。CYP2C19*2 和CYP2C19*3 LOF等位基因损害生物活性,降低氯吡格雷活性代谢物浓度,使氯吡格雷抗血小板作用减弱,从而导致不良心血管事件发生风险增加[15]。本研究结果显示,CYP2C19*2和CYP2C19*3 LOF等位基因与ACS患者血小板反应性增高有关(P<0.05)。PON1是影响血小板活化的另一个遗传因素,在氯吡格雷的生物转化过程中起着重要作用,陆文岐等[16]研究表明,中国人群PON1(rs662)A等位基因为HPR的独立风险因素。本研究结果显示,HPR组患者的PON1 Q192R LOF等位基因发生率明显高于LPR组患者(P<0.05),未发现PON1基因多态性与HPR的相关性。此外,ABCB1的SNP改变会影响氯吡格雷在肠道内的吸收代谢,可能是氯吡格雷低反应性产生的原因之一。有研究报道,与CC型或CT型患者相比较,TT型患者氯吡格雷吸收减少,并与支架内早期血栓形成明显相关[9]。本研究中,HPR组患者的ABCB1 TT型等位基因发生率明显高于LPR组(P<0.05),两组患者的CC型和CT型发生率差异无统计学意义(P>0.05)。
阿司匹林作为经典的抗血小板药物,不仅可以通过抑制环氧合酶抑制血小板聚集,还在ADP诱导的血小板抑制中发挥一定的作用[17]。在本研究中,HPR组AA诱导的IPA明显低于LPR组(P<0.05)。另外,阿司匹林抵抗患者心血管不良事件的发生率较高(54.17%),这可能与阿司匹林抵抗导致环氧合酶依赖的血栓素A2形成的抑制不足有关[18]。因此,采取积极的双联抗血小板治疗对预防PCI术后血栓栓塞事件有重要作用。
氯吡格雷的基因多态性与PCI术后MACE的发生密切相关,SUN等[19]研究发现,CYP2C19中间代谢和慢代谢患者发生MACE的风险是快代谢患者的2.664倍,这是由于氯吡格雷不能被CYP2C19 LOF等位基因生物转化,不能有效抑制血小板的活性状态,最终导致血栓形成。本研究分析了24例发生MACE患者的风险因素,结果发现,与非LOF等位基因相比,CYP2C19*2 LOF等位基因与MACE发生率增加有关,表明CYP2C19*2 LOF等位基因与PCI术后MACE的发生相关。
本研究有一定的局限性:(1)研究的样本量较少,需要进行大规模的前瞻性、随机和对照良好的试验来评估氯吡格雷多态性与抗血小板作用的相关性;(2)患者的随访时间较短,延长随访时间可能对以后的研究提供更大的价值;(3)随访途径需要优化,电话随访可能不能充分显示患者的预后情况,需要在今后的研究中采取更优化的随访方案;(4)未观察PCI术后出血事件的发生情况。

