运动经FoxO1-脂噬通路缓解ApoE-/-小鼠高脂血症的研究
花卫成,付鹏宇,张缨,王林佳,倪震,龚丽景*
(1.北京体育大学运动与体质健康教育部重点实验室,北京 100084;2.北京体育大学运动人体科学学院,北京 100084;3.西北工业大学体育部,西安 710072)
高脂血症(hyperlipidemia,HL)是一种发病率逐年升高的全球性慢性疾病,参与动脉粥样硬化、II型糖尿病和非酒精性脂肪肝等疾病的发生发展,临床特征表现为血液中脂质和脂蛋白含量升高[1-2]。富甘油三酯的脂蛋白(TG-rich lipoproteins,TGRLs)负责将血液中的甘油三酯和胆固醇转运到血浆和其他组织,而载脂蛋白E(apolipoprotein E,ApoE)是TGRLs的重要组成部分[3]。ApoE与脂质形成脂蛋白复合体来转运脂质,并且可以作为细胞表面脂蛋白受体的配体,介导脂质转运至组织细胞,ApoE缺乏会导致血液中TGRLs转运受阻,是诱发HL的关键因素[4]。ApoE基因缺陷(ApoE-/-)小鼠3月龄左右自发产生高脂血症,而高脂饮食会进一步加重病情,是构建高脂血症的常用模型[5]。
脂肪组织是调节能量代谢和糖脂代谢的中心[6]。发生在脂肪细胞中的选择性自噬——脂噬,是一种新近发现的可以选择性识别脂质并将其降解的调节脂代谢稳态的生理过程。该过程能够选择性地动员脂滴中的脂质,经历启动和成核、自噬体的形成、自噬体与溶酶体融合和自噬溶酶体降解的步骤调节脂质代谢[7]。在自噬启动阶段,肌球蛋白样Bcl-2结合蛋白(coiled-coil myosin-like BCL2-interacting protein 1,Beclin1)发挥重要作用[8];选择性自噬接头蛋白1(sequestosome 1,SQSTM1/p62)能将微管相关蛋白1轻链3(microtublue-associated protein 1 light chain 3,LC3)招募到脂滴上,促进自噬体形成[9];LC3被自噬相关蛋白7(autophagy related protein 7,Atg7)脂化,形成LC3Ⅱ,从而闭合自噬体[10];在晚期自噬体的物质运输以及溶酶体的生物发生过程,Ras相关蛋白7(ras-related GTP-binding protein 7,Rab7)参与其中,并促进溶酶体和自噬体相互作用[7]。自噬上游的磷酸肌醇3激酶/蛋白激酶B/叉头样转录因子O1(phospoinositide 3 kinase/protein kinase B/forkhead box of transcription factors O1,PI3K/Akt/FoxO1)信号通路是其重要调控通路。在脂肪组织中大量表达的FoxO1,属于Fox转录因子家族成员之一,是许多自噬基因(如Beclin1和LC3)的重要调控因子[11],能促进自噬相关基因的转录,形成FoxO1-脂噬通路。经磷酸化修饰的FoxO1会与细胞核中的14-3-3蛋白结合并移出细胞核,降低其转录活性,使自噬水平下调[12]。PI3K的激活会导致Akt磷酸化,并使下游的FoxO1磷酸化[13]。
规律的运动训练具有降低血脂的功效已得到广泛证实[14]。中等强度持续运动(moderate intensity continuous training,MICT)和高强度间歇运动(high-intensity intermittent training,HIIT)是目前在大众体育中广泛采用的两种健身方式[15-16]。脂代谢受到脂肪组织自噬水平的影响,FoxO1又是调控自噬的重要转录因子。MICT和HIIT发挥改善高脂血症的作用是否与FoxO1-脂噬途径有关,目前尚未见报道。因此,本研究拟通过对比MICT和HIIT对高脂饮食饲喂的ApoE敲除小鼠脂肪组织FoxO1-脂噬通路相关蛋白表达的影响,探讨运动预防高脂血症的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
10只9周龄雄性SPF级C57BL/6J小鼠,体重(25.17±0.35)g;35只9周龄雄性SPF级C57BL/6J ApoE-/-小鼠,体重(25.32±0.85)g;购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0006】。所有ApoE-/-小鼠均饲喂含21%(w/w)脂肪和1.5%(w/w)胆固醇的高脂饲料(北京科澳协力饲料有限公司,中国);野生型小鼠喂食含4%~5%(w/w)脂肪的标准维持饲料(北京华阜康生物科技有限公司,中国)。所有小鼠饲养于北京体育大学动物实验室【SYXK(京)2016-0033】,温度22℃,湿度50%~70%,昼夜12 h/12 h,可自由进食和饮水,在实验室适应1周后开始正式训练干预。本研究经北京体育大学运动科学实验伦理委员会批准(审批号2019100A)。
1.1.2 主要试剂与仪器
脂肪固定液(G1119,Servicebio,中国),RNA Store样品保存液(DP408,TianGen,中国),血脂检测试剂盒(A111-1-1,A110-1-1,A113-1-1,A112-1-1;南 京 建 成,中 国),定 量PCR相 关 试 剂(MiniBEST Universal RNA Extraction Kit 9767,PrimeScriptTMMaster Mix RR036A,SYBR Premix Ex Taq II RR820A;TaKaRa,日 本),RIPA裂 解 液(P0013B,碧云天,中国),蛋白酶/磷酸酶抑制剂(04693159001,04906837001,Roche,瑞士),BCA试剂盒(PierceTMBCA Protein Assay Kit 23227,Thermo Fisher Scientific,美国),Bolt LDS Sample Buffer(B0007,Novex,美国),Bolt Reducing Agent(B0009,Novex,美 国),MES Running Buffer(B0002,Invitrogen,美 国),4%~12% Bis-Tris梯 度 胶(NW04125,Invitrogen,美国),iBlot 2 NC Regular Stacks(IB23001,Invitrogen,美 国),PI3K抗 体(Proteintech,21890-1-AP),Akt抗体(Abcam,ab8805),Phospho-Akt抗体(Cell Signaling Tech,4060),FoxO1抗体(Abcam,ab52857),Phospho-FoxO1抗 体(Abcam,ab131339),Beclin1抗 体(Abcam,ab207612),Atg7抗体(Abcam,ab133528),LC3抗 体(Proteintech,14600-1-AP),p62抗 体(Abcam,ab109012),Rab7抗体(Abcam,ab137029),α-Tubulin(Proteintech,66031-1-IG),Goat anti-Rabbit抗体(LI-COR,926-68071),Goat anti-Mouse抗体(LI-COR 926-32210)。
动物跑台(LF8710MAP,Panlab,美国),酶标仪(BioTek Synergy H1,Bio Tek,美国),显微图象分析系统(DMI4000B,Leica,德国),超微量分光光度计(Nanodrop 2000c,Thermo Fisher Scientific,美国),实时荧光定量PCR仪(ABI 7500,Thermo Fisher Scientific,美国),蛋白转印仪(iBlot 2,Thermo Fisher Scientific,美国),双色红外荧光成像系统(Odyssey CLX,LI-COR,美国)。
1.2 方法
1.2.1 动物分组及实验干预
10只C57BL/6J小鼠作为野生对照组(WT组)。5只ApoE-/-小鼠用于最大速度测试以制定训练方案,其余30只ApoE-/-小鼠随机分为3组:ApoE-/-安静对照组(CON组)、ApoE-/-中强度持续运动组(MICT组)和ApoE-/-高强度间歇运动组(HIIT组)。每组10只。
训练开始前用5只ApoE-/-小鼠进行最大速度测试,根据测试结果制定训练方案。测试方案为8 cm/s速度热身10 min,之后每3 min增加跑速2 cm/s,直到力竭,力竭时的速度为最大速度,力竭判断标准为连续在电网上停留3 s或者电击次数达到100次[16]。最大速度的测试结果为(45±4)cm/s。
HIIT组和MICT组在开始前4 d进行适应性训练(每天在跑步机上跑10 min,速度逐渐增加,分别为10、12、14和16 cm/s。从10周龄开始训练6周,WT组和CON组不运动,MICT组和HIIT组每周一、三、五上午10:00训练。如图1,MICT组在10 min热身(5 cm/s×5 min+10 cm/s×5 min)后进行40 min匀速跑,速度为40%最大跑速(18 cm/s);HIIT组在10 min热身(8 cm/s×5 min+15 cm/s×5 min)后进行四组5×10 s的短跑,间歇20 s,组间休息5 min,速度为100%最大跑速(45 cm/s)[17]。
1.2.2 取材
注:A:MICT组训练方案;B:HIIT组训练方案。图1 MICT组和HIIT组训练计划Note.A.Training program of MICT group.B.Training program of HIIT group.Figure 1 Schematic diagram of training program for MICT group and HIIT group
在训练干预结束48 h后取材,称重,麻醉,心脏穿刺取血,离心取血浆(4℃,3000 rpm,15 min),液氮速冻,-80℃保存。取附睾白色脂肪组织(epididymal WAT,eWAT),分成3份,一份存于固定液中,用于制备石蜡切片;一份存于RNA保存液中,4°C放置1 d后-80°C保存;一份液氮速冻,-80°C保存,用于Western Blot测试。
1.2.3 血液指标测试
按照试剂盒说明书检测血浆甘油三酯、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDLC)含量。
1.2.4 脂肪组织形态学测试
脂肪组织经固定液固定后,常规石蜡包埋、切片,HE染色,显微图像分析系统观察,拍照,Imagepro Plus 6.0软件统计组织细胞横截面积。
1.2.5 脂肪组织mRNA相对含量测试
引物序列由Primerbank(https://pga.mgh.harvard.edu/primerbank/index.html)网站查询获得,见表1,引物由GENEWIZ公司合成。称取80 mg附睾白色脂肪组织,按照试剂盒说明提取总RNA,超微量分光光度计检测总RNA浓度,逆转录操作获取cDNA,进行实时荧光定量PCR扩增。以β-actin作为内参,采用2-△△CT法计算目的基因/内参基因的相对表达量。

表1 引物信息Table 1 Information of primers
1.2.6 脂肪组织蛋白相对含量测试
称取80 mg附睾白色脂肪组织,加入500 μL RIPA裂解液,组织破碎机破碎细胞,分离出总蛋白,BCA法测定蛋白浓度后制备蛋白样品。SDS-PAGE电泳分离蛋白,用蛋白转印仪将蛋白转印到NC膜上,室温封闭液封闭1 h后孵育一抗(4℃,12 h),TBST洗去未结合的一抗(3×10 min),室温孵育二抗1 h,TBST洗去未结合的二抗(3×10 min),TBS洗涤(2×5 min),滤纸吸干后双色红外荧光成像系统曝光,Image Studio软件进行相对定量分析。抗体信息见1.1.2。
1.3 统计学分析
实验数据采用SPSS 25.0软件分析,所有数据符合正态分布,结果用平均值±标准差()表示。WT组和CON组间采用独立样本t检验,CON组、MICT组和HIIT组间采用单因素方差分析,以P<0.05和P<0.01表示差异具有显著性。
2 结果
2.1 运动降低ApoE-/-小鼠血脂水平
6周干预结束后,WT组小鼠体重为(28.55±1.44)g,CON组 为(30.34±1.50)g,MICT组(30.53±0.36)g,HIIT组为(29.63±0.56)g,各组间无显著性差异。血液指标结果表明,CON组TG、TC和LDL-C均显著高于WT组(P<0.01),MICT组和HIIT组TG和TC水平显著低于CON组(P<0.01),MICT组HDL-C显著高于CON组和HIIT组(P<0.05),见表2。
表2 小鼠血浆TC、TG、HDL-C和LDL-C结果()Table 2 Results of TC,TG,HDL-C and LDL-C in mice plasma()

表2 小鼠血浆TC、TG、HDL-C和LDL-C结果()Table 2 Results of TC,TG,HDL-C and LDL-C in mice plasma()
注:与WT组相比,*P<0.05,**P<0.01;与CON相比,#P<0.05,##P<0.01;与MICT组相比,&P<0.05,&&P<0.01。(下图同)Note.Compared with WT group,*P<0.05,**P<0.01.Compared with CON group,#P<0.05,##P<0.01.Compared with MICT group,&P<0.05,&&P<0.01.(The same in the following figures)
组别Groups甘油三酯(mmol/L)TG(mmol/L)胆固醇(mmol/L)TC(mmol/L)高密度脂蛋白胆固醇(mmol/L)HDL-C(mmol/L)低密度脂蛋白胆固醇(mmol/L)LDL-C(mmol/L)WT组WT group 0.53±0.03 4.95±0.16 2.88±0.28 0.46±0.16 CON组CON group 7.52±1.48** 32.48±4.14** 2.93±1.11# 7.98±1.57**MICT组MICT group 5.32±0.45## 25.00±1.36## 4.76±2.01# 7.30±2.25 HIIT组HIIT group 5.83±0.68## 24.15±3.07## 3.01±0.97& 7.33±1.30
2.2 ApoE-/-小鼠脂肪细胞横截面积减小
6周干预结束后,各组小鼠eWAT脂肪细胞HE染色图片如图2A所示。野生型小鼠脂肪细胞横截面积明显大于ApoE-/-小鼠。CON组脂肪细胞横截面积(1631.08±375.96)μm2与WT组(2847.48±556.59)μm2相比显著降低(P<0.05),MICT组(1789.69±451.40)μm2和HIIT组(1872.79±402.86)μm2与CON组相比无显著性差异,见图2B。

图2 MICT和HIIT对小鼠附睾脂肪组织细胞横截面积的影响Figure 2 Effects of MICT and HIIT on adipocyte cross-sectional area of eWAT in mice
2.3 运动下调ApoE-/-小鼠脂肪组织FoxO1-自噬相关基因的mRNA表达
6周干预结束后,各组小鼠eWAT实时荧光定量PCR结果如图3所示。CON组较WT组FoxO1、Beclin1、LC3、Atg7和Rab7 mRNA相对表达水平显著升高(P<0.01)。MICT组和HIIT组FoxO1、Beclin1、LC3、Atg7和Rab7 mRNA相对表达水平较CON组显著下降(P<0.05)或(P<0.01)。HIIT组Beclin1 mRNA相对表达水平较MICT组显著升高(P<0.05)。

图3 MICT和HIIT对小鼠附睾脂肪组织FoxO1-自噬相关基因mRNA表达的影响Figure 3 Effects of MICT and HIIT on mRNA relative expression levels of FoxO1-Autophagy-associated proteins from eWAT in mice
2.4 运动激活ApoE-/-小鼠脂肪组织PI3K/Akt/FoxO1通路并促进自噬
6周干预结束后,CON组较WT组PI3K、p-Akt和p-FoxO1蛋白相对表达水平显著下降(P<0.01),p-Akt/Akt和p-FoxO1/FoxO1显著下降(P<0.01);MICT组和HIIT组较CON组PI3K、p-Akt水平以及p-Akt/Akt和p-FoxO1/FoxO1显著上升(P<0.01),Foxo1水平显著下降(P<0.01);HIIT组较CON组Akt水平显著下降(P<0.01),较MICT组PI3K、Akt、p-Akt、FoxO1和p-FoxO1蛋白相对表达水平显著下降(P<0.01)或(P<0.05),p-Akt/Akt比值显著上升(P<0.05),见图4A,4B。
自噬相关蛋白表达情况如图4C,4D所示,CON组较WT组Beclin1、Atg7、LC3Ⅱ/Ⅰ和Rab7显著上升(P<0.01),p62水平显著下降(P<0.05);MICT组和HIIT组较CON组Beclin1、Atg7、LC3Ⅱ/Ⅰ和Rab7水平显著下降(P<0.01),MICT组和HIIT组较CON组p62水平显著上升(P<0.01)或(P<0.05);HIIT组较MICT组Beclin1、Atg7、LC3Ⅱ/Ⅰ和Rab7水平显著下降(P<0.01)或(P<0.05)。
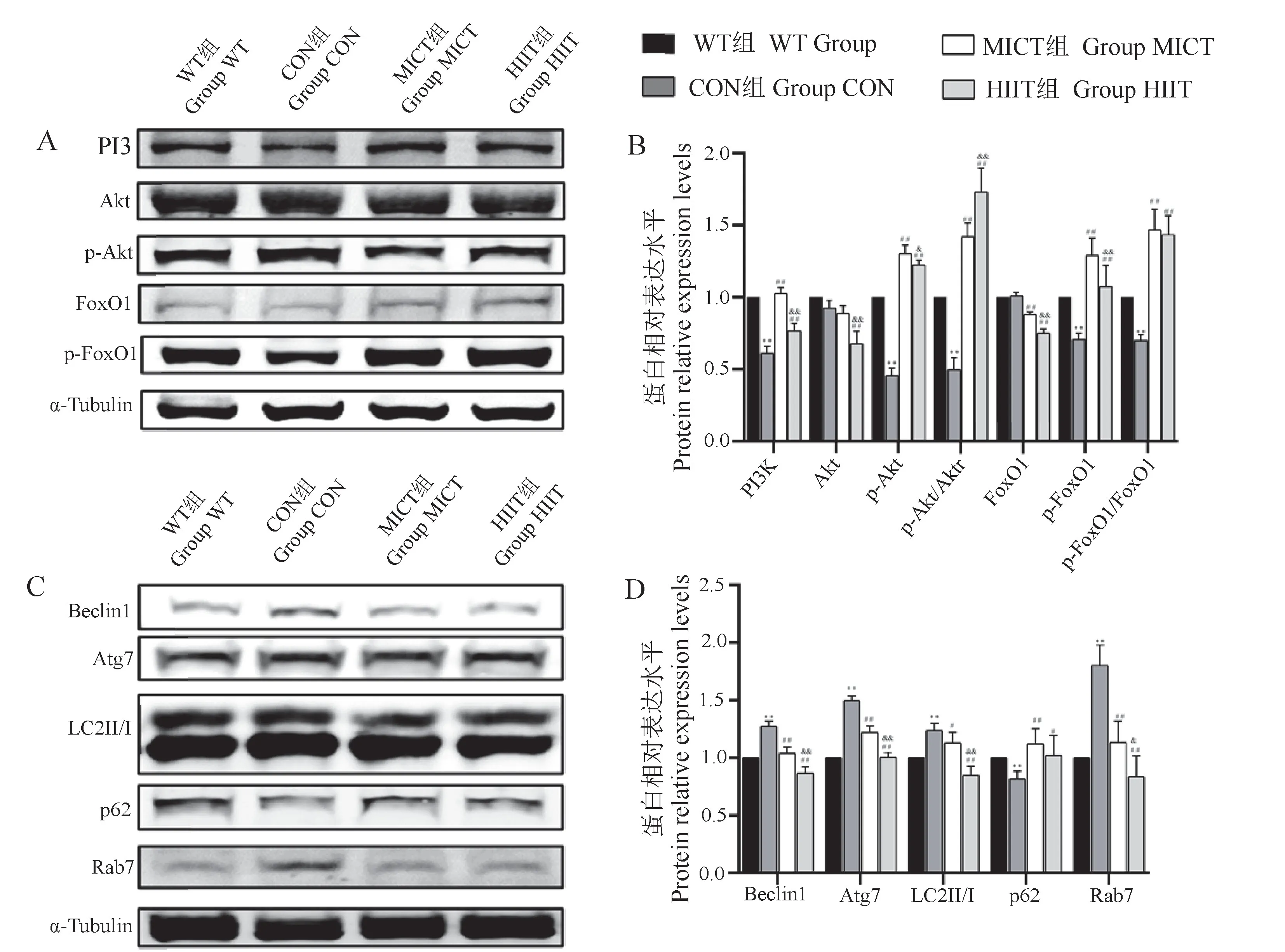
图4 MICT和HIIT对小鼠附睾脂肪组织蛋白相对表达水平的影响Figure 4 Effects of MICT and HIIT on protein relative expression levels of eWAT in WT mice and ApoE-/-mice
3 讨论
ApoE-/-小鼠会从3~4月龄开始自发产生高脂血症和动脉粥样硬化,高脂肪饮食会进一步加剧和加速病情[18]。本研究中10周龄ApoE-/-小鼠在饲喂高脂饲料6周后脂肪细胞横截面积变小,同时血浆TG、TC和LDL-C水平升高,这是由于ApoE-/-小鼠血液中脂蛋白,如乳糜微粒(chylomicrons,CM)和极低密度脂蛋白(very low density lipoproteins,VLDL)转运受阻,难以运输到脂肪组织积累所致[19]。
此外脂肪组织分解增加也会使ApoE-/-小鼠血脂升高[20-21],而脂噬过程可通过自噬溶酶体途径对脂肪组织中的脂滴进行选择性降解[22]。ApoE-/-小鼠脂肪组织处于炎症浸润状态,诱发机体慢性炎性状态[23],白细胞介素-6(interleukin,IL-6)等炎症因子的表达会激活信号传导与转录激活因子(signal transducer and activator of transcription 3,STAT3),进而上调FoxO1的表达[24],FoxO1是介导自噬的关键核转录因子[25]。此外ApoE缺失时PI3K/Akt信号通路受到抑制[26],进而降低FoxO1磷酸化水平。本研究ApoE-/-小鼠脂肪组织中p-FoxO1/FoxO1比值下降,说明细胞核中FoxO1比例增加,发挥转录作用,导致下游自噬相关基因表达上调,诱导ApoE-/-小鼠脂肪细胞面积减小,血脂水平显著上升,形成高脂血症[27]。
MICT是运动强度低、训练时间长的有氧运动,其对有高脂血症和动脉粥样硬化倾向的ApoE-/-小鼠有预防作用。研究发现,规律的跑台或游泳训练能够降低ApoE-/-小鼠血脂[28],减轻内质网应激介导的内皮功能障碍[29],缓解肝细胞胰岛素抵抗和非酒精性脂肪性肝病等症状[30]。而HIIT的特点是在短时间的高强度运动中穿插低强度运动或休息,以减少训练时间并提供较大的生理刺激,已被证明有良好的减脂效果[31]。但HIIT运动对ApoE-/-小鼠的影响研究不多见。本研究结果显示HIIT对ApoE-/-小鼠血脂有改善作用,降低了血浆TG和TC含量,与MICT结果一致;此外,MICT还提高血浆HDL-C含量。两种运动使小鼠脂肪组织细胞横截面积有所增大,提示运动可促使血脂进入脂肪组织细胞储存,并降低ApoE-/-小鼠脂肪组织细胞脂解作用[21]。
ApoE基因缺失也是引起II型糖尿病的原因之一,II型糖尿病会导致脂肪组织PI3K/Akt信号通路出现损伤,而运动可以上调PI3K/Akt信号通路,改善糖尿病大鼠糖脂代谢[32-33]。虽然运动对脂噬的影响报道较少,但外源刺激如针刺可促进PI3K和p-Akt表达,降低海马自噬水平[34]。Akt磷酸化激活后可进一步磷酸化FoxO1的丝氨酸256位点(S256)并降低FoxO1结合目标DNA的能力[35]。本研究中,MICT和HIIT均可上调ApoE-/-小鼠脂肪组织中PI3K的表达,促进Akt磷酸化,增加FoxO1磷酸化水平和p-FoxO1/FoxO1比值,以抑制自噬相关基因和蛋白的表达[35]。Beclin1是Ⅲ类磷脂酰肌醇3-激酶(class III phosphatidylinositol 3-kinase,PI3KⅢ)复合物的组成部分,在自噬启动阶段调节自噬相关蛋白如LC3的分布,而Beclin1和LC3又受到FoxO1的直接调控[36]。本研究中,小鼠MICT和HIIT后脂肪组织中Beclin1、Atg7和Rab7 mRNA和蛋白表达水平下降,LC3 mRNA表达水平及LC3Ⅱ/Ⅰ比值下降,说明本研究的运动方式抑制了脂肪组织自噬。随着自噬水平下调,包含Atg7、LC3以及其他自噬相关蛋白表达的减少,延缓了自噬体膜的延伸;Rab7随着自噬体形成附着在自噬体表面,介导自噬体与溶酶体结合形成成熟的自噬溶酶体,其含量的减少可能影响脂肪组织中自噬溶酶体的成熟[37-38];接头蛋白p62在脂噬中负责将LC3招募到脂滴上,并随着待降解物质进入自噬溶酶体,随着自噬溶酶体的降解而降解[39],本研究两种运动后脂肪组织p62蛋白表达水平上升,也说明了脂噬水平的下调[40]。上述结果提示两种运动方式皆可通过促进FoxO1磷酸化以抑制ApoE-/-小鼠脂肪组织自噬,促进脂肪细胞代谢,降低血浆中TG和TC含量,改善高血脂症状。
综上所述,ApoE基因缺失所致的高脂血症可激活脂噬水平;6周HIIT和MICT均可通过激活ApoE-/-小鼠脂肪组织PI3K/Akt通路,促进FoxO1磷酸化,抑制脂噬,降低血脂水平,缓解高脂血症。

