蜂王浆中超氧化物歧化酶的活性测定与应用
杨焱,胡九菊,李林霖,赵勋能,张健*
(1.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;2.北京金王健康科技有限公司,北京 100269)
蜂王浆(royal jelly)又名蜂皇浆、王浆,是由青年工蜂发达的下咽头腺和上颚腺等腺体共同分泌的乳白色或淡黄色浆状物,具有抗衰老、抗菌、抗疲劳、抗炎、抗氧化、抗肿瘤、抗糖尿病和抗突变等多种生理功能[1-2]。蜂王浆的质量和生理功能由其成分决定,但蜂王浆成分复杂,且易受季节、产地、蜜源、蜂种和贮存条件等影响[3],很难明确其成分与质量或生理功能之间的相关性。尽管如此,人们发现新鲜蜂王浆的生理功能远高于贮存后的蜂王浆,且贮存时间越久,生理功能越低。可见蜂王浆极易变质,其品质和生理功效易受贮存条件的影响,若贮存条件不当,则蜂王浆的物理性状、化学组成和生理功效均会发生显著变化。
为有效地评价蜂王浆的质量,从而建立蜂王浆的分级和定价标准,以及改良销售、流通各环节的贮存方法,科研人员进行了大量试验,试图找到一些有价值的蜂王浆新鲜度评价指标,已报道的指标包括色度[4]、糠氨酸[5]、糠醛[6]、游离氨基酸[7]、57 ku 蛋白[8]和三磷酸腺苷(adenosine triphosphate,ATP)及其降解产物[9-10]、酶类物质(超氧化物歧化酶、葡萄糖氧化酶)[3,11]等,然而受各种因素的制约,目前仍没有一种蜂王浆新鲜度评价指标被世界公认。
超氧化物歧化酶(superoxide dismutase,SOD)是一种能直接地、特异性地猝灭超氧化自由基的抗氧化酶,能显著降低超氧阴离子对细胞的毒性作用,具有抗衰老、抗肿瘤和抗辐射等生理功能。袁耀东等[12]研究表明了蜂王浆中含有0.403 ng/g的SOD;庞红金[11]、张映等[13]、张娟等[14]和唐朝忠等[15]分别研究了不同贮存温度和时间条件下蜂王浆中SOD活性的变化,发现反复冷冻、解冻对蜂王浆SOD活性影响很大;蜂王浆中SOD活性随贮存时间的延长而降低,且贮存温度越高失活速度越快。在-18℃下贮存一个月,蜂王浆中SOD活性基本稳定;在4℃下贮存10 d,SOD活性略有下降,但变化亦不显著;在25℃下贮存10 d后SOD活性消失。
上述报道中,除张娟等[14]采用黄嘌呤氧化酶法测定SOD活性,其他研究均采用邻苯三酚自氧化法测定SOD活性。相比而言,黄嘌呤氧化酶法具有更好的灵敏度,检测更为快速,干扰更少,更适合用于科研和仲裁[16]。蜂王浆成分复杂,基质干扰对SOD活性的测定影响很大,必须对蜂王浆预处理除去干扰物,才能保证SOD测定结果的准确,而现有的文献在测定SOD时对蜂王浆的预处理却鲜有报道。
本试验采用黄嘌呤氧化酶法测定蜂王浆中SOD活性,优化了蜂王浆的预处理方法,测定了蜂王浆在不同贮存时间和温度下SOD活性变化,以及不同生产工艺和蜜源对SOD活性的影响,评价了SOD活性作为新鲜度指标的可行性。
1 材料与方法
1.1 材料与试剂
蜂王浆:北京金王健康科技有限公司。试验中所使用蜂王浆包括以下几种:粗品蜂王浆为采集后直接罐装,含有杂质的待加工原材料,包含以荆花、椴树花、槐花为蜜源的新鲜蜂王浆;纯品蜂王浆为以槐花为蜜源的新鲜蜂王浆,根据不同的加工方法,分为正常工艺(普通)、全链条低温保存及速冻工艺(速冻)和过度加工(加工)3种。
总超氧化物歧化酶(total superoxide dismutase,TSOD)测试盒(羟胺法):南京建成生物工程研究所;冰乙酸(分析纯):天津市永大化学试剂公司;氯化钠(分析纯):天津市北方天医试剂公司。
1.2 仪器与设备
XMTD-204数显式电热恒温水浴锅:上海博迅实业有限公司医疗设备厂;UV-3100型紫外可见分光光度计:上海美谱达仪器有限公司;H1650R台式高速冷冻离心机:湖南湘仪动力测试仪器有限公司;QL-902涡旋振荡仪:海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 SOD粗提液的制备
将蜂王浆从-18℃冰箱中取出,于4℃下解冻2 h,无冰碴即可用于后续试验。以将蜂王浆3倍稀释为例,首先在EP管内加入生理盐水2 mL,缓慢加入蜂王浆,直至液面涨至3 mL,加入玻璃珠后,置于涡旋振荡仪上涡旋混匀。离心取上清液在同样条件下再次离心,上清液即为SOD粗提液。
1.3.2 酶活测定
本试验使用T-SOD测试盒检测酶活,试剂盒采用黄嘌呤氧化酶法(羟胺法)测定SOD活性,具体测定方法参照南京建成总超氧化物歧化酶(T-SOD)测试盒说明书进行。通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基(O2-·),后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用紫外可见分光光度计测其吸光度[16]。因酶的百分抑制率与酶的活力呈抛物线关系,故在确定稀释倍数时,应取百分抑制率在45%~55%的样本浓度作为最佳取样浓度。通过公式(1)可计算出吸光度抑制率,根据抑制率通过公式(2)计算可求出被测样品中的SOD活性。

式中:R1为氧化抑制率,%;A0为对照管吸光度;A1为对照管吸光度。

式中:U1为总 SOD 活性,U/mL;R1为氧化抑制率,%;V1为反应液总体积,mL;V2为测定样品体积,mL;n为样品测试前的稀释倍数。
1.3.3 单因素试验设计
以粗品槐花蜂王浆为原料,优化的因素包括研磨时间、稀释倍数、稀释液成分、离心次数、离心转速。根据预试验的结果,以在4℃下,使用蒸馏水对样品进行2倍稀释,研磨时间控制在20 s,以6 000 r/min进行1次离心,单次离心时间20 min,作为基础反应条件。单一改变基础反应条件中的变量,分别测定研磨时间为 0、10、20、60 s时;稀释倍数为 2、3、4、5 倍时;稀释液为蒸馏水、生理盐水时;转速为6 000 r/min,离心1次或2次时;离心1次,转速为6 000 r/min或12 000 r/min时,蜂王浆样品粗提液SOD的活性。每个水平测定3次取平均值,每个因素均以酶活力最高的水平为100%计,其它水平实际酶活与最高水平实际酶活的比值的百分数即为该水平下的相对酶活力,以相对酶活力反映试验效果。
1.3.4 不同温度和存放时间对蜂王浆SOD活性的影响
以粗品和纯品的槐花蜂王浆为原料,其中纯品槐花蜂王浆以正常工艺制备。采用优化后的预处理方法提取蜂王浆中SOD,黄嘌呤氧化酶法测定SOD活性。分别考察新鲜蜂王浆在4℃和25℃下不同贮存时间的SOD相对酶活力,每2 d测定一次,以每个因素中酶活力最高者为100%计。
1.3.5 不同蜜源对蜂王浆SOD活性的影响
采用优化后的预处理方法提取蜂王浆中SOD,黄嘌呤氧化酶法测定SOD活性。测定荆花、椴树花、槐花蜜源的新鲜粗品蜂王浆中的SOD相对活性,以活性最高者为100%计。
1.3.6 蜂王浆不同生产工艺对蜂王浆SOD酶活力的影响
采用优化后的预处理方法提取蜂王浆中SOD,黄嘌呤氧化酶法测定SOD活性。考察不同生产工艺的纯品槐花蜂王浆中SOD活性,以酶活力最高者为100%。
1.3.7 统计方法
每组数据均平行3次,采用Origin 2018进行绘图;差异的显著性通过采用Graphpad Prism 8.0.1中单因素方差分析(one-way ANOVA)进行数据分析,结果用平均值±标准差表示。
2 结果与分析
2.1 研磨时间对SOD活性的影响
观察发现粗品槐花蜂王浆样品中含有结晶状颗粒物,为使其完全溶解,提高SOD提取收率,采用研钵对其进行研磨,考察研磨时间对SOD活性的影响,结果见图1。

图1 研磨时间对SOD活性的影响Fig.1 Effect of grinding time on SOD enzyme activity
由图1可知,60 s内研磨时间对酶活性无明显影响。王粉琴等[17]认为蜂王浆中结晶状颗粒物为10-羟基-2-癸烯酸晶体,它是王浆中很重要的一种脂肪酸,析出程度随蜂王浆新鲜度以及品质的不同而变化。既然该物质不影响SOD测定,此步骤可以省略。
2.2 样品稀释倍数以及稀释液对SOD活性的影响
粗品槐花蜂王浆样品浓稠且黏度较高,为取抑制率在45%~55%的样本浓度作为最佳取样浓度,故对样品梯度稀释;考虑到蛋白质的盐溶作用,故比较生理盐水与蒸馏水作为稀释剂的效果,以提高SOD提取收率,考察样品不同稀释液和稀释倍数下的抑制率,结果见图2和图3。

图2 不同稀释液和稀释倍数对抑制率的影响Fig.2 Effects of different diluents and dilution times on inhibition rates
使用生理盐水和蒸馏水3倍稀释后抑制率可分别达46.78%和47.84%,与庞红金[11]、唐朝忠等[15]试验结果相似,由图2可知,生理盐水作为稀释剂效果更好。其原因可能是盐溶作用促进SOD在水中的溶解,或与酶活性中心的金属离子发生拮抗作用[18],由图3可知,对3倍稀释样品SOD相对酶活力计算,在测定新鲜蜂王浆SOD活性时采用生理盐水3倍稀释最佳。

图3 稀释3倍样品中SOD相对活性Fig.3 Relative activity of SOD in samples diluted 3 times
2.3 离心对测定SOD活性的影响
在预试验中,发现离心后上清液中可能有干扰酶活测定的颗粒物质,故尝试提高离心转速或增加离心次数以除去干扰物质,测定转速或离心次数对SOD活性的影响,结果分别见图4a和图4b。

图4 离心对测定SOD活性的影响Fig.4 Effect of centrifugation on the determination of SOD activity
由图4a可知,12 000 r/min离心后SOD相对酶活力降低,可能是因为SOD离心损失所致,于是仍然维持原有6 000 r/min的转速,将离心后的上清液在相同条件下重复离心1次,测定离心次数对SOD活性的影响。由图4b可知,离心1次相对酶活力仅为88.14%,离心2次相对酶活力明显提高,说明该条件下检测灵敏度更高,故在后续试验中将蜂王浆在6 000 r/min下离心2次后测定酶活。
2.4 不同温度下存放时间对蜂王浆SOD活性的影响
酶是生物活性物质,不同贮存条件会影响其活性,本试验探究蜂王浆在不同温度下贮存不同时间后SOD活性的变化,结果见图5a和图5b。

图5 存放时间对蜂王浆SOD活性的影响Fig.5 Effect of storage time on SOD activity of royal jelly
由图5 a和图5 b可知,不同蜂王浆随着贮存时间的延长,SOD的活性逐步降低,且纯品蜂王浆中SOD的相对酶活比粗品中失活更快。在4℃下贮存时,贮存时间8 d时,纯品槐花蜂王浆中SOD的相对酶活力接近于0%;在25℃下贮存时,相对酶活力在2 d内急剧下降;贮存时间4 d时,纯品槐花蜂王浆中SOD的相对酶活接近于0%。有报道蜂王浆中SOD活性随贮存时间的延长而下降,且贮存温度越高失活越快[11,13,15,19-20]。与本试验结果相似。
2.5 不同蜜源对蜂王浆SOD活性的影响
蜂王浆中的多种生物活性成分大部分来源于蜜蜂食物中的蛋白质,因此,王浆的质量和生物活性成分受蜜源的影响非常显著[21]。考察不同蜜源对SOD活性的影响,结果见图6。
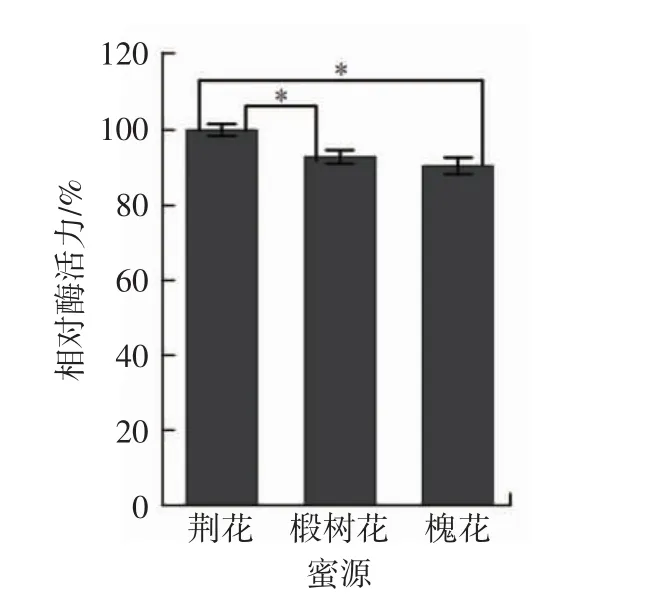
图6 不同蜜源对蜂王浆SOD活性的影响Fig.6 Effect of different honey plant on the SOD enzyme activity of royal jelly
由图6可知,饲喂荆花蜜蜂所产蜂王浆SOD活性最高,与其它蜜源蜂王浆SOD活性有显著差异(P≤0.05),而饲喂椴树花或槐花蜜蜂所产蜂王浆中SOD活性无明显差异。由于本研究蜂王浆均为北京金王健康科技有限公司提供,样品有限且产地单一,在后续研究中将进一步扩大蜂王浆样品产地范围和数量,以排除其它潜在因素对SOD活性的影响。
2.6 不同生产工艺对蜂王浆SOD活性的影响
鲜蜂王浆容易受外界光、热等因素的影响[22],因此加工生产工艺会对SOD活性产生较大影响。对正常工艺(普通)、全链条低温保存及速冻工艺(速冻)和过度加工(加工)3种工艺条件下生产的纯品槐花蜂王浆中SOD活性进行检测,结果见图7。

图7 不同生产工艺对蜂王浆SOD活性的影响Fig.7 Effect of different production processes on the SOD enzyme activity of royal jelly
由图7可知,速冻工艺与正常工艺生产的蜂王浆中SOD活性有显著差异(p≤0.01),与过度加工工艺生产的蜂王浆中SOD活性有高度显著差异(p≤0.01),而正常工艺和过度加工工艺生产的蜂王浆中SOD活性无明显差异,使用速冻工艺生产的蜂王浆中SOD活性最高。这说明蜂王浆中SOD在加工过程中易失活,而冷冻可以抑制其失活,如果条件允许,采浆后迅速冷冻可以有效保持蜂王浆中SOD活性。
3 结论与讨论
本试验优化了黄嘌呤氧化酶法(羟胺法)检测蜂王浆中SOD活性时的预处理方法,为使用生理盐水对样品进行3倍稀释,4℃下以6 000 r/min对样品2次离心,单次离心20 min。采用该方法,测定蜂王浆在不同贮存时间和温度下SOD活性变化,随着贮存时间的增长,贮存温度的上升,蜂王浆中SOD活性有非常明显的降低。速冻生产工艺能最大程度保持蜂王浆中SOD活性,荆花蜜源的蜂王浆SOD活性最高。
本试验首次优化了蜂王浆样品的预处理方法,提高了试剂盒法检测蜂王浆SOD活性的灵敏度,这对于准确检测SOD活性至关重要。采用本研究优化的方法,验证了前人的研究成果,证明SOD在蜂王浆贮存过程中极易失活;加工方法和蜜源会影响蜂王浆中SOD活性。事实上,其它诸如蜂王浆产地和蜂种等因素也会影响蜂王浆中的SOD活性,这将在以后继续研究。蜂王浆在25℃下贮存6 d后SOD已经基本失活,但据文献报道[23-25],很多生理功能在如此短的贮存时间内并未失活,因此,SOD指标只适合在其完全失活前评价同种蜂王浆新鲜度。

