热带红睡莲精油主要成分及其抑菌活性分析
陈彦甫,范杨杨,周卫娟,李子馨,李兆基,王健,赵莹*,罗海希
(1.海南大学林学院,热带特色林木花卉遗传与种质创新教育部重点实验室,海南省热带特色花木资源生物学重点实验室,海南 海口 570228;2.海南科技职业大学海南省药食同源植物资源重点实验室,海南 海口 571126)
热带睡莲是睡莲科(Nymphaeaceae)睡莲属(Nymphaea)植物中广泛分布于热带地区的类群的统称,是多年生草本水生花卉。由于其花色艳丽、丰富,具有很高的观赏价值,同时睡莲的根具有净化水体的作用,热带睡莲逐渐成为园林设计中重要的水生植物[1]。近年来研究发现睡莲属植物富含黄酮、酚酸等多种活性成分,具有抗氧化、抗菌、抗辐射、降血糖等多种生物活性[2-3]。热带睡莲的花和叶制成的食品及护肤品深受大众喜爱[3-4]。Zhang等[5]通过系统基因组学分析证实了热带睡莲是所有现存被子植物中的基部类群,是被子植物中最古老的分支之一。
热带红睡莲(Nymphaea rubra)因其花期长、品质优良、繁殖能力强,成为热带水景园林设计中异军突起的新优种类。根据范杨杨等[6]的研究发现,其相比于埃及白睡莲(Nympheae lotus)、蓝鸟睡莲(Nymphaea'Blue Bird')等常见热带睡莲品种,热带红睡莲的含水量、可溶性蛋白含量、维生素C含量更为突出,营养价值高,由此可见热带红睡莲在食药工业具有广阔的开发与应用前景。
近年来关于睡莲的研究主要集中于热带睡莲品种的栽培与选育[7]、基因组及形态多样性分析[8-9]、睡莲的生理机制[10-11]、睡莲在吸收重金属离子及净化污水[12]等方向,但睡莲精油的提取工艺研究较少。植物精油在食品、化妆品等行业应用前景广阔,目前研究植物精油的主要提取手段有微波辅助提取、水蒸气蒸馏法、超临界CO2流体萃取、亚临界水萃取等方法,吴晓菊等[13]采用4种提取方法分别提取神香草精油,比较4种方法的精油得率后得知超临界CO2流体萃取法的精油得率要高于水蒸气蒸馏法。同时超临界流体萃取法相比于工艺较简单的水蒸气蒸馏法和微波辅助提取法来说,采用的流体(如CO2)通常无害,有机溶剂残留的风险较少,是目前众多提取方法中较为环保并且精油得率较高的一种提取手段[14-15],近几年关于应用超临界流体技术萃取植物油脂方面的研究也日趋增多。
同时,植物精油抗氧化能力较强[16],近年来研究表明植物提取精油在一定程度上对革兰氏阳性菌、革兰氏阴性菌及真菌具有显著的抑制作用,且抑制作用受温度影响变化较小[17-20],具备一定的紫外稳定性[21]。植物精油还可降低化妆品的刺激性,在化妆品行业中起着极为关键的作用[22]。目前对热带睡莲精油的抑菌能力及抗氧化活性的研究较少,对其进行抑菌活性测定,将为热带睡莲精油在化妆品行业中的应用提供参考。
本研究采用超临界CO2流体萃取法提取热带红睡莲精油,对精油组分进行气相色谱-质谱(gas chromatograph-mass spectrometer,GC-MS)分析,鉴定出热带红睡莲精油内各化合物组分,并对热带红睡莲精油进行抑菌活性测定,探究精油对6种常见菌种的抑制能力,以期为热带红睡莲精油的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
热带红睡莲:印度红睡莲(Nymphaea rubra),海南荣丰花卉有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(CP)、葡萄糖(AR)、柠檬酸钠(Na3C6H5O7·2H2O)(AR):西陇科学股份有限公司;YPD培养基(EA):上海吉至生化有限公司;腺嘌呤(EA):生工生物工程(上海)股份有限公司;青霉素、结晶牛血清蛋白(低内毒素):上海麦克林生化科技有限公司;2,6-二叔丁基对甲基苯酚(butylated hydroxytoluene,BHT)(EA):上海伟寰生物科技有限公司;氯化钠(AR):国药集团化学试剂有限公司;吐温80:海南金唯诺生物科技有限公司;大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、酿酒酵母、黑曲霉(均需4℃低温保藏):海南子约仪器设备有限公司。
1.2 仪器与设备
XMTD-8222电热恒温干燥箱:上海精宏实验设备有限公司;HP6890/5975C GC/MS联用仪:美国安捷伦公司;SPE-EDAFE-2超临界CO2流体萃取仪:美国Applide Separations公司;UV-5500紫外分光光度计:北京普析通用仪器有限公司。
1.3 超临界CO2方法萃取热带红睡莲精油
首先将红睡莲鲜花花瓣在电热恒温干燥箱中45℃下干燥7 h,待其达到恒重时,在粉碎机中进行粉碎,将得到的干粉备用。
参考黄秋伟等[7]的试验方法萃取精油。称取40 g红睡莲干粉,装入1 L的装料罐,将其放入萃取釜中密封。将CO2流速控制在30 L/h,分离釜Ⅰ压力设定为6.0 MPa、分离釜Ⅰ温度设定为30℃;分离釜Ⅱ压力设定为5.8 MPa、分离釜Ⅱ温度设定为25℃,设定好分离条件后,设置萃取压力为30 MPa,萃取温度为35℃,萃取时间2 h,进行动态循环萃取,当萃取结束后,从分离釜中接取得到的物料,使用注射器吸取漂浮于上层的黄色油层进行称重,在-20℃条件下进行冷冻备用,按照下式计算精油得率。
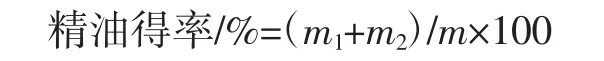
式中:m1为分离釜Ⅰ出口精油质量,g;m2为分离釜Ⅱ出口精油质量,g;m为红睡莲干粉质量,g。
1.4 热带红睡莲精油成分GC-MS分析
1.4.1 固相微萃取
萃取前,取红睡莲精油0.6 g,放入5 mL进样瓶中,使用硅胶垫密封进样瓶。随后,取100 μm聚二甲基硅氧烷固相微萃取手动进样萃取头,250℃预热2 h,由顶部插入样品瓶,28℃萃取80 min。将萃取头向GC-MS汽化室内快速插入,于230℃温度下进行3 min洗脱处理。以离子源(electron ionization,EI)为电离源进行气相色谱-质谱分析。
1.4.2 GC-MS条件
GC条件:使用色谱柱为石英毛细管柱,将流速设定为0.3 L/min、进样量 1 μL、分流比 10∶1;进样温度250℃,四极杆温度150℃。升温程序:在5℃/min速度下升至170℃,在2.5℃/min速度下再升至250℃,到指定温度后维持15 min。
MS条件:选择EI离子源,离子源温度230℃,四极杆温度150℃,接口温度280℃,溶剂延迟5 min,电子能70eV,扫描质量范围29amu~450amu。以Nist 2005质谱鉴定分析总离子流图内各峰的质谱图结果。以峰面积归一化法来计算各成分的相对含量。
1.5 热带红睡莲精油抑菌活性测定
1.5.1 滤纸片法测定抑菌圈直径
取1.3中得到的红睡莲精油1 g,溶解于5 mL DMSO中,得到红睡莲精油溶液。把滤纸片贴于含菌平板上,3片/皿,向各滤纸上滴加精油溶液0.01 mL,同时分别滴加等量吐温80、青霉素,以作参照,将细菌移至培养箱内,37℃培养1 d,将真菌移至培养箱内,28℃培养3 d。每组试验重复5次,每皿使用交叉法测量抑菌圈直径3次,取平均值,分析热带红睡莲精油对各供试菌种的抑菌活性。
1.5.2 红睡莲精油热稳定性检测
将精油分别在 30、40、50、60 ℃水浴 15 min。以大肠杆菌和金黄色葡萄球菌为例,使用上述滤纸片法测定抑菌圈直径,交叉法测量3次,每组试验重复5次,结果取平均值。比较分析热处理对热带红睡莲精油抑菌活性的影响。
1.5.3 红睡莲精油紫外稳定性检测
使用紫外灯照射红睡莲精油溶液,照射时间分别为 10、20、30、40、50、60 min。以 1.5.1 方法测量抑菌圈直径,结果取平均值。比较分析紫外处理对热带红睡莲精油抑菌活性的影响。
1.5.4 红睡莲精油酸碱稳定性检测
使用 NaOH 溶液(1 mol/L)及 HCl溶液(1 mol/L)对固体培养基的pH值进行调节,获得pH值为4、5、6、7、8、9的培养基。以1.5.1方法测量抑菌圈直径,结果取平均值。比较分析不同pH值对热带红睡莲精油抑菌活性的影响。
2 结果与分析
2.1 热带红睡莲精油GC-MS分析
借助GC-MS联用仪对热带红睡莲精油成分展开分析,同时通过峰面积归一法,明确各组分相对含量,图1为总离子流图,分析结果详情如表1所示。
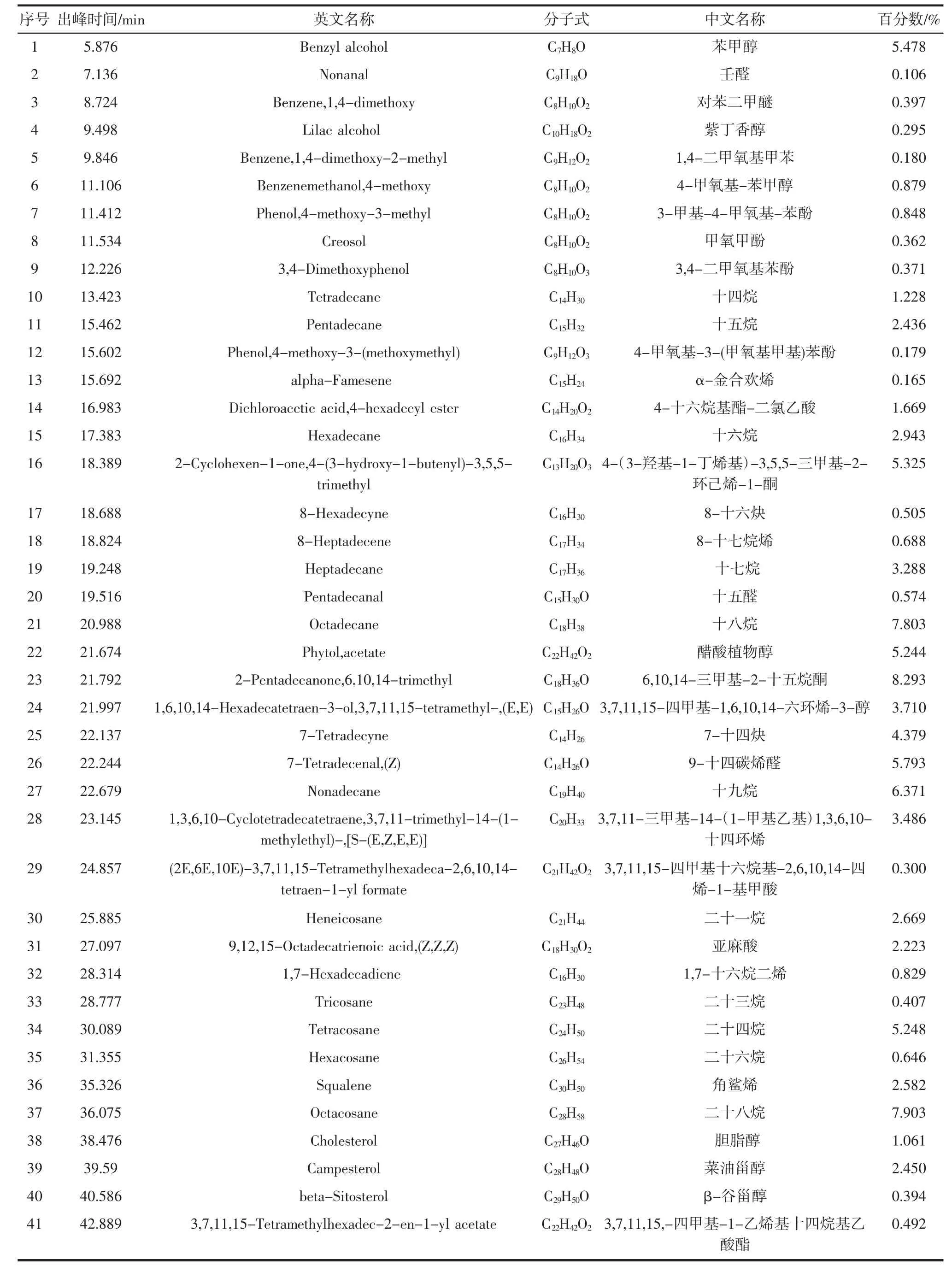
表1 热带红睡莲精油成分Table 1 Essential oils composition of tropical red water lily
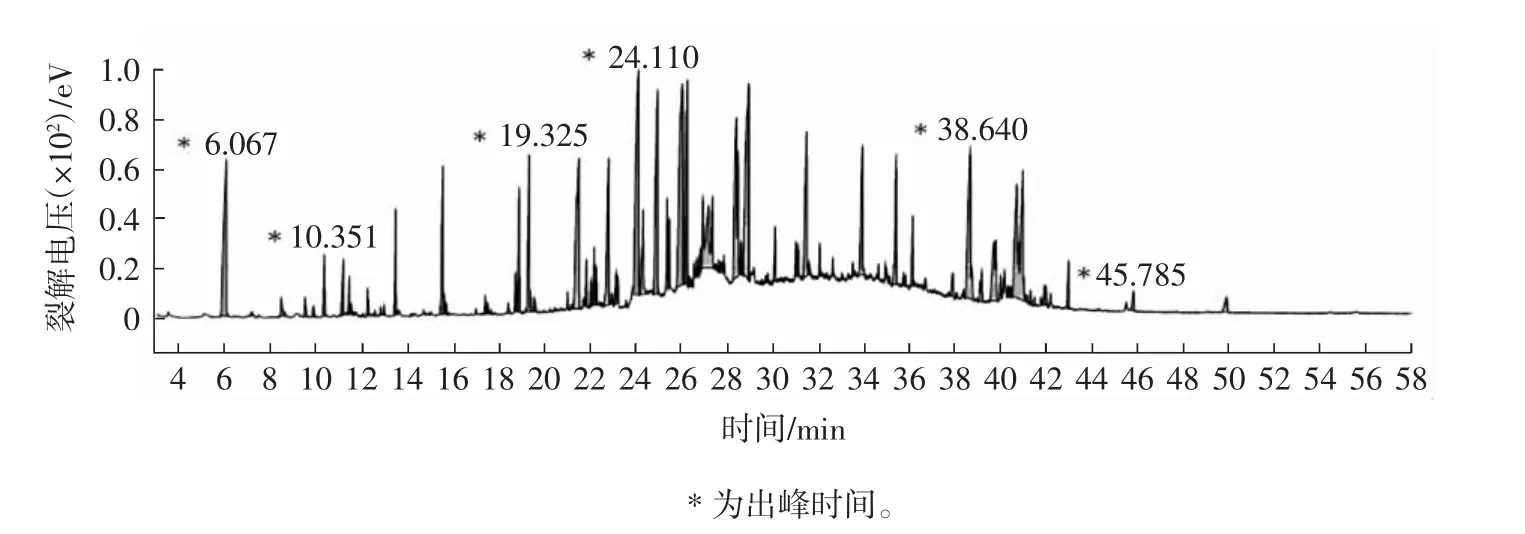
图1 超临界CO2提取热带红睡莲精油总离子流图Fig.1 Supercritical CO2extraction of tropical red water lily essential oil total ion flow diagram
由图1和表1可知,运行至5 min时,开始出峰,然而裂解电压较低,大多处于0.2×102eV~0.8×102eV区间;当进行至24 min~28 min时,裂解电压上升至1.0×102eV。超临界CO2流体萃取出的红睡莲精油含有41种化合物,其中烷烃、烯醛、烷酮、醇类为主要成分。这些成分中含芳香环的有苯甲醇、对苯二甲醚、1,4-二甲氧基甲苯、3,4-二甲氧基苯酚、4-甲氧基-3-(甲氧基甲基)苯酚与甲氧甲酚,但是缺少呈浓香的单萜和倍半萜,表明热带红睡莲精油的芳香度要低于玫瑰精油、薰衣草精油等浓香型植物精油。
2.2 热带红睡莲精油抑菌性分析
2.2.1 抑菌圈测定结果
不同供试菌种的抑菌圈直径见表2。
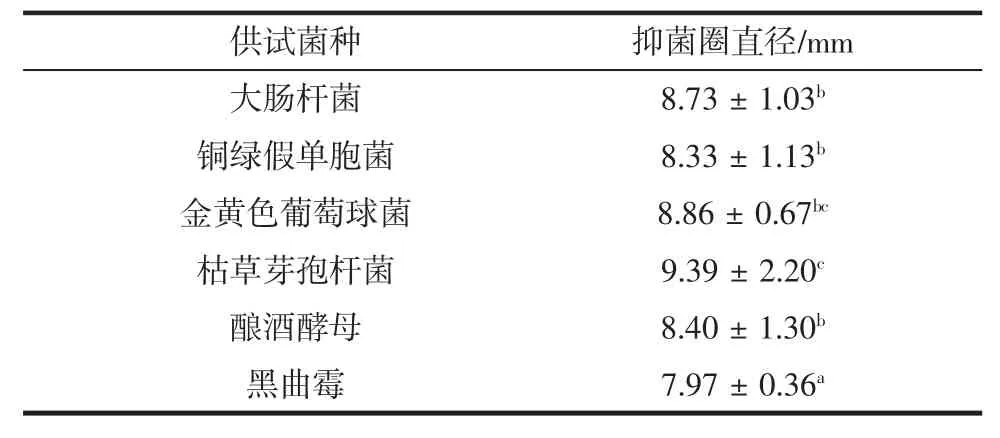
表2 热带红睡莲精油对不同供试菌种的抑菌圈直径Table 2 Diaphragm diameter of tropical red water lily oil for different tested strains
由表2可知,大肠杆菌的抑菌圈直径为8.73 mm,铜绿假单胞菌抑菌圈直径为8.33 mm,金黄色葡萄球菌抑菌圈直径为8.86 mm,枯草芽孢杆菌抑菌圈直径为9.39 mm,酿酒酵母抑菌圈直径为8.40 mm,黑曲霉抑菌圈直径为7.97 mm。热带红睡莲精油对供试菌的抑菌活性由强到弱依次为枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌、酿酒酵母、铜绿假单胞菌、黑曲霉。
2.2.2 热带红睡莲精油热稳定性结果
温度与热带红睡莲精油抑菌活性的关系见表3。
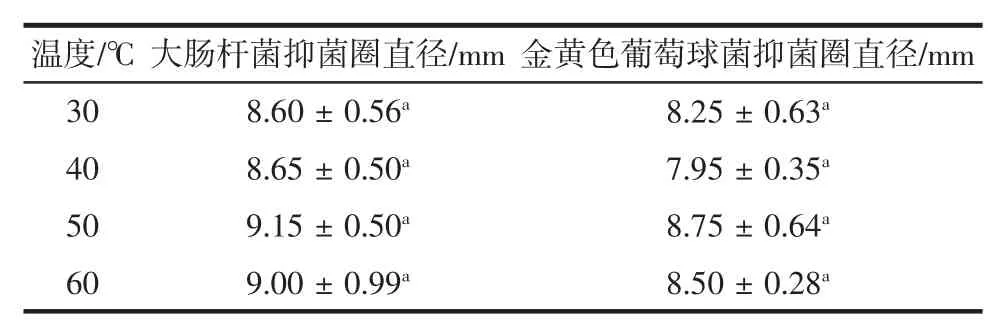
表3 温度与热带红睡莲精油抑菌活性的关系Table 3 Relationship between temperature and antibacterial activity of tropical red water lily oil
通过表3结果发现,经热处理后,热带红睡莲精油抑制大肠杆菌的活性相比金黄色葡萄球菌略强;该精油在温度低于50℃时,对两种菌的抑菌活性随着温度上升而增强,且50℃处理对大肠杆菌和金黄色葡萄球菌具有最佳抑菌活性。总体来看,当处理温度达到50℃以后,精油的抑菌效果均减弱,但依然维持了一定的抑菌效果。
2.2.3 热带红睡莲精油紫外稳定性结果
紫外处理时间与热带红睡莲精油抑菌活性的关系见表4。
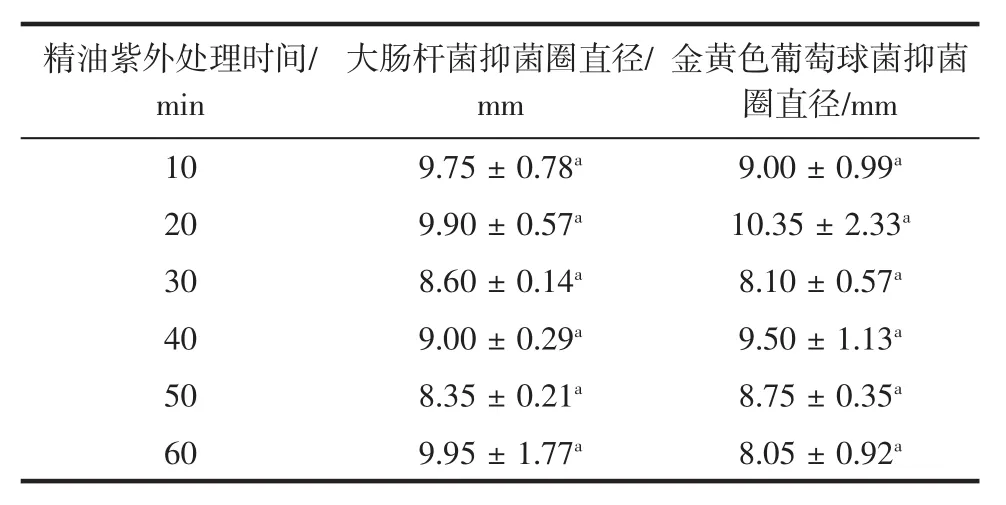
表4 紫外处理时间与热带红睡莲精油抑菌活性的关系Table 4 Relationship between UV treatment time and antibacterial activity of tropical red water lily oil
由表4可知,热带红睡莲精油经过不同时间的紫外照射后,抑菌活性上下波动,且在紫外处理20 min时具有最佳抑菌活性。但各紫外处理时间下,抑菌效果差异不显著(p>0.05),说明热带红睡莲精油具有一定的紫外稳定性。
2.2.4 热带红睡莲精油酸碱稳定性
培养基pH值与热带红睡莲精油抑菌活性的关系见表5。
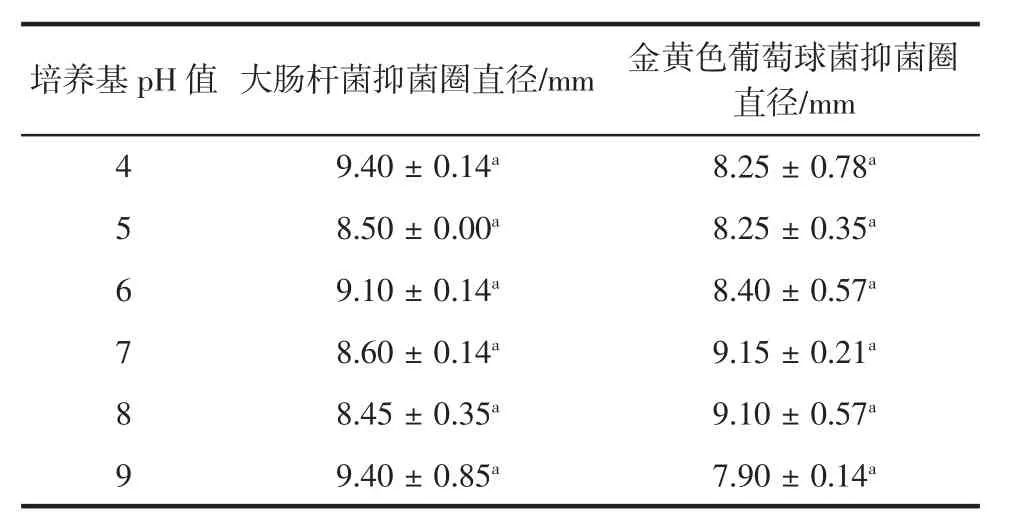
表5 培养基pH值与热带红睡莲精油抑菌活性的关系Table 5 Relationship between pH of culture medium and antibacterial activity of tropical red water lily oil
由表5可知,在热带红睡莲精油供试菌种中,pH 4、6、9时对大肠杆菌抑制效果较好,pH7、8时对金黄色葡萄球菌抑制效果较好。但各pH值下抑菌效果差异不显著(p>0.05),说明热带红睡莲精油具有广谱酸碱稳定性。
3 讨论
研究表明,热带红睡莲精油对于6种供试菌皆表现出一定抑制效果,包括2类革兰氏阴性菌(Gram negative bacteria,GNB)(枯草芽孢杆菌与大肠杆菌)、2类革兰氏阳性菌(Gram positive bacteria,GPB)(铜绿假单胞菌与金葡菌)、2类真菌(黑曲霉与酿酒酵母)。其中对GPB的抑制效果相比GNB偏高,是由于GNB的细胞壁内存在脂多糖(lipopolysaccharide,LPS),可阻止疏水性成分向菌体内转移[23],具有保护菌体的作用,马立[24]的研究显示,酚类物质会导致LPS结构受损。同时,王勇[25]发现植物精油中的丁香酚、肉桂醛和柠檬烯等是有效抑菌成分,尤其丁香酚具备芳香环结构,含极性基团,此类基团可结合菌中部分酶的活性基团,使其正常的代谢机能受损,抑制菌体生长。由此可以推测,酚类物质、甲基丁香酚和各种烯醛类化合物是红睡莲精油具有抑菌活性的关键所在。可为后续提升睡莲精油抑菌性提供理论依据。同时,热带红睡莲精油稳定性试验的结果表明,热带红睡莲精油具有良好的热稳定性、紫外稳定性及酸碱稳定性,可广泛应用于实际生产及生活中。
热带红睡莲精油对常见菌种的抑制效果虽比不上茶树精油等具有极强抑菌效果的精油产品,但与玫瑰、鼠尾草、薰衣草等精油相比,不仅抑菌效果较好且具有良好的稳定性。除此之外,因热带红睡莲精油对金黄色葡萄球菌有较强的抑制效果,而金黄色葡萄球菌是引起痤疮等皮肤炎症的主要原因之一,所以可考虑制备含热带红睡莲精油的护肤品。
4 结论
采用超临界CO2流体萃取热带红睡莲精油,并用GC-MS检测所提精油主要成分,结果显示精油含有大量烷烃、烯烃、酮类、酯类物质,为精油的抑菌性和抗氧化性奠定基础。热带红睡莲精油对试验中供试菌的抑菌能力为枯草芽孢杆菌>金黄色葡萄球菌>大肠杆菌>酿酒酵母>铜绿假单胞菌>黑曲霉。表明对革兰氏阳性菌抑制能力大于革兰氏阴性菌,同时精油在抑菌能力方面具备一定热稳定性、紫外稳定性、酸碱稳定性,即在 30℃~60℃、紫外线处理 10 min~60 min、pH4~9时,热带红睡莲精油的抑菌圈大小没有显著差异。

