光助MIL-101(Fe)活化过氧化氢氧化洛克沙胂及同步吸附生成的砷酸根
桑林凤,苏珊珊,高紫崴,金 伟,赵雅萍*
光助MIL-101(Fe)活化过氧化氢氧化洛克沙胂及同步吸附生成的砷酸根
桑林凤1,苏珊珊1,高紫崴1,金 伟2,赵雅萍1*
(1.华东师范大学生态与环境科学学院,上海 200041;2.同济大学环境科学与工程学院,上海 200071)
采用铁基金属有机框架(MIL-101(Fe))在模拟太阳光下活化过氧化氢氧化降解ROX—吸附去除生成的砷酸根.结果表明,光助MIL-101(Fe)(250mg/L)活化氧化剂H2O2(1.0mmol/L)体系可在120min内实现95.27%的ROX去除率,反应过程中形成的无机砷酸盐(As(V))会吸附在MIL-101(Fe)的表面,最终从溶液中实现84.14%的总砷去除率,主要活性氧形态•OH和O2•–自由基攻击ROX的As-C键,生成As(V)和邻硝基苯酚,环境实际水体基质对ROX在该系统中的去除有显著促进提升作用.
洛克沙胂;铁基金属有机框架;过氧化氢;吸附
砷(As)是一种地源性元素,在环境介质中广泛存在.它可通过水、陆地、空气和生命系统在自然界中循环[1].国内外许多研究人员对无机砷在环境中的行为及毒性进行了大量研究,获得了丰富的成果,但对芳香族有机砷化合物的研究较少[2].
芳香族有机砷如洛克沙胂(3-硝基-4-羟基苯胂酸,ROX)作为饲料添加剂被广泛应用于畜牧业,以提高家禽肉的产量、控制寄生虫和改善动物的健康状况[3].但有机砷在家禽体内几乎不参与新陈代谢转化,以原有的化学形式通过家禽排泄物进入环境, 后经生物和非生物作用,转化为毒性更强的无机砷化合物[4].ROX通过传统高级氧化技术氧化分解后,形成的无机砷产物依然保留在溶液中,无法实现总砷的完全去除,带来严重的二次污染[5].
目前针对有机砷去除的方法主要有:吸附法、高级氧化技法(包括光催化氧化法、Fenton氧化法、过硫酸盐氧化法)、絮凝沉淀法、微生物降解法等[6].其中吸附法与高级氧化法各有优势也各有不足,将高级氧化技术与吸附相结合应用于有机砷的去除已经引起了广泛关注.如何获得催化效果好、稳定性高、对砷吸附亲和力强、吸附容量大的催化剂是该联用技术的关键[7].
铁氧化物由于其地质储存量丰富、与砷亲和力强、吸附容量大、催化效果好而备受关注,但是铁氧化矿物由于颗粒细小极易团聚,极大限制了吸附和催化活性[8].因此,将铁氧化矿物与碳材料复合是提高其催化与吸附的效果是解决办法之一[9].近年来,金属有机框架结构(MOFs)作为一种新兴材料,具有比表面积大、较高的催化活性和吸附性能等优点[10].因此,本文拟研究铁基金属有机框架同步作为催化和吸附双功能材料活化过氧化氢去除有机砷的性能和机理.
1 材料与方法
1.1 实验试剂
洛克沙胂(ROX)采购于阿尔法埃沙中国有限公司,过氧化氢(H2O2)、六水合氯化铁(FeCl3·6H2O)、对苯二甲酸(H2BDC)、N,N-二甲基甲酰胺(DMF)、甲醇(CH3OH)和所有其他化学品均由国药集团化学试剂有限公司提供,无需进一步纯化即可使用.
1.2 材料合成
使用文献报道方法水热法合成MIL-101(Fe)[11].简言之,将2.48mmol H2BDC和4.9mmol FeCl3·6H2O超声溶解于30mL DMF溶剂中.然后,将混合物转移到55mL特氟龙密封高压反应釜中,于110℃下反应20h.离心回收得到的黄褐色固体粉末,使用DMF溶液清洗3遍后,在60℃下用乙醇分2次提纯6h.最后,用去离子水对催化剂多次清洗,冷冻干燥后研磨成粉末状供实验使用.
1.3 材料表征
使用Rigaku D/Max-2500型号的X射线衍射仪(XRD)表征合成的MIL-101(Fe)的晶体结构.以Cu Kα作为辐射源,扫描速度为5°min-1,扫描范围为2°~40°.使用扫描电子显微镜(SEM)表征材料形貌.采用傅里叶变化红外光谱(FTIR)对反应前后MIL-101(Fe)的表面官能团进行了分析,利用X射线光电子能谱(XPS)测定MIL-101(Fe)反应前后表面元素组成及其化学状态.
1.4 催化降解实验
ROX降解实验在玻璃反应器中进行,使用350W氙灯模拟自然条件下的太阳光,未使用滤光片.反应器中装有200mL浓度为10mg/L的ROX溶液(浓度是以As元素浓度计算),MIL-101(Fe)的投加量为50mg (0.25g/L),添加1.0mmol/L的H2O2后在氙灯辐照下(MIL-101(Fe)/H2O2/hv体系),25˚C下持续搅拌反应.在预定的时间间隔内取样,使用0.22μm聚四氟乙烯滤膜过滤,测定滤液中剩余ROX和形成无机砷的浓度.采用0.1mol/L HCl或NaOH调整反应液初始pH值.
溶液中ROX的浓度采用高效液相色谱测定,总砷浓度采用电感耦合等离子体原子发射光谱法(ICP-AES)测定.砷钼蓝分光光度法测定溶液中砷酸根(As(V))的浓度.总砷的浓度减去As(V)和ROX的浓度计算溶液中亚砷酸根(As(III))的浓度.使用钛试剂紫外可见分光光度法测定反应过程中H2O2的变化.使用紫外-可见光分光光度计测定反应过程中ROX的紫外-可见吸收光谱.使用1,10-菲罗啉分光光度法测量反应过程中溶解总Fe浓度.
1.5 自由基抑制与电子自旋共振实验
为研究催化体系中的活性氧物种,分别使用甲醇(MeOH)和氮气(N2)作为羟基自由基(•OH)和超氧自由基(O2•–)的抑制剂.采用电子自旋共振谱(EPR)验证体系中•OH、O2•–自由基和空穴(h+)的存在.•OH和O2•–自由基的捕获剂是100mmol/L DMPO;h+的自旋捕获剂为30mmol/L TEMPO.
1.6 实际水体的应用
研究水体基质效应对ROX在MIL-101(Fe)/ H2O2/hv体系去除过程的影响,所用水样分别为崇明岛的河流、东海水、长江水以及污水处理厂二级出水[12].水样使用前经过0.45μm滤膜过滤去除水中不溶性杂质颗粒.处理后,将ROX储备液加入滤液中,调节ROX浓度为10mg/L.
2 结果与讨论
2.1 MIL-101(Fe)结构特性
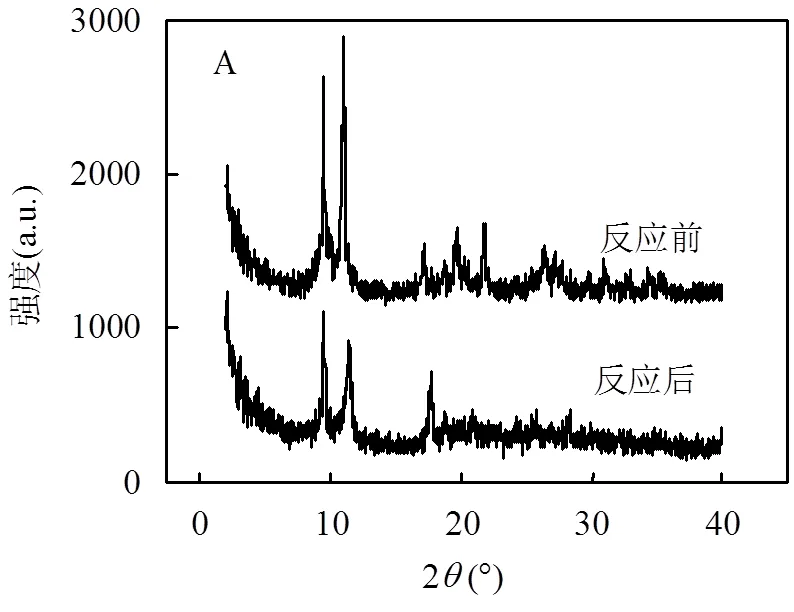
如图1A所示,MIL-101(Fe)的特征衍射峰出现在2= 9.5°,11.0°,17.1°,19.6°和21.7°处,与文献报道的研究结果一致[13],相对高强度的特征衍射峰表明MIL-101(Fe)结晶性良好,也未观察到杂质峰的存在,表明MIL-101(Fe)纯度较高.反应后的XRD出峰位置与反应前相同,但强度有所下降,说明ROX的降解和As(V)的吸附在一定程度上影响了MIL-101(Fe)有序结构.通过SEM研究MIL-101(Fe)的形貌,结果如图1B所示,MIL-101(Fe)外形是约为1 μm光滑的八面体形状,与文献报道一致[14].
2.2 MIL-101(Fe)/H2O2/hv体系增强ROX降解性能
在不同反应条件下ROX浓度随时间变化率如图2A所示.在单独光照射或者H2O2氧化下,120min后ROX的降解率分别为0.36%和5.68%,表明ROX在自然环境条件下非常稳定,而MIL-101(Fe)对ROX的吸附去除率在120min内也仅达到20.66%. ROX在MIL-101(Fe)/hv光催化体系下降解率可达到57.13%,表明MIL-101(Fe)具有优异的光催化性能,骨架结构互相连通的空隙结构提供了更多的催化位点和更好的质量运输,促进了光生电子空穴对的分离,具有催化降解ROX的能力.MIL-101(Fe)/ H2O2类芬顿体系下ROX的降解率为30.51%,这主要是由于MIL-101(Fe)中的Fe金属簇可以催化H2O2.ROX在H2O2/hv光解体系中去除率120min后可稳定上升到49.58%,这主要是由于过氧化氢可以有效地氧化激发态ROX.MIL-101(Fe)/H2O2/hv体系中,ROX可以在催化剂的表面以最快的降解动力学完全转化为As(V).溶液中残留As(V)的变化如图2B所示,在单纯光解、H2O2氧化或MIL-101(Fe)/H2O2体系中,几乎没有观察到As(V)的生成,表明这3个体系下ROX即使被氧化为As(V),那么As(V)的生成量也是非常之低或者已经被吸附到MIL-101(Fe)表面.在MIL-101(Fe)/hv和hv/H2O2体系中,残留As(V)的浓度分别逐渐增加到2.62和4.96mg/L左右.对于MIL-101(Fe)/H2O2/hv体系,生成的As(V)的浓度60min内先增加到4.75mg/L,然后在反应120min后逐渐下降到1.10mg/L,这表明ROX首先氧化ROX为As(V)释放在溶液中,然后生成的As(V)又逐渐被吸附到MIL-101(Fe)上.
在MIL-101(Fe)/H2O2/hv体系中,ROX降解过程中不同形态砷的浓度变化如图2C所示.随着反应的进行,溶液中ROX的浓度逐渐降低,120min后将近84.14%的ROX完全转化为As(V),同时,在催化剂上只检测到少量的ROX,这表明吸附对ROX的去除贡献很小.在ROX降解过程中,在溶液和催化剂表面均检测到As(V)的存在,且As(V)在溶液中快速积累,浓度先是逐渐升高,而后又缓缓下降,这表明随着反应的进行,As(V)逐渐吸附在MIL- 101(Fe)上.

反应条件:[H2O2] = 1.0mmol/L, [MIL-101(Fe)] = 0.25g/L, ROX = 10mg/L, pH = 3.58 ± 0.1,= (25 ± 1)℃
2.3 环境条件对ROX降解的影响
在非均相类芬顿催化过程中,溶液的初始pH值对ROX的化学形态和溶液中活性氧形态(ROS)的生成有重要影响.如图3A所示,酸性反应环境促进H2O2的界面吸附有利于ROX降解,初始pH值的增加会使反应速率减慢.ROX是一种有机酸,在溶液中呈负电性[15].MIL-101(Fe)的零点电荷(pHZPC)约为4.3[16].当pH值在4.3以上时,由于表面羟基的逐渐去质子化,使MIL-101(Fe)表面带负电荷,从而抑制了ROX的吸附,减缓了ROX的降解速率.此外,当pH=11.1时,由于MIL-101(Fe)稳定性下降会分解泄漏铁离子,在反应初期通过均相芬顿反应加速ROX降解,随着反应进行,铁离子逐渐水解致使均相芬顿反应受到抑制逐渐趋于平缓.研究表明,Fenton氧化工艺的最佳反应pH值约为3.0[17].然而,光助MIL- 101(Fe)活化过氧化氢催化体系可以很好克服这个缺点并扩大反应的pH值范围,具有非常好的实际应用价值.如图3A插图显示了在不同初始pH值下反应过程中H2O2的变化,随着初始pH值从3.00增加到11.02,H2O2的消耗量从98.4%下降到62.4%. H2O2在不同初始pH值下的消耗趋势与ROX降解趋势一致,说明酸性条件下更有利于H2O2去质子化分解,生成大量的•OH自由基,提高催化降解效果. H2O2用量、催化剂投加量和反应物初始浓度对MIL-101(Fe)/H2O2/hv体系中降解ROX的影响如图3B~D所示.随着H2O2用量的从0.5mmol/L到2.0mmol/L逐渐增加,ROX的降解率逐渐提高,因为溶液中•OH自由基的生成量逐渐增多.当超过H2O2用量1.0mmol/L之后,ROX降解率没有显而易见的提升,这是由于过量的H2O2可能会发生自清除. 随着MIL-101(Fe)投加量的增加,ROX的去除率提高.这是由于MIL-101(Fe)投加量的增加可导致催化和吸附的活性位点的增多.此外,在ROX初始浓度在5mg/L到20mg/L范围内,MIL-101(Fe)仍表现出良好的催化性能.随着ROX初始浓度的增加,去除效果下降.这是由于当H2O2和MIL-101(Fe)投加量固定时,可用于去除ROX的活性位点受到催化剂投加量的限制.
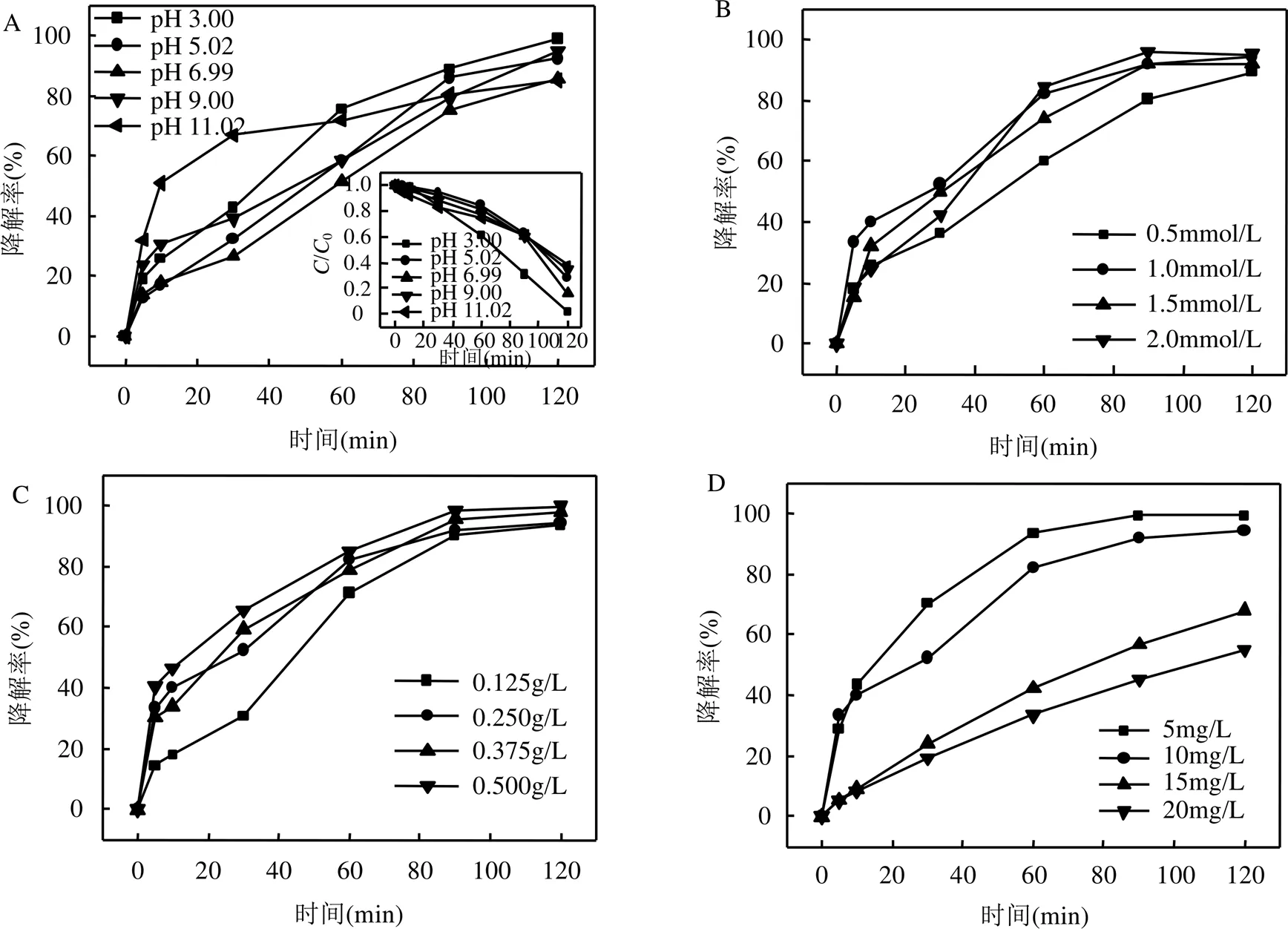
图3 pH值,H2O2的浓度,MIL-101(Fe)投加量以及ROX初始浓度对MIL-101(Fe)/H2O2/hv体系降解ROX的影响
反应条件:[H2O2] = 1.0mmol/L,除(B)外, [MIL-101(Fe)] = 0.25g/L,除(C)外, ROX = 10mg/L,除(D)外, pH = 3.58 ± 0.1,除(A)外,=( 25 ± 1)℃
2.4 MIL-101(Fe)重复利用性能
如图4A所示.5个循环实验后ROX的降解效率从第1次的95.27%小幅度地下降到第5次的87.26%,表明MIL-101(Fe)具有良好且稳定的催化性能,降解效率稍有下降的主要原因是反应副产品吸附到MIL-101(Fe)材料表面,占据了反应活性位点[18-19].随循环实验次数增加,溶液中残留As(V)浓度逐渐增加,主要是由于MIL-101(Fe)材料经过洗脱,其表面吸附活性位点逐渐饱和.溶液中Fe泄漏量如图4B所示,经过5轮循环实验后,反应液中总Fe的含量由4.329mg/L降至0.429mg/L.反应液中溶解的Fe含量较高可能是由于铁基金属有机框架结构稳定性相对较差的缘故.体系内溶解性Fe的含量是影响均相Fenton反应的决定性因素之一.最大的Fe泄漏浓度下的均相光助芬顿催化反应对ROX降解的贡献如图4B插图所示,结果与ROX在H2O2/hv体系中降解的趋势相似.结果表明溶液中溶解Fe发生的均相芬顿降解ROX的贡献比起MIL-101(Fe)/H2O2/hv体系的贡献小很多,说明ROX在MIL-101(Fe)/H2O2/hv体系中ROX的降解是非均相催化过程起主导作用.
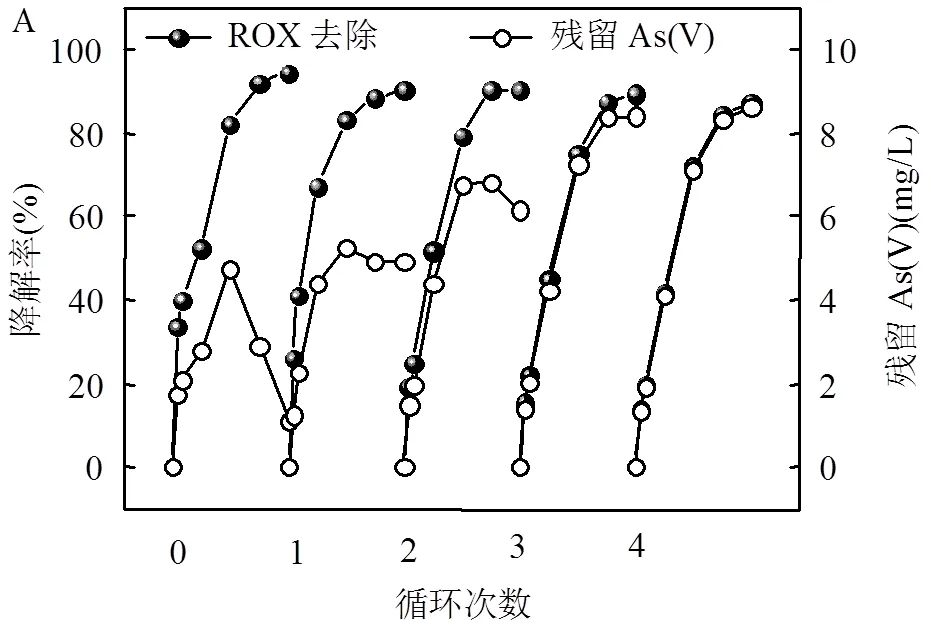
反应条件:[H2O2] = 1.0mmol/L, [MIL-101(Fe)] = 0.25g/L, ROX = 10mg/L, pH = 3.58 ± 0.1,= (25 ± 1)℃
2.5 ROX降解机理分析
2.5.1 MIL-101(Fe)/H2O2/hv体系中活性氧形态 通过自由基抑制实验研究不同的活性自由基对ROX降解在MIL-101(Fe)/H2O2/hv体系中的作用.分别以甲醇和N2作为反应体系中•OH和O2•–的抑制剂;使用EDTA-2Na、草酸铵和三乙醇胺作为h+的捕获剂[20],向反应体系内添加这些自由基抑制剂后,ROX的降解曲线如图5A所示.甲醇和N2的存在对ROX的降解效率均有明显的抑制作用,这表明•OH和O2•–自由基是ROX降解过程中的主要活性物质,N2比甲醇具有更高的抑制效果,这表明O2•–自由基对ROX降解的贡献更高.但是,EDTA-2Na、草酸铵和三乙醇胺在反应体系中的引入会导致催化剂的溶解,因为他们会与材料中的Fe离子发生络合反应,无法作为空穴清除剂使用[13].因此,为了研究h+对ROX降解的作用,采用EPR技术进一步确认体系中活性自由基的存在.如图5B~D所示,在黑暗的情况下检测不到DMPO-OH或DMPO-OOH信号.光照3min后,出现了4个相对强度为1:2:2:1的DMPO- OH特征峰和6个相对强度为1:1:1:1:1:1的DMPO- OOH特征峰.DMPO-OH特征峰的超精细分裂常数为(aH=aN)为14.9G.这表明在反应体系内形成了O2•–和•OH 自由基[21].在光辐射到9min后,信号强度明显增强,说明反应体系内活性自由基数量的增加.此外,在光照射5min后,h+的信号也有所增加,这证明了MIL-101(Fe)/H2O2/hv体系内h+作用的存在.EPR实验结果表明, •OH、O2•–自由基和h+是反应体系中ROX降解的主要活性物种.
2.5.2 光助MIL-101(Fe)活化过氧化氢体系降解机理 如图6A所示,从反应前MIL-101(Fe)的FTIR谱图显示1692, 1587, 1390, 752和554cm-1处有吸收峰,与文献报道结果一致.位于752cm-1处的吸收峰对应苯环中的C–H键的弯曲振动,1390cm-1的吸收对应MIL-101(Fe)芳香环C–C键振动,1587cm-1的吸收峰代表对苯二甲酸结构中羧基(–COO–)的不对称振动,位于1692cm-1处的吸收峰表示游离羧基的C–O键的振动,出现在554cm-1处的吸收带对应于Fe–O键的振动.降解反应后MIL-101(Fe)的FTIR谱图中新出现782和880cm-1处的吸收峰来自于Fe–O–As键,这表示含砷的降解产物通过化学键吸附在材料表面,位于1587cm-1处的峰强减弱了许多,这是由As(V)的吸附引起游离羧基的数量增加,而游离的羧基作为吸附位点又会通过氢键的作用吸附溶液中的ROX.
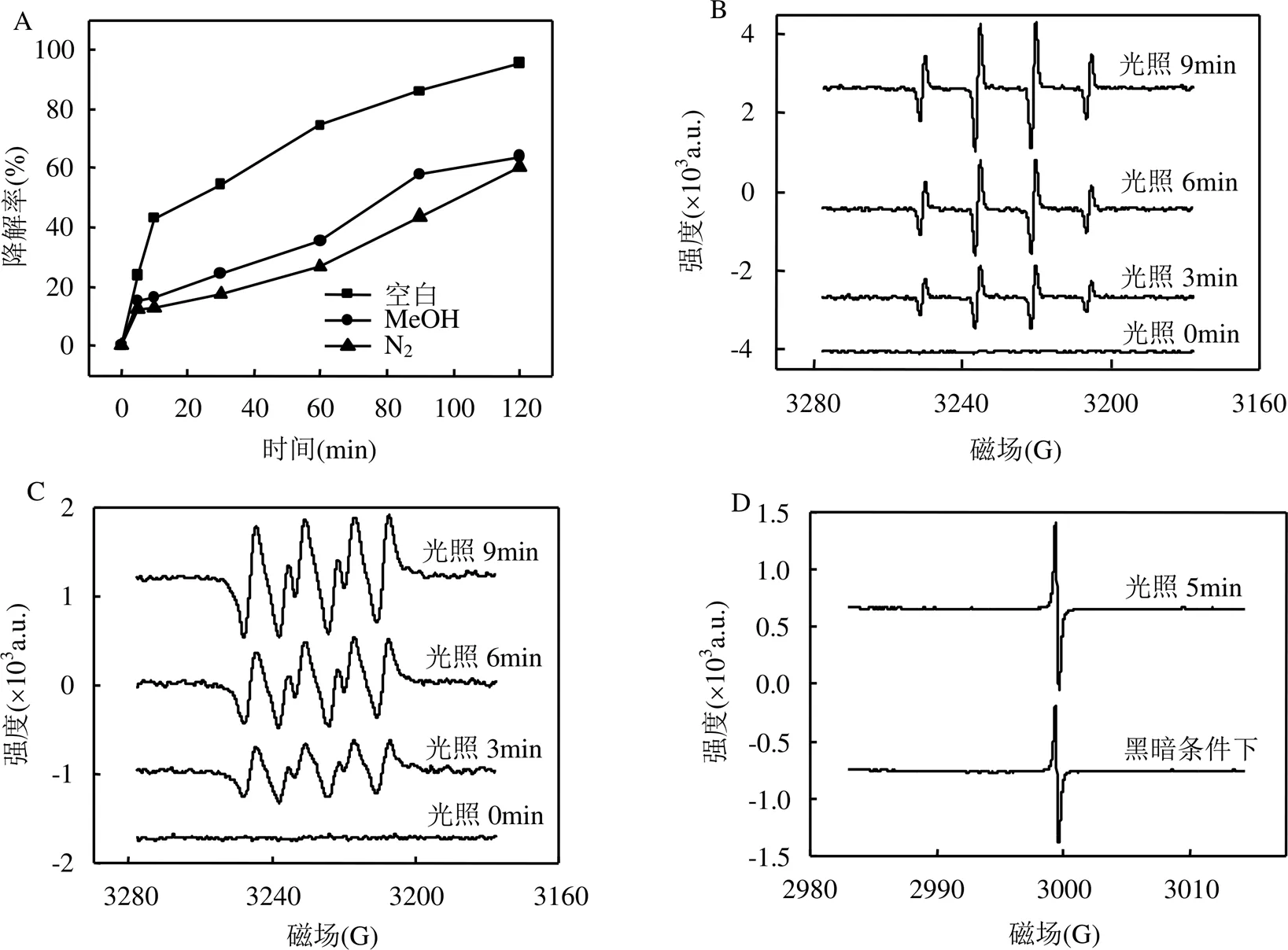
图5 自由基抑制剂对ROX 在MIL-101(Fe)/H2O2/hv体系降解的影响和DMPO捕获O2•–、•OH、以及TEMPO捕获h+的EPR谱
反应条件:[H2O2] = 1.0mmol/L, [MIL-101(Fe)] = 0.25g/L, ROX = 10mg/L, pH = 3.58 ± 0.1,= (25 ± 1)℃
如图6B所示,XPS全谱显示MIL-101(Fe)主要由C、O和Fe 3种元素组成.由图6C可见,C 1s的精细谱中可以明显地看到结合能位于284.7和289.0eV处的2个峰,分别对应于MIL-101(Fe)结构中的苯环和连接对苯二甲酸的O–C=O基团[13,22].由图6D可见,反应前MIL-101(Fe)的O 1s谱图有3个主峰,结合能分别位于533.6, 531.6和530.8eV处. 533.6eV代表的是对苯二甲酸中的O–C=O基团, 531.6eV对应的是MIL-101(Fe)材料表面的Fe–OH, 530.8eV对应的是Fe–O键[23-24]. ROX降解后,新出现了结合能位于532.1eV处的Fe– O–As键,表示降解产物As(V)通过化学吸附在MIL- 101(Fe)上,这与FTIR分析结果一致.如图6E所示,Fe 2p的精细谱显示结合能位于710.8和724.3eV分别代表Fe 2p3/2和Fe 2p1/2,表明MIL-101(Fe)中Fe(III)的存在[25].两处峰之间结合能相差13.5eV,这与典型的Fe2O3特征相似[26].降解ROX后,新出现了一个结合能位于717.3eV的Fe(II)卫星峰[27-28],表明在反应过程中存在Fe(III)的还原.Fe 2p精细谱中分峰的变化表明在ROX降解的过程中,Fe(II)和Fe(III)在催化剂表面进行了有效的氧化还原循环.由图6F可见,与原始MIL- 101(Fe)的XPS谱图比较,反应后新出现了一个结合能位于45.6eV处的峰,对应于As 3d的存在[29-30].45.6eV处峰强的显著增加是由于含砷降解产物吸附在MIL-101(Fe)表面所致,由于MIL-101 (Fe)/H2O2/hv体系具有的强氧化性,反应溶液体系中没有检测到As(III)的存在.
通过以上阐述, MIL-101(Fe)/H2O2/hv体系降解ROX可能的反应机理为:在350W的氙灯照射下,催化剂表面Fe(II)活化过氧化氢形成Fe(II)-H2O2复合物发生光解,生成•OH自由基和Fe(III),从而氧化激发态ROX ,Fe(III)又与H2O2反应生成HO2•–和•OH自由基,并再生Fe(II),Fe(II)和Fe(III)在催化剂表面的循环是制约反应速率的关键步骤.由MIL- 101(Fe)紫外可见吸收光谱(图6G)可知,MIL- 101(Fe)可以吸收小于680nm的紫外可见光而被激发,产生光生载流子,具有氧化性的空穴可以直接与ROX反应,而光生电子可与溶液中的H2O2发生反应,通过电子转移机制分解H2O2产生•OH自由基,减缓了电子与空穴的复合效率,从而加快了ROX降解的反应速率.此外,电子还可与催化剂表面吸附的氧气反应生成O2•–自由基,进一步促进ROX的降解.这3个过程协同进行,共同作用导致了ROX的降解和最终矿化.
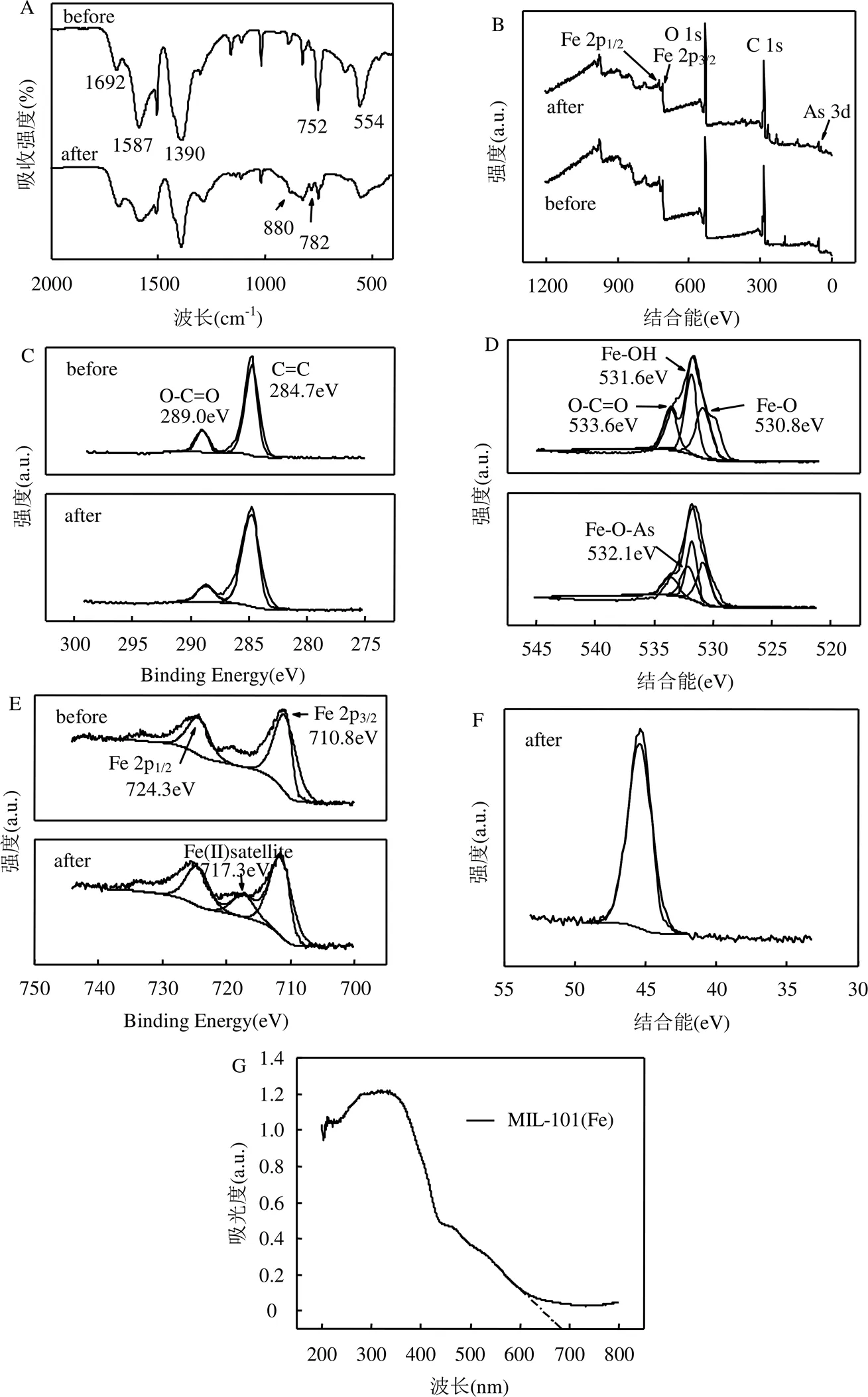
图6 反应前后MIL-101(Fe)的红外吸收光谱、XPS谱图以及UV–Vis DRS光谱
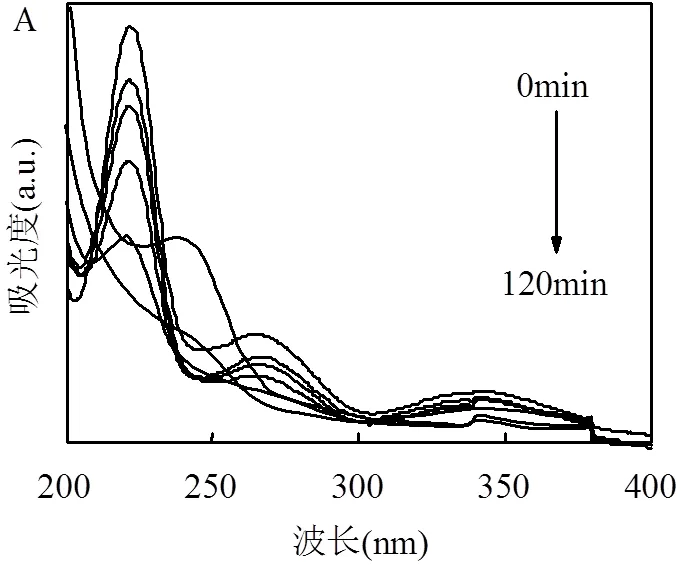
2.5.3 ROX氧化降解途径 如图7A所示, ROX的特征吸收峰位于266nm与340/220nm处,分别表示ROX结构中芳香环上的羟基和硝基的吸收[29,31].随着反应的进行,这些吸收峰的强度逐渐降低,说明在反应体系中ROX被逐渐分解为无机As(V)的形式.反应后期,出现了位于238nm处新的吸收峰,这是由于生成了含有芳香环的中间产物.为了进一步了解ROX在MIL-101(Fe)/H2O2/hv体系中降解的途径,使用HPLC-MS检测了反应过程中生成的中间产物.当/=139代表了邻硝基苯酚的存在,/=263指的是洛克沙胂,/=94的峰代表反应过程中生成了苯酚.通过对中间产物的分析,提出了ROX可能的降解路径,如图7B所示.有报道表明,羟基自由基会倾向于攻击分子结构里电子密度较高的部位,而超氧自由基则会攻击电子密度较低的部位.在ROX的分子结构中,As–O是一个富电子的化学键,故羟基自由基会首先攻击As–O键,导致邻硝基苯酚和As(V)的产生.苯环上的硝基是一个强吸收电子取代基,很容易被羟基自由基攻击并生成邻苯二酚.邻苯二酚进一步会被氧化为醌类化合物或者苯酚,最终发生开环反应,氧化成一些短链羧酸./= 234的存在表明溶液中可能还存在另一种氧化过程:羟基自由基首先攻击硝基,ROX苯环上的硝基被羟基取代,而后发生进一步氧化生成1, 2, 4-苯三酚(/= 126),经过矿化作用最终被降解成为二氧化碳和水分子.
2.6 实际水体中ROX去除效果
实际水体系是一个含有各种阴离子、阳离子和溶解性有机物的复杂环境体系,会抑制催化体系的降解效果.选择4种不同的实际水体,考察了MIL- 101(Fe)/H2O2/hv体系对实际水体中ROX的降解效率,结果如图8A所示,与实验用水相比,MIL- 101 (Fe)/H2O2/hv体系在实际水体中反而表现出相对更高的ROX降解速率.为了解释在实际废水中,ROX降解效果不减反增的现象.我们以东海海水为例,进一步研究了模拟海水、不同浓度的HA和Fe(II)的对ROX降解的影响,如图8B所示.模拟海水的pH值、盐度与海水相近,主要区别在于模拟海水中没有有机物.用模拟海水代替蒸馏水可显著抑制ROX的降解,模拟海水中的Cl-和SO42-对•OH自由基具有较强的竞争性,从而减缓了ROX的降解速率.此外,模拟海水中的SO42-可与Fe(II)、Fe(III)形成表面络合物,从而影响反应活性和Fe元素在MIL- 101(Fe)表面的分布情况.根据上述结论,我们排除了实际水体中各种阴阳离子对促进ROX降解的影响.由于模拟海水与实际海水之间的主要区别是有机物的存在与否,我们在反应体系内分别添加了5mg/L或10mg/L的HA.但是实验结果表明,HA的存在会抑制 ROX的降解效果,这可能是由于有机物可能会与ROX竞争MIL-101(Fe)表面的活性吸附位点或溶液中的活性氧物种,从而抑制了ROX的降解.我们还考察了1mg/L或5mg/L二价铁离子的存在对反应体系中ROX的降解效果,发现微量铁离子就能够显著提升该反应体系对ROX的降解效果,也间接表明本实验中不同环境水体或许含有微量能够促进MIL-101(Fe)/H2O2/hv催化反应活性的微量金属离子.此外,还有研究报道低浓度的天然有机物可以作为电子穿梭介质促进有机物的氧化.考虑到天然地表水体和污水处理厂二级出水里均存在天然有机物,故这可能是本体系应用在实际水体中,ROX降解效果不减反增的原因.Wang等[32]研究阳光照射下的DOM可产生激发三重态DOM(3DOM*)、1O2和•OH活性中间体,从而对有机污染物的降解起到促进作用.然而,DOM也可通过遮挡阳光、清除活性自由基等来延缓有机污染物的降解.故DOM在有机污染物中的促进或抑制作用取决于DOM的来源和其中的主要成分.DOM中除了腐殖类成分以外,还具有蛋白类成分.而我们之前的实验结果显示腐殖酸类物质对ROX的降解起到抑制作用.因此猜想本实验中4处不同实际水体DOM中蛋白类成分是促进ROX降解的可能原因.就不同水质提升MIL-101(Fe)/ H2O2/hv体系催化性能的原因还需后续深入探讨和研究.

反应条件:[H2O2] = 1.0mmol/L, [MIL-101(Fe)] = 0.25g/L, ROX = 10mg/L, pH = 3.58 ± 0.1,= (25 ± 1)℃
3 结论
3.1 铁基MOFs材料应用于类Fenton体系中,实现了有机砷和无机砷整体化的高去除率.反应体系降解速率快、不产生二次污染、稳定性高等优势,为环境中有机砷的修复提供了一种新的思路.
3.2 在MIL-101(Fe)/H2O2/hv体系中,产生的活性氧形态(包括•OH、O2•–自由基和h+)可以有效攻击MIL-101(Fe)表面吸附的ROX,从而转化为无机砷酸盐As(V),MIL-101(Fe)对As(V)的高吸附容量,可以实现体系内总砷的完全去除. ROX降解过程涉及到活性氧物种来源:1)MIL-101(Fe)受到光激发产生的光生电子与空穴,生成活性自由基攻击ROX;2) MIL-101(Fe)中的表面Fe(II)离子催化H2O2产生羟基自由基和超氧自由基氧化降解ROX.
3.3 MIL-101(Fe)具有非常好的重复利用性能和循环稳定性,而且在实际环境水体降解ROX效果明显优于纯净水,这对含砷水体的实际处理具有十分重要的意义.
[1] Payel S, Prabir P, Priyanka M, et al. Kinetics and mechanism of arsenic removal using sulfide-modified nanoscale zerovalent iron [J]. Chemical Engineering Journal. 2021,412,128667.
[2] Yan W, Yu J, Wang Z, et al. A review on arsenic removal from coal combustion: Advances, challenges and opportunities [J]. Chemical Engineering Journal. 2021,414,128785.
[3] Li R, Yang W, Gao S, et al. Hydrous cerium oxides coated glass fiber for efficient and long-lasting arsenic removal from drinking water [J]. Journal of Advanced Ceramics. 2021,10(2):247-257.
[4] 华 洁,王 敏,林舒婷,等. Fe3O4/FeS2活化H2O2降解典型苯胂酸类污染物[J]. 中国环境科学, 2021,41(6):2646-2656.
Hua J, Wang M, Lin S, et al. Fe3O4/FeS2activated H2O2to degrade typical phenylarsonic acid contaminants [J]. China Environmental Science. 2021,41(6):2646-2656.
[5] 李 欢,张静丽,张诗雨,等.四环素和砷对斑马鱼的联合毒性及机制研究[J]. 中国环境科学, 2021,41(7):1-12.
Li H, Zhang J, Zhang S, et al. Combined toxicity and mechanism of tetracycline and Arsenic on zebrafish [J]. China Environmental Science, 2021,41(7):1-12.
[6] Lara B F A, Facundo B, Carlos M R, et al. Efficient low-cost magnetic composite based on eucalyptus wood biochar for arsenic removal from groundwater [J]. Groundwater for Sustainable Development, 2021,14, 100585.
[7] Goetjen T A, Liu J, Wu Y, et al. Metal-organic framework (MOF) materials as polymerization catalysts: a review and recent advances [J]. Chemical communications (Cambridge, England), 2020,56(72):10409- 10418.
[8] 曾辉平,尹 灿,李 冬,等.基于铁锰泥的除砷吸附剂性能比较及吸附机理[J]. 中国环境科学, 2018,38(9):3373-3379.
Zeng H, Yin C, Li D, et al. Performance comparison and adsorption mechanism of arsenic removal adsorbent based on iron and manganese mud [J]. China Environmental Science, 2018,38(9):3373-3379.
[9] 蒋 琦,章 涵,王俊二,等.磁性金属有机骨架材料(MOF)Fe3O4- COOH@MIL-101(Cr)的制备及其吸附/催化协同作用去除新型污染物尼泊金甲酯[J]. 环境化学, 2020,39(10):2937-2946.
Jiang Q, Zhang H, Wang J, et al. Preparation of magnetic metal- organic framework (MOF)Fe3O4-COOH@MIL-101(Cr) and its synergistic adsorption/catalytic effect on the removal of methyl niperin as a novel pollutant [J]. Environmental Chemistry, 2020,39(10):2937- 2946.
[10] Lata R, Jyotsna K, Lal S A, et al. A critical review on recent developments in MOF adsorbents for the elimination of toxic heavy metals from aqueous solutions [J]. Environmental science and pollution research international, 2020,27(36):44771-44796.
[11] Maksimchuk N V, Kovalenko K A, Fedin V P, et al. Cyclohexane selective oxidation over metal–organic frameworks of MIL-101 family: superior catalytic activity and selectivity [J]. Chemical Communications, 2012,48(54):6812-6814.
[12] Liu X, Shi H, Xie B, et al. Microplastics as both a sink and a source of bisphenol a in the marine environment [J]. Environmental Science & Technology. 2019,53(17):10188-10196.
[13] Wang D, Jia F, Wang H, et al. Simultaneously efficient adsorption and photocatalytic degradation of tetracycline by Fe-based MOFs [J]. Journal of Colloid and Interface Science, 2018,519:273-284.
[14] Hu H, Zhang H, Chen Y, et al. Enhanced photocatalysis degradation of organophosphorus flame retardant using MIL-101(Fe)/persulfate: Effect of irradiation wavelength and real water matrixes [J]. Chemical Engineering Journal, 2019,368:273-284.
[15] Chen L, Li H, Qian J. Degradation of roxarsone in UV-based advanced oxidation processes: A comparative study [J]. Journal of Hazardous Materials, 2021,410,124558.
[16] Thanh H T M, Phuong T T T, Le Hang P T, et al. Comparative study of Pb(II) adsorption onto MIL–101 and Fe–MIL–101 from aqueous solutions [J]. Journal of Environmental Chemical Engineering, 2018, 6(4):4093-4102.
[17] Xie X, Hu Y, Cheng H. Rapid degradation of p-arsanilic acid with simultaneous arsenic removal from aqueous solution using Fenton process [J]. Water Research, 2016,89:59-67.
[18] Jorfi S, Kakavandi B, Motlagh H R, et al. A novel combination of oxidative degradation for benzotriazole removal using TiO2loaded on FeIIFe2IIIO4@C as an efficient activator of peroxymonosulfate [J]. Applied Catalysis B: Environmental, 2017,219:216-230.
[19] Tan C, Gao N, Deng Y, et al. Radical induced degradation of acetaminophen with Fe3O4magnetic nanoparticles as heterogeneous activator of peroxymonosulfate [J]. Journal of Hazardous Materials, 2014,276:452-460.
[20] Lv J, Hu Q, Cao C, et al. Modulation of valence band maximum edge and photocatalytic activity of BiOX by incorporation of halides [J]. Chemosphere. 2018,191:427-437.
[21] Tang L, Liu Y, Wang J, et al. Enhanced activation process of persulfate by mesoporous carbon for degradation of aqueous organic pollutants: Electron transfer mechanism [J]. Applied Catalysis B: Environmental, 2018,231:1-10.
[22] Zhang C, Ai L, Jiang J. Graphene hybridized photoactive iron terephthalate with enhanced photocatalytic activity for the degradation of rhodamine B under visible light [J]. Industrial & Engineering Chemistry Research, 2014,54(1):153-163.
[23] Li X, Guo W, Liu Z, et al. Quinone-modified NH2-MIL-101(Fe) composite as a redox mediator for improved degradation of bisphenol A [J]. Journal of Hazardous Materials, 2017,324(Pt B):665-672.
[24] Farisabadi A, Moradi M, Hajati S, et al. Controlled thermolysis of MIL-101(Fe, Cr) for synthesis of FeO/porous carbon as negative electrode and Cr2O3/porous carbon as positive electrode of supercapacitor [J]. Applied Surface Science, 2019,469:192-203.
[25] He L, Dong Y, Zheng Y, et al. A novel magnetic MIL-101(Fe)/TiO2composite for photo degradation of tetracycline under solar light [J]. Journal of Hazardous Materials, 2019,361:85-94.
[26] Wang H, Yuan X, Wu Y, Zeng G, et al. In situ synthesis of In2S3@MIL-125(Ti) core–shell microparticle for the removal of tetracycline from wastewater by integrated adsorption and visible- light-driven photocatalysis [J]. Applied Catalysis B: Environmental, 2016, 186:19-29.
[27] Du J, Bao J, Lu C, et al.Reductive sequestration of chromate by hierarchical FeS@Fe(0) particles [J]. Water Research, 2016,102:73- 81.
[28] Gong Y, Gai L, Tang J, et al. Reduction of Cr(VI) in simulated groundwater by FeS-coated iron magnetic nanoparticles [J]. Science of the Total Environment, 2017,595: 743-751.
[29] Hu P, Liu Y, Jiang B, et al. High-efficiency simultaneous oxidation of organoarsenic and immobilization of arsenic in fenton enhanced plasma system [J]. Industrial & Engineering Chemistry Research, 2015,54(33):8277-8286.
[30] Sun T, Zhao Z, Liang Z, et al. Efficient degradation of p-arsanilic acid with arsenic adsorption by magnetic CuO-Fe3O4nanoparticles under visible light irradiation [J]. Chemical Engineering Journal, 2018,334: 1527-1536.
[31] Zhu X D, Wang Y J, Liu C, et al. Kinetics, intermediates and acute toxicity of arsanilic acid photolysis [J]. Chemosphere, 2014,107:274- 281.
[32] Wang J, Chen J, Qiao X, et al. Disparate effects of DOM extracted from coastal seawaters and freshwaters on photodegradation of 2,4-Dihydroxybenzophenone [J]. Water Research, 2019,151:280-287.
Photoassisted MIL-101(Fe) activated hydrogen peroxide system for oxidative degradation of roxarsone and adsorption of in-situ formed arsenate.
SANG Lin-feng1, SU Shan-shan1, GAO Zi-wei1, JIN Wei2, ZHAO Ya-ping1
(1.Faculty of Ecological and Environmental Sciences, East China Normal University, Shanghai 200241, China;2.School of Environmental Science and Engineering, Tongji University, Shanghai 200071, China)., 2022,42(1):203~212
An iron-based-organic framework (MIL-101(Fe)) was prepared using a simple one-pot method, aiming to simultaneously oxidize ROX through activating hydrogen peroxide and adsorption formed arsenate under simulated sunlight. The photoassisted MIL-101(Fe) (250mg/L) activating H2O2(1.0mmol/L) system could remove 95.27% of ROX within 120min. Moreover, the arsenate (As(V)) formed in this system could be adsorbed onto the surface of MIL-101(Fe) with 84.14% of the total arsenic removal ratio. The main formed reactive oxygen species •OH and O2•–free radicals, attacked the As-C bond of ROX, generated As(V) and o-nitrophenol compounds and accelerated the removal process. The actual environment water matrix significantly promoted the removal ratio of ROX in this system.
roxarsone;Fe-based metal-organic framework;hydrogen peroxide;adsorption
X52
A
1000-6923(2022)01-0203-10
桑林凤(1999-),女,安徽霍邱人,华东师范大学硕士研究生,主要从事环境功能材料去除水体难降解有机污染物的研究.
2021-05-20
国家自然科学基金资助项目(21377039)
* 责任作者, 教授, ypzhao@des.ecnu.edu.cn

