PFOA与PFOS对厌氧氨氧化污泥特性和微生物群落的影响
唐琳钦,宿程远*,黄 娴,李汝婷,王安柳,樊翠萍,先云川
PFOA与PFOS对厌氧氨氧化污泥特性和微生物群落的影响
唐琳钦1,2,宿程远1,2*,黄 娴2,李汝婷2,王安柳2,樊翠萍2,先云川2
(1.广西师范大学珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541004;2.广西师范大学环境与资源学院,广西 桂林 541004)
通过序批实验研究了不同浓度(0.5,1mg/L)与不同类型的全氟化合物(PFCs)对厌氧氨氧化(anammox)污泥脱氮性能及微生物群落的影响.结果表明,0.5与1mg/L全氟辛酸(PFOA)和全氟辛烷磺酸盐(PFOS)对anammox污泥的脱氮性能无明显抑制作用;1mg/L PFOA(OA1)与PFOS(OS1)添加至anammox污泥中后1d,其去除率分别达到47.68%和92.7%.污泥的X射线光电子能谱(XPS)分析表明OA1、OS1实验组存在C-F、MgF2、CaF2等官能团.PFOA和PFOS胁迫下anammox污泥中血红素c浓度出现降低,OA1与OS1实验组分别降低了21.05%、7.5%.对不同实验组anammox污泥进行高通量测序分析表明,1mg/L PFOA和PFOS的添加会降低厌氧氨氧化菌但促进反硝化细菌的相对丰度,OA1、OS1实验组中属的相对丰度分别降低1.08%、0.28%,而不动杆菌属相对丰度增加1.73%与0.06%.整体而言,PFOA对anammox污泥的负面影响更为明显.
全氟辛酸;全氟辛烷磺酸盐;厌氧氨氧化;污泥特性;微生物群落
全氟化合物(PFCs)是碳氢化合物中的氢原子被氟取代而形成的化合物,全氟辛酸(PFOA)和全氟辛烷磺酸盐(PFOS)是典型的PFCs,两者主要产生于涂料、润滑剂、杀虫剂等产品的生产过程中[1-2].由于PFOA与PFOS含有共价键C-F,因此具有较强的化学稳定性从而在环境中具有高度持久性与生物累积性[3].由于PFCs的化学持久性、生物放大作用和潜在毒性,其越来越受到人们的广泛关注.PFOA和PFOS的广泛应用导致两者不可避免在污水处理厂中积累.目前,全球诸多污水处理厂、地表水中均检出了PFOA与PFOS[4].
目前PFOA和PFOS主要处理方法有电化学氧化法、臭氧氧化法、光催化氧化法、吸附法、生物处理法等[3].生物处理法是污水处理厂采用的主流工艺,具有稳定、经济等优点.Chiavola等[4]的研究表明,使用活性污泥法去除200~4000ng/L的PFOA和PFOS时,两者在液相中去除率分别达到59%~68%和66%~96%.Yang等[2]研究发现好氧颗粒污泥法可去除废水中32%~36.4%的PFOA,但1mg/L PFOA会抑制微生物聚羟基链烷酸酯与糖原的转化,并降低亚硝化单胞菌属()、硝化螺旋菌属()等细菌的相对丰度,可见PFCs可被生物处理法去除却会对微生物造成一定的不利影响.Yu等[5]研究了PFOA对活性污泥工艺的影响,发现PFOA浓度达到20mg/L时会抑制微生物的生长从而影响溶解性有机碳的去除.厌氧氨氧化(anammox)是在厌氧环境中,微生物以亚硝酸盐为电子受体,将氨直接氧化为氮气的自养过程,可节省碳源与运行成本,被认为是最有前途的脱氮处理技术之一[6].然而随着工业的发展,越来越多的新型污染物诸如纳米金属、抗生素等出现在污水处理厂中,对anammox工艺的稳定运行提出新挑战.Zhang等[7]发现anammox菌暴露在5mg/L CuNPs下,相对丰度由29.59%下降至17.53%.Du等[8]发现5~7mg/L的磺胺二甲嘧啶会抑制anammox菌活性,并使丰度从2.57%降低至0.39%.
本文研究了不同浓度、类型的PFCs对anammox污泥脱氮性能的影响;同时采用高效液相色谱-质谱法(HPLC-MS)分析了anammox污泥对PFOA与PFOS的去除效率;并利用X射线光电子能谱(XPS)与三维荧光光谱(3D-EEM)研究了PFOA和PFOS对anammox污泥官能团及胞外聚合物(EPS)组分的影响.最后,利用16S rRNA扩增子测序分析了anammox污泥中微生物群落与功能代谢在PFOA和PFOS胁迫下的演替情况,从而为厌氧氨氧化体系的稳定运行提供一定的科学借鉴.
1 材料与方法
1.1 实验方法
实验所用anammox污泥取自实验室运行180d的厌氧折流板反应器.实验所用PFOA购自Adamas, PFOS购自江西国化化工.所用废水为人工配置废水,包括50mg/L NH4Cl、65mg/L NaNO2、58.6mg/L MgSO4·7H2O、840mg/L NaHCO3、73.5mg/L CaCl·2H2O,以及100mg/L Na2SO3作为脱氧剂,此外还加入1.25mL/L微量元素I和微量元素II[9].
序批实验在5个500mL锥形瓶中进行,锥形瓶内均含有150mL anammox污泥及350mL废水.参考文献[10],在本实验确定0.5, 1mg/L的PFOA和PFOS.实验中对照组(CT)不添加PFCs,OA0.5、OA1、OS0.5、OS1实验组分别添加0.5mg/L PFOA、1mg/L PFOA、0.5mg/L PFOS、1mg/L PFOS[3].实验周期40d,每天进水量350mL,水力停留时间24h, pH值控制在7.5~8.0,原水DO浓度在0.5mg/L以下.实验中锥形瓶封口处理并置于35℃恒温震荡器中,1~3d时震荡速度160r/min,在该震荡速度下硝酸盐高度积累,为使厌氧氨氧化细菌处于合适的生存环境,对震荡速度适当调整,4~8d时震荡速度100r/min,9~40d时震荡速度120r/min[2].每天测定进水与出水氨氮、亚硝酸盐氮及硝酸盐氮浓度;每隔4d分析PFOA与PFOS去除情况;此外分别于第0, 40d取出一定量anammox污泥用于EPS、血红素c的测定;实验结束时通过16S rRNA扩增子测序对不同实验组的微生物群落结构进行分析.
1.2 分析方法
水样经0.45 μm滤膜过滤后使用纳氏试剂分光光度法,N-(1-萘基)-乙二胺光度法分光光度法及紫外分光光度法分别测定其氨氮,亚硝酸盐氮及硝酸盐氮浓度.X射线光电子能谱仪(Thermo scientific, 250Xi)用于anammox污泥表面官能团分析,将实验结束后(40d)的污泥于105℃下干燥24h进行XPS分析,测试束斑为500 μm,全谱通过能100eV,步长1.0eV,窄谱通过能30eV,步长0.06eV[9].污泥胞外聚合物(EPS)的提取采用热提取法,并将松散型胞外聚合物(LB-EPS)与紧致型胞外聚合物(TB-EPS)用于EEM光谱分析(日立-F7000),仪器发射波长和激发波长为5nm,扫描速度为2400r/min[11]. Anammox污泥中血红素c的测定采用吡啶分光光度法,于波长549nm处测定其吸光度并计算血红素c浓度[12].
液相色谱串联质谱仪(Agilent Q-TOF 6545B)用于水样及anammox污泥中PFOA、PFOS浓度的测定;LC-MS所用色谱柱为ZORBAX Eclipse plus c18,流动相A为乙腈,流动相B为5mmol/L乙酸铵; LC-MS扫描时间为6min,流速0.2mL/min,0~2.5min流动相A与B的体积比例为58:42,2.5~4min流动相A与B的体积比例为5:95,4~6min流动相A与B的体积比例恢复到58:42.污泥中PFOA、PFOS的提取方法:取一定量anammox泥水混合物于5mL离心管,于6000r/min离心5min弃去上清液,置于2mL甲醇溶液中,超声破碎1h后于6000r/min离心5min,取上清液进行测定[4].
1.3 16S rRNA扩增子测序
实验结束后对CT、OA1、OS1组的anammox污泥进行16S rRNA扩增子测序,使用Mag-Bind土壤DNA试剂盒(EZNATM,OMEGA,美国)提取污泥的DNA,DNA完整性通过1%琼脂糖凝胶电泳验证并使用Qubit定量检测DNA样本浓度[13].PCR一轮扩增所用引物为V3-V4通用引物341F(CCTACGGGNG- GCWGCAG)和805R(GACTACHVGGGTATCTAA- TCC)[14];第二轮扩增引入Illumina桥式PCR兼容引物[15].Illumina Miseq™/Hiseq™得到的原始图像数据文件经碱基识别分析转化为原始测序序列[16].然后对各样本数据的质量进行质控过滤,得到各样本有效数据,之后再进行OTU聚类分析和物种分类学分析.此外KEGG(基因和基因组京都百科全书)数据库被用来预测anammox污泥中相关代谢功能预测分析[14].
2 结果与讨论
2.1 脱氮性能影响
首先分析了不同浓度PFOA与PFOS污染下,anammox污泥对氨氮、亚硝酸盐氮去除及硝酸盐氮生成的情况,结果如图1所示.
由图1A可知,CT对照组与OA0.5(0.5mg/L PFOA)、OA1(1mg/L PFOA)、OS0.5(0.5mg/L PFOS)、OS1(1mg/L PFOS)实验组氨氮去除率变化趋势基本一致,1~3d时振荡器震荡速度为160r/min,5个实验组氨氮去除率均达86%以上,去除率相对稳定,这表明PFOA与PFOS对氨氮去除并未产生急性抑制作用.4~8d时,CT、OA0.5、OA1、OS0.5、OS1的氨氮平均去除率降低至51.48%、53.43%、72.65%、63.21%和61.43%,在此阶段氨氮去除率均明显下降,可能是anammox污泥中细菌活性受到一定抑制导致.9~40d时振荡器震荡速度为120r/min,CT、OA0.5、OA1、OS0.5、OS1对氨氮去除率基本保持在98%左右,这表明PFOA、PFOS的添加对anammox污泥除氨氮能力并未产生不利影响.由图1B可知,CT、OA0.5、OA1、OS0.5、OS1各组对亚硝酸盐氮去除率变化趋势与氨氮基本一致,1~3d时,5个实验组的亚硝酸盐氮去除率均达到76%以上;在4~10d时亚硝酸盐氮去除率明显降低,亚硝酸盐氮平均去除率分别为41.19%、43.88%、51.12%、51.40%、37.41%,以OS1实验组降低的最为明显.而11d以后,对照组与实验组对亚硝酸盐氮的去除效率逐渐升高, 13~40d时各组去除率均达到97%以上.

根据Strous提出的anammox反应方程,硝酸盐氮/氨氮理论物质的量比为0.26[17],对不同实验组出水硝酸盐氮/氨氮与硝酸盐氮/亚硝酸盐氮进行分析,如图2所示.硝酸盐氮/氨氮在1~3d内持续增大,表明震荡速度为160r/min时,反应器内的硝酸盐氮浓度增加,这可能是由于过高的震荡速度使得反应器中废水溶解氧含量增加导致.4~8d时震荡速度为100r/min,此时硝酸盐氮/氨氮明显下降同时伴随着氨氮、亚硝酸盐去除率大幅下降,对照组与实验组的硝酸盐氮/氨氮最低为0.082. 9~40d时振荡器震荡速度为120r/min,而硝酸盐氮/氨氮缓慢增加,此阶段硝酸盐氮/氨氮维持在0.77~1.11之间,超过理论物质的量比,这表明出水硝酸盐氮浓度增加.9~40d时CT对照组与4个实验组的氨氮、亚硝酸盐去除率也逐渐升高并达到稳定状态是其转化成硝酸盐氮所致.CT对照组与4个实验组硝酸盐氮/亚硝酸盐氮的变化趋势与硝酸盐氮/亚硝酸盐氮的变化趋势基本一致.

图2 硝酸盐氮与氨氮、亚硝酸盐氮的比值
2.2 全氟化合物的去除
PFOA和PFOS分别具有亲水性官能团羧基和磺酸基,使PFOA和PFOS具有一定的水溶性,其中PFOA、PFOS的溶解度分别为3.4和0.54g/L[4],为更好评价PFOA与PFOS的去除情况,本文对出水及污泥中的PFOA和PFOS进行了测定,结果如图3所示.
由图3可知,第1d时,OA0.5、OA1实验组对PFOA的去除率分别为49.86%、47.68%, OA0.5、OA1实验组PFOA在污泥相的比例为45.67%和46.48%,此外OA0.5、OA1中PFOA的量均有不同程度损失,其比例分别为1.2%,4.19%.而第5d以后PFOA去除率降低并维持在18.43%~29.17%之间,表明添加PFOA的初始,anammox污泥对PFOA具有一定吸附能力,而持续添加PFOA会降低anammox污泥的吸附能力.OS0.5、OS1实验组在添加PFOS的1d后,PFOS去除率高达91.5%和92.7%,而第9d后污泥对PFOS的吸附能力逐渐趋于饱和,此时OS0.5、OS1实验组的PFOS去除率降低至49.08%以下.在添加PFOS的17d后,PFOS的去除率相对平稳,OS0.5、OS1实验组的PFOS平均去除率分别为26.94%和24.83%.此外OS0.5、OS1实验组的PFOS在污泥相的比例高达88.77%和89.8%,这表明添加PFOS1d后,anammox污泥吸附PFOS的能力较PFOA更强.污泥对PFOA和PFOS的吸附可归因于阳离子架桥作用与疏水作用,污水及污泥中的带正电的Ca2+与Mg2+作为阳离子连接带负电的PFOA和PFOS,从而实现PFCs被污泥吸附[18];同时PFOA和PFOS具有羧基和磺酸基及较长的C-F主链,溶解在水相的PFCs会与anammox污泥发生疏水作用而被吸附.由于PFOS比PFOA具有更多C-F键(多2个)故具有更强疏水能力[19],从而与anammox污泥间具有更强的亲和力.

图3 PFOA与PFOS的去除率及分布情况
堆积条形图为添加PFCs一天后,PFCs的分布比例
2.3 污泥官能团分析
为分析PFOA与PFOS对污泥表面官能团的影响,使用XPS光谱对对照组与OA1、OS1实验组anammox污泥中C、N、F元素进行分析,结果如图4所示.

图4 污泥的XPS谱图分析
图4表明OA1、OS1实验组污泥中存在多种含氟官能团,其中688.5~688.9eV处出现的峰为PFOA、PFOS中含有的C-F[20],且OS1组C-F键的峰面积明显大于OA1,这说明OS1组anammox污泥中吸附了较多PFOS;685.9~686.2,684.4~685eV处出现的峰分别为MgF2、CaF2[21],这表明anammox污泥中的Mg2+、Ca2+可通过阳离子架桥连接带负电荷的anammox污泥及2种PFCs;此外OS1组在683eV处还存在KF官能团[22],说明PFOS对anammox污泥的亲和力更高.C1s由3~4种官能团组成,其中284.8, 286.3,288eV处出现的峰分别为C-C、C-O-C、C=O[2];另外CT、OS1组在289, 289.4eV出现的峰为-COOH[2].在399.9, 401.8~401.9eV附近处存在2个峰,399.9eV处出现的峰归因于非质子化氨基(-NH),而401.8~401.9eV处的峰与质子化的氨基有关(-NH3+)[23].
2.4 污泥EPS的3D-EEM分析
胞外聚合物(EPS)是微生物产生的由蛋白质与多糖等组成的高分子聚合物,具有较强的吸附能力且能保护细菌免受有毒物质的影响,主要可分为松散型胞外聚合物(LB-EPS)和紧密型胞外聚合物(TB-EPS),两者空间分布和理化特性不同[24-25].

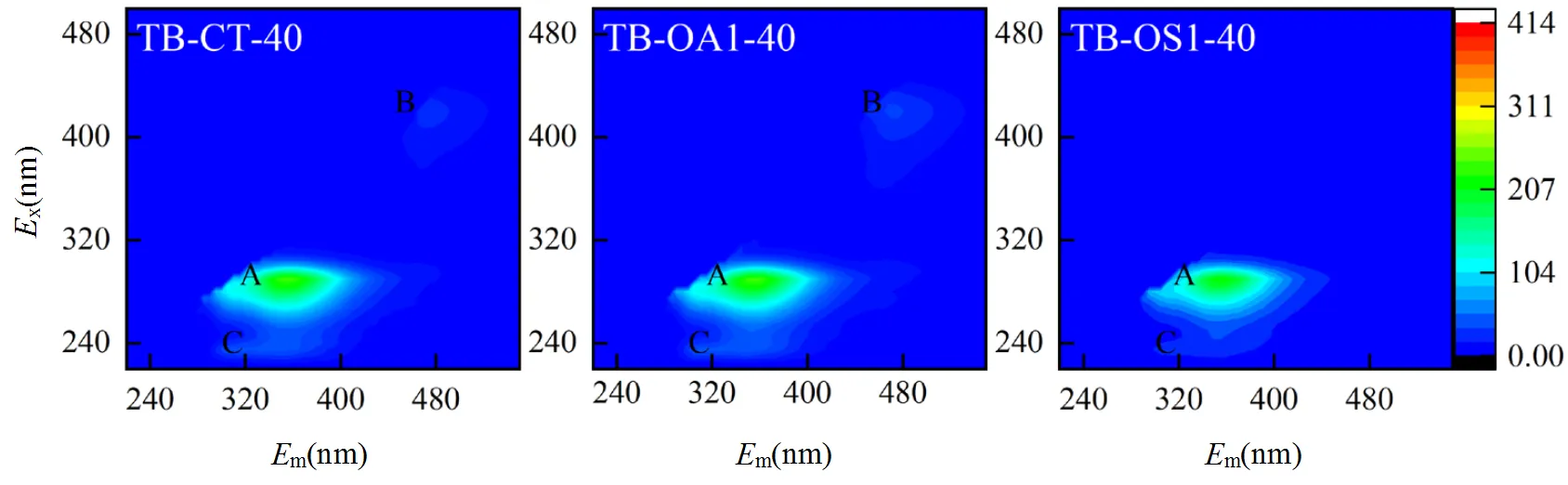
图5 不同实验组污泥LB-EPS和TB-EPS的3D-EEM谱图
由图5可知,第0d时,CT、OA1、OS1组的LB- EPS在x/m=280/345~350nm和x/m=420/ 475nm处存在色氨酸(峰A)和辅酶F420(峰B)2个主峰[26-27].其中CT、OA1、OS1类色氨酸荧光峰强度存在一定差异,分别为62.11,69.11,76.34,可能是由于实验之初anammox污泥间混合不匀所致.此外在x/m=230/305~310nm、x/m=270/470nm处存在芳香族蛋白质(峰C)、黄腐酸(峰D)荧光峰[26].第40d时,CT、OA1、OS1组色氨酸荧光峰强度均有不同程度降低,分别降低14.2%、28.9%、23.52%. TB-EPS的EEM谱图中主要存在色氨酸峰(峰A)和辅酶F420(峰B)2种荧光峰.第0d时色氨酸荧光峰强度较高,CT对照组与OA1、OS1实验组峰A的荧光强度达到302.9,332.9,318.1,而到第40d时,CT、OA1、OS1组色氨酸峰强度分别降低21%、27.7%、31.1%.这表明添加PFCs会降低anammox污泥色氨酸的分泌,且PFOA对污泥色氨酸的分泌所产生负面影响更为明显.污泥的疏水作用主要与污泥中疏水性氨基酸(色氨酸、丙氨酸、苯丙氨酸等)、腐殖酸、富里酸中的芳香族、脂环族及污泥中的脂质有关[28].各组污泥的EEM谱图表明,相较于CT对照组,PFCs的存在使LB-EPS、TB-EPS中色氨酸荧光峰强度降低更显著,可能是PFCs与EPS中色氨酸发生疏水作用所导致.
2.5 污泥血红素c含量
厌氧氨氧化污泥具有红色特征主要是由于具有细胞色素c,细胞色素c包含血红素c,当二价铁和三价铁间转换时,血红素c能够被氧化和还原,因此可通过确定血红素c含量来估算anammox污泥的细胞色素c含量[29].Shi等[30]研究表明当厌氧氨氧化反应器中土霉素浓度为2mg/L时,特定厌氧氨氧化活性(SAA)降低81.3%,同时血红素c浓度降低50.1%,这说明血红素c的浓度与SAA存在联系,因此本文分析了PFOA与PFOS对anammox污泥中血红素c含量的影响,结果如图6所示.
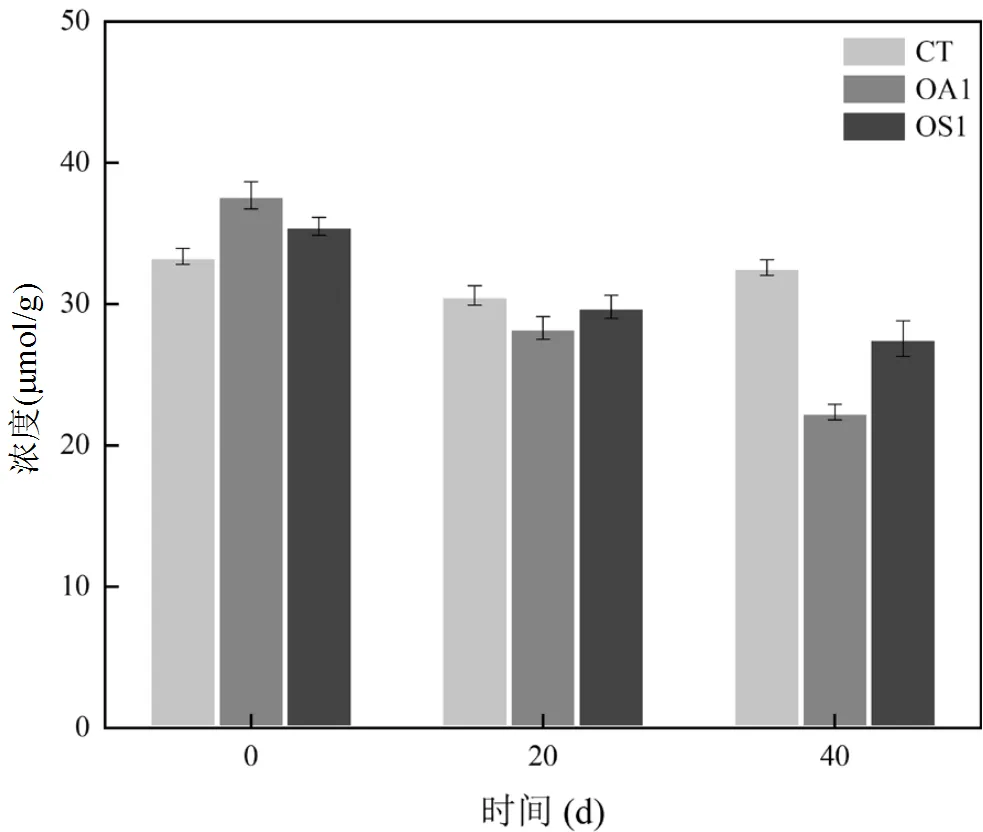
图6 PFOA与PFOS对血红素c含量的影响
由图6可知,在未添加PFCs之前,OA1组的血红素c含量最高,而添加PFCs后的第20d,CT、OA1、OS1的血红素c含量均有不同程度降低,分别降低了2.77,9.39,5.7 μmol/g.添加PFCs后的第40d,CT对照组血红素c含量出现回升,而OA1、OS1实验组继续降低,降低幅度分别为21.05%和7.5%.因此添加PFCs之后会降低anammox污泥血红素c的含量,以PFOA最为显著,说明1mg/L的PFCs抑制了厌氧氨氧化污泥的氧化活性.
2.6 微生物群落分析
由图7可知,变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)在各组微生物群落中占主导地位,另外还存在装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)等.变形菌门与绿弯菌门是反硝化过程中主要细菌,据报道PFCs可促进变形菌门与绿弯菌门相对丰度增加[10,31].添加1mg/L的PFOA与PFOS使变形菌门相对丰度分别增加3.92%与0.32%,OA1中绿弯菌门的相对丰度增加2.01%,这表明添加PFCs促进了反硝化细菌的生长.此外OA1组变形菌门与绿弯菌门的丰度较OS1组增加比例更高,可能归因于PFOA C-F键更少而更好地被利用.拟杆菌属具有较好的代谢能力,可以适应恶劣的环境,酸杆菌门是一种有机物水解细菌[10].添加1mg/L的PFOA和PFOS后拟杆菌门、酸杆菌门相对丰度分别增加0.49%和0.24%、0.24%与0.06%,这与先前的研究相一致[10,31].目前已知的厌氧氨氧化菌属于浮霉菌门[32],PFCs的存在降低了浮霉菌门相对丰度,相对于CT组,OA1、OS1实验组中浮霉菌门比例分别降低1.38%、0.52%.

图7 门水平与属水平细菌的相对丰度
甲烷丝菌属()、不动杆菌属()、甲烷杆菌属 ()在属水平上为优势菌群,此外还存在、、等具有脱氮能力的菌群.高丰度的甲烷丝菌属、甲烷杆菌属与驯化污泥有关[9].据报道不动杆菌属和属能进行异养硝化和好氧反硝化[33-34].此外是一种多功能氮代谢细菌,常发现于自养反硝化与异养反硝化反应器中[35],是一种自养反硝化细菌[36]1mg/L的PFOA与PFOS使不动杆菌属、的相对丰度增加1.73%与0.06%、0.65%与0.98%,而、分别增加0.55%与0.22%、0.65%和0.33%,这表明添加PFCs会促进反硝化细菌的相对丰度.相较于与等厌氧氨氧化细菌,具有更高的生长速度与亚硝酸盐半饱合常数.1mg/L PFOA、1mg/L PFOS的存在使的相对丰度降低1.08%、0.28%.总体而言,PFCs的存在能够刺激反硝化细菌而抑制厌氧氨氧化菌生长.可能是PFCs能被反硝化菌作为碳源而被生物利用,而厌氧氨氧化细菌由于生长速度慢且对环境因素更敏感,具有生物毒性的PFCs添加至厌氧氨氧化体系中会使其被PFCs所抑制.
2.7 KEGG分析
由图8可知,KEGG通路图显示对照组和OA1、OS1实验组中主要有4个一级通路:代谢(41.43%~ 42.03%)、基因信息处理(17.48%~17.73%)、环境信息处理(12.81%~9.13.48%)和细胞过程(3.26%~ 4.02%).代谢主要以氨基酸代谢(9.56%~9.88%)、碳水化合物代谢(10.26%~10.54%)为主.相对于对照组,OA1实验组的氨基酸代谢、碳水化合物代谢、多糖生物合成的丰度分别增强0.015%、0.073%、0.067%,而能量代谢的比例减少0.27%.1mg/L PFOS的添加使得氨基酸代谢和能量代谢能力增强(0.016%和0.109%),而碳水化合物代谢、多糖生物合成和代谢的能力略微降低.氨基酸代谢和碳水化合物代谢是污泥中的主要代谢路径,这与污泥去除氮素与有机污染物有直接关系[37-38].PFCs的添加使OA1、OS1实验组anammox污泥的氨基酸代谢能力得到增加,但污泥中的血红素c含量与浮霉菌门丰度出现了降低,从而解释了添加有PFCs的OA1、OS1实验组对氨氮、亚硝酸盐氮去除效果和CT对照组无明显差异的现象.

图8 PFOA与PFOS对KEGG代谢途径的影响
3 结论
3.1 PFOA与PFOS的浓度为0.5与1mg/L时,对anammox污泥去除氨氮、亚硝酸盐氮的效率并无明显抑制;由于PFOS更高的疏水性,anammox污泥对PFOS的去除率高于PFOA,其中污泥的吸附作用占有较大比例.
3.2 PFOA和PFOS的添加会降低污泥C-C、C- O-C等官能团的比例,而会增加C=O的比例;PFOA和PFOS会降低LB-EPS、TB-EPS中色氨酸峰的强度;同时PFOA、PFOS胁迫下使污泥中血红素c的浓度出现降低,PFOA的抑制作用更为明显.
3.3 PFOA与PFOS胁迫下,厌氧氨氧化菌相对丰度降低,特别是PFOA影响下,的相对丰度降低了1.08%,但PFOA与PFOS的存在促进反硝化细菌相对丰度及氨基酸代谢能力.
[1] Gong X, Yang C X, Hong Y J, et al. PFOA and PFOS promote diabetic renal injury in vitro by impairing the metabolisms of amino acids and purines [J]. Science of the Total Environment, 2019,676:72-86.
[2] Yang G J, Zhang N, Yang J N, et al. Interaction between perfluorooctanoic acid and aerobic granular sludge [J]. Water Research, 2020,169:115249.
[3] 张春晖,刘 育,唐佳伟,等.典型工业废水中全氟化合物处理技术研究进展 [J]. 中国环境科学, 2021,41(3):1109-1118.
Zhang C H, Liu Yu, Tang J W, et al. Progress of research on treatment technology of perfluorinated compounds in typical industrial wastewater [J].China Environmental Science, 2021,41(3):1109-1118.
[4] Chiavola A, Di Marcantonio C, Boni M R, et al. Experimental investigation on the perfluorooctanoic and perfluorooctane sulfonic acids fate and behaviour in the activated sludge reactor [J]. Process Safety and Environmental Protection, 2020,134:406-415.
[5] Yu X, Nishimura F, Hidaka T. Impact of long-term perfluorooctanoic acid (PFOA) exposure on activated sludge process [J]. Water Air & Soil Pollution, 2018,229:134-145.
[6] Chen R, Takemura Y, Liu Y, et al. Using partial nitrification and anammox to remove nitrogen from low-strength wastewater by co-immobilizing biofilm inside a moving bed bioreactor [J]. ACS Sustainable Chemistry & Engineering, 2019,7:1353-1361.
[7] Zhang Z Z, Hu H Y, Xu J J, et al. Susceptibility, resistance and resilience of anammox biomass to nanoscale copper stress [J]. Bioresource Technology, 2017,241:35-43.
[8] Du L F, Cheng S J, Hou Y Q, et al. Influence of sulfadimethoxine (SDM) and sulfamethazine (SM) on anammox bioreactors: Performance evaluation and bacterial community characterization [J]. Bioresource Technology, 2018,267:84-92.
[9] Tang L Q, Su C Y, Chen Y, et al. Influence of biodegradable polybutylene succinate and non-biodegradable polyvinyl chloride microplastics on anammox sludge: Performance evaluation, suppression effect and metagenomic analysis [J]. Journal of Hazardous Materials, 2021,401:123337.
[10] Ji J, Peng L, Redina M M, et al. Perfluorooctane sulfonate decreases the performance of a sequencing batch reactor system and changes the sludge microbial community [J]. Chemosphere, 2021,279:130596.
[11] Zhao L J, Su C Y, Liu W H, et al. Exposure to polyamide 66microplastic leads to effects performance and microbial community structure of aerobic granular sludge [J]. Ecotoxicology and Environmental Safety, 2020,190:110070.
[12] Ma H Y, Zhang Y L, Xue Y, et al. Relationship of heme c, nitrogen loading capacity and temperature in anammox reactor [J]. Science of the Total Environment, 2019,659:568-577.
[13] Deng Q J, Su C Y, Lu X Y, et al. Performance and functional microbial communities of denitrification process of a novel MFC-granular sludge coupling system [J]. Bioresource Technology, 2020,306: 123173.
[14] Qin R H, Su C Y, Liu W H, et al. Effects of exposure to polyether sulfone microplastic on the nitrifying process and microbial community structure in aerobic granular sludge [J]. Bioresource Technology, 2020,302:122827.
[15] 赵立君,刘云根,王 妍,等.砷污染湖滨湿地底泥微生物群落结构及多样性 [J]. 中国环境科学, 2019,39(9):3933-3940.
Zhao L J, Liu Y G, Wang Y et al. Microbial community structure and diversity of arsenic-contaminated lakeshore wetland sediments [J].China Environmental Science, 2019,39(9):3933-3940.
[16] Ucar D, Yilmaz T, Di Capua F, et al. Comparison of biogenic and chemical sulfur as electron donors for autotrophic denitrification in sulfur-fed membrane bioreactor (SMBR) [J]. Bioresource Technology, 2020,299:122574.
[17] Strous M, Heijnen S, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50:589-596.
[18] Zhou Q, Deng S B, Zhang Q Y, et al. Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated sludge [J]. Chemosphere, 2010,81:453-458.
[19] Arvaniti O S, Andersen H R, Thomaidis N S, et al. Sorption of perfluorinated compounds onto different types of sewage sludge and assessment of its importance during wastewater treatment [J]. Chemosphere, 2014,111:405-411.
[20] Zhang K l, Huang J, Yu G, et al. Destruction of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) by ball milling [J]. Environmental Science & Technology, 2013,47:6471-6477.
[21] Briggs D. Handbook of x-ray and ultraviolet photoelectron spectroscopy [M]. Cheshire, England: ICI Ltd Corporate Laboratory Runcom, 1997:387-391.
[22] Wagner C D. Studies of the charging of insulators in ESCA [J]. Journal of Electron Spectroscopy and Related Phenomena, 1980,18:345-349.
[23] Zhang B A Q, Zhao Z W, Chen N, et al. Insight into efficient phosphorus removal/recovery from enhanced methane production of waste activated sludge with chitosan-Fe supplementation [J]. Water Research, 2020,187:116427.
[24] Jiang X Y, Cheng Y F, Zhu W Q, et al. Effect of chromium on granule-based anammox processes [J]. Bioresource Technology, 2018,260:1-8.
[25] Wang W G, Yan Y, Zhao Y H, et al. Characterization of stratified EPS and their role in the initial adhesion of anammox consortia [J]. Water Research, 2020,169:115223.
[26] Ding A, Wang J L, Lin D C, et al. In situ coagulation versus pre- coagulation for gravity-driven membrane bioreactor during decentralized sewage treatment: Permeability stabilization, fouling layer formation and biological activity [J]. Water Research, 2017,126: 197-207.
[27] Deng Q J, Su C Y, Lu X Y, et al. Performance and functional microbial communities of denitrification process of a novel MFC-granular sludge coupling system [J]. Bioresource Technology, 2020,306: 123173.
[28] Xiao K, Abbt-Braun G, Horn H, et al. Changes in the characteristics of dissolved organic matter during sludge treatment: A critical review [J]. Water Research, 2020,187:116441.
[29] Kang D, Li Y Y, Xu D D, et al. Deciphering correlation between chromaticity and activity of anammox sludge [J]. Water Research, 2020,185:116184.
[30] Shi Z J, Hu H Y, Shen Y Y, et al. Long-term effects of oxytetracycline (OTC) on the granule-based anammox: Process performance and occurrence of antibiotic resistance genes [J]. Biochemical Engineering Journal, 2017,127:110-118.
[31] Cai Y P, Chen H L, Yuan R F, et al. Metagenomic analysis of soil microbial community under PFOA and PFOS stress [J]. Environmental Research, 2020,188:109838.
[32] 张志强,关 笑,吕 锋,等.悬浮填料对厌氧氨氧化MBR运行的影响特性及机理[J]. 中国环境科学, 2018,38(3):929-934.
Zhang Z Q, Guang X, Lv F, et al. Influencing characteristics and mechanisms of suspended carriers on anammox MBR performance [J].China Environmental Science, 2018,38(3):929-934.
[33] 王秀杰,王维奇,李 军,等.异养硝化菌Acinetobacter sp.的分离鉴定及其脱氮特性[J]. 中国环境科学, 2017,37(11):4241-4250.
Wang X J, Wang W Q, Li J, et al. Isolation and identification of a heterotrophic nitrifier,sp., and its characteristics of nitrogen removal [J].China Environmental Science, 2017,37(11): 4241-4250.
[34] Qiao Z X, Sun R, Wu Y G, et al. Characteristics and metabolic pathway of the bacteria for heterotrophic nitrification and aerobic denitrification in aquatic ecosystems [J]. Environmental Research, 2020,191:110069.
[35] Zhang S C, Zhang Z J, Xia S B, et al. The potential contributions to organic carbon utilization in a stable acetate-fed Anammox process under low nitrogen-loading rates [J]. Science of the Total Environment, 2021,784:147150.
[36] Ma Y H, Zheng X Y, He S B, et al. Nitrification, denitrification and anammox process coupled to iron redox in wetlands for domestic wastewater treatment [J]. Journal of Cleaner Production, 2021,300: 126953.
[37] Kong Z J, Wang X Q, Wang M M, et al. Bacterial ecosystem functioning in organic matter biodegradation of different composting at the thermophilic phase [J]. Bioresource Technology, 2020,317: 123990.
[38] Gao Y Y, Li J, Dong H Y, et al. Nitrogen removal mechanism of marine anammox bacteria treating nitrogen-laden saline wastewater in response to ultraviolet (UV) irradiation: High UV tolerance and microbial community shift [J]. Bioresource Technology, 2021,320: 124325.
Evaluation of sludge characteristics and microbial community of anammox sludge during exposure to perfluorooctane acid and perfluorooctane sulfonate.
TANG Lin-qin1,2, SU Cheng-yuan1,2*, HUANG Xian2, LI Ru-ting2, WANG An-liu2, FAN Cui-ping2, XIAN Yun-chuan2
(1.Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection, Ministry of Education, Guangxi Normal University, Guilin 541004, China;2.School of Environment and Resources, Guangxi Normal University, Guilin 541004, China)., 2022,42(1):194~202
The sequential batch experiments explored the influence mechanism under different concentrations (0.5mg/L and 1mg/L) and types of perfluorinated compounds (PFCs) on the denitrification performance and microbial community of anaerobic ammonia oxidation (anammox) sludge. Results indicated that perfluorooctanoic acid (PFOA) (at 0.5mg/L, 1mg/L) and perfluorooctane sulfonate (PFOS) had no obvious inhibitory effect on the denitrification performance of the anammox sludge. The addition of 1mg/L PFOA (OA1) and PFOS (OS1) to the anammox sludge for one day resulted in removal rates of respectively 47.68% and 92.7%. X-ray photoelectron spectroscopy (XPS) analysis of the sludge showed the presence of C-F, MgF2, CaF2functional groups in the OA1 and OS1 groups. The addition of PFOA and PFOS reduced the concentration of heme c in the anammox sludge by respectively 21.05% and 7.5%. The high-throughput sequencing analysis of the anammox sludge in different experimental groups showed that the addition of 1mg/L PFOA and PFOS could reduce the relative abundance of anammox bacteria and promote the relative abundance of denitrifying bacteria. The relative abundance ofin the OA1 and OS1 groups decreased by respectively 1.08% and 0.28%, while the relative abundance ofincreased by 1.73% and 0.06%. In general, the negative effects of PFOA on the anammox sludge were more significant than PFOS.
perfluorooctanoic acid;perfluorooctane sulfonate;anammox;sludge characteristics;microbial communities
X703.1
A
1000-6923(2022)01-0194-09
唐琳钦(1997-),男,广西桂林人,广西师范大学硕士研究生,研究方向为水处理技术.
2021-06-01
国家自然科学基金资助项目(52060003);广西师范大学科研育人项目(2020YR009)
* 责任作者, 教授, suchengyuan2008@126.com

