纳米银对蒙古黄芪种子和幼苗的毒性研究与数据挖掘分析
徐蓉蓉,高静,魏思敏,关思静,葛甜甜,王楠,*,唐志书,宋忠兴
1. 陕西中医药大学陕西中药资源产业化省部共建协同创新中心,咸阳 712083 2. 陕西中医药大学药学院,咸阳 712046
随着纳米技术的进步,纳米颗粒被广泛应用于生产生活中,并不可避免地被释放到环境中[1]。进入水中或土壤后,纳米颗粒的吸收、遗传毒性和细胞毒性等特性会发生一定的变化[2-3]。比如纳米银(AgNPs)释放到环境中,团聚状态、表面化学性质和电荷,以及释放Ag+的能力由于被氧化和硫化而发生改变,最后使得其持续性和毒性受到影响[4-5]。释放到环境中的纳米颗粒可被植物吸收,并运输到植物的根、茎、叶,甚至花和果实等部位,对植物各生长阶段造成影响。此外,一定数量的纳米颗粒可造成人体暴露。因此,在考虑进一步开发纳米技术的应用时必须确定纳米颗粒的安全性[6]。AgNPs因其广谱杀菌且无耐药性的特点使其应用广泛并成为研究的热点,关于其在植物方面的研究多集中于消极影响[7-9],但也不乏一些积极效应的研究存在。例如,对AgNPs在拟南芥中的积累和运输进行研究,发现AgNPs对根的毒性作用是受其大小和浓度影响[2]。而Hojjat和Kamyab[10]探究AgNPs在不同浓度的盐溶液对胡芦巴种子发芽和生长的作用,发现AgNPs的使用可以提高胡芦巴幼苗的耐盐性,其应用可能会刺激植物抵御盐毒的不同防御机制。研究发现AgNPs浓度为0.06~0.5 mg·L-1时在农业上具有重要的应用价值,可作为一种替代性的生态友好型小麦肥料[11]。
黄芪作为一味常用的补益药,目前主要依赖人工栽培。而作为中药材黄芪来源之一的蒙古黄芪为主流商品[12]。天气和土壤条件等外在环境因素都会严重影响黄芪药材的产量和质量。纳米颗粒会通过各种途径被释放到土壤中,其中一部分可能由黄芪根部吸收,然后在体内迁移、转运或者蓄积,这可能会对黄芪的生长产生一定影响。如果人们直接或间接食用了含有纳米颗粒的黄芪,可能会对人类健康造成潜在威胁。因此为模拟实际栽培种植中可能存在的问题和隐患,本实验以豆科黄芪属植物蒙古黄芪(Astragalusmembranaceus(Fisch.) Bge. var.mongholicus(Bge.) Hsiao,简写为Astragalusmongholicus)为研究对象,研究不同浓度的AgNPs溶液对蒙古黄芪种子萌发和幼苗生长的毒害作用,并基于数据进行分析。大数据分析涉及的领域越来越广泛,成为当前的研究热点。为探讨单一植物蒙古黄芪对AgNPs的响应是否符合大数据分析形成的趋势,本研究使用冗余分析和meta分析进行验证,比较二者预测结果与实际实验结果的差异,验证大数据分析的可靠性,旨在正确使用数学模型评价AgNPs的植物毒性,并为其实际应用提供依据。
1 材料与方法(Materials and methods)
1.1 实验材料与实验设计
实验选用大小均一、颗粒成熟饱满的蒙古黄芪种子。将供试种子用体积比为1∶3的过氧化氢∶纯净水消毒40 min,纯净水冲洗干净,备用。实验所用AgNPs粒径为40 nm,由陕西中医药大学陕西中药资源产业化省部共建协同创新中心提供。以不同浓度AgNPs溶液处理为实验组,纯净水处理为对照组,相同的处理设置6个重复,每日更换培养皿中滤纸和处理液,并观察蒙古黄芪种子的萌发和幼苗生长情况。将所有种子置于直径为90 mm的培养皿中,每个培养皿30粒种子,实验组分别加入10 mL不同浓度的AgNPs溶液,使之将滤纸完全湿润,对照组加入相同体积的纯净水,种子萌发的标志为露白。AgNPs溶液设置9个不同浓度:0、10、20、60、100、200、400、600和1 000 mg·L-1。整个实验过程在人工气候箱中完成,温度为25 ℃、光/暗周期为12 h/12 h、光照度为Ⅲ级和湿度为60%。
利用文献搜索网站Web of science、Google scholar和中国知网(CNKI),设定“纳米银(AgNPs、silver nanoparticles、Ag nanoparticles)”、“种子(seed)”、“幼苗(seedling)”、“萌发(germination)”、“生长(growth)”等为关键词进行文献收集,共收集到文献105篇。经筛选,符合我们分析条件的文献有英文文献16篇,中文文献2篇。
1.2 种子萌发指标与幼苗生长指标测定
每日观察并记录各培养皿中发芽种子数,至所有培养皿连续3 d无新种子萌发时停止观察,次日进行各指标测定。最终发芽率(total germination percentage, TGP)=发芽种子数/供试总种子数;平均发芽时间(mean of germination time, MGT)=∑[(nt×t)/n],其中nt为第t天的发芽数,n为最终发芽数。
萌发实验结束后,从各处理的各重复中随机取出9株幼苗,分别测定幼苗生理生化指标,包括胚根长(radicle length, RL)、胚轴长(hypocotyl length, HL)、子叶长(cotyledon length, CL)、子叶宽(cotyledon width, CW)、总鲜质量(total fresh weight, TFW)、总干质量(total dry weight, TDW)、叶绿素含量(chlorophyll content, Chl)和氮含量(nitrogen content)。将测完鲜质量的幼苗放置烘箱,80 ℃烘干至恒重。不同指标对AgNPs的耐受性不同,为了能更准确地比较AgNPs对蒙古黄芪的毒性作用,用AgNPs对各指标的抑制率表示,抑制率(inhibition rate, IR)=(1-处理组/对照组)×100%,IR<0表示具有促进作用,IR≥0表示具有抑制作用。IR的绝对值越大,表示促进或抑制作用越大。
每个处理中选取长势较好的幼苗,分别取其地上和地下部分进行过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)含量测定,分别用CATS、CATR、PODS、PODR、SODS、SODR表示。CAT采用紫外吸收法、POD采用愈创木酚法、SOD含量测定采用氮蓝四唑(NBT)光还原法分别进行含量测定。
1.3 数据处理
测定得到16个种子萌发和幼苗生长评价指标:最终发芽率(TGP,X1)、平均发芽时间(MGT,X2)、胚根长(RL,X3)、胚轴长(HL,X4)、子叶长(CL,X5)、子叶宽(CW,X6)、总鲜质量(TFW,X7)、总干质量(TDW,X8)、叶绿素含量(Chl,X9)、氮含量(N,X10)、地上过氧化氢酶(CATS,X11)、地下过氧化氢酶(CATR,X12)、地上过氧化物酶(PODS,X13)、地下过氧化物酶(PODR,X14)、地上超氧化物歧化酶(SODS,X15)和地下超氧化物歧化酶(SODR,X16)。为验证实验结果的准确性,查阅AgNPs对植物种子和幼苗影响的相关文献,并搜集整理数据,同样得到16个评价指标:最终发芽率(TGP)、幼苗总长度(TL)、根长(RL)、根鲜质量(RFW)、根干质量(RDW)、茎长(SL)、茎鲜质量(SFW)、茎干质量(SDW)、幼苗总鲜质量(TFW)、幼苗总干质量(TDW)、叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chl)、过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)。
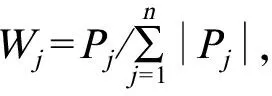
2 结果与分析(Results and analysis)
2.1 AgNPs对黄芪种子萌发的影响
由图1(a)和(b)可知,在不同浓度AgNPs溶液中,蒙古黄芪种子的萌发受到不同程度的抑制,最终发芽率随着AgNPs浓度的升高而降低。在浓度10~400 mg·L-1的范围内,与对照组相比,处理组最终发芽率降低;而在浓度达到600 mg·L-1和1 000 mg·L-1时,最终发芽率显著降低(P<0.05),在1 000 mg·L-1时,出现最低值,为8.67%。由图1(c)可知,浓度10~400 mg·L-1的处理与对照组的发芽时间无显著性差异;而浓度为600 mg·L-1和1 000 mg·L-1时平均发芽时间显著高于其他处理组(P<0.05),且600 mg·L-1的平均发芽时间最长,为5.50 d。
2.2 AgNPs对黄芪幼苗生长和抗氧化酶系统的影响
实验过程中,浓度为10~400 mg·L-1的AgNPs对蒙古黄芪幼苗的生长无影响,但随着浓度的升高,在观察后期其生长受到影响。浓度为600 mg·L-1时在观察第11天幼苗开始陆续出现茎叶失水并腐烂的现象,至观察结束时,叶绿素、氮含量和抗氧化酶等指标已无法进行测量;而1 000 mg·L-1时,种子发芽后的生长受到严重抑制,胚根突出后,伸长非常缓慢,且在观察第9天时,发芽的种子开始腐烂发霉,观察结束时,生理生化指标已无法测量。

图1 AgNPs对蒙古黄芪种子累计发芽率(a)、最终发芽率(b)和平均发芽时间(c)的影响注:柱状图和折线图上不同小写字母表示所有处理在P<0.05水平与对照组相比差异显著;下同。Fig. 1 Effects of AgNPs on the cumulative germination rate (a), total germination percentage (b) and mean of germination time (c) of A. mongholicus seeds Note: Values with different lowercase letters on the line and bars chart represent all treatments are significantly different from control at P<0.05; the same below.
由图2可知,当浓度为400~1 000 mg·L-1时,胚根伸长受到抑制,显著低于对照组(P<0.05);除1 000 mg·L-1外,各处理间胚轴的长度未受到AgNPs浓度变化的显著影响,当浓度为200 mg·L-1时,胚轴出现最大值,为1.07 cm,而最短值出现在对照组,为0.77 cm;子叶长趋势同胚根长度一致,浓度为400 mg·L-1时开始受到抑制,为600 mg·L-1时显著低于对照组(P<0.05);浓度为10~400 mg·L-1时,与对照组相比,子叶宽无明显变化,当浓度达到600 mg·L-1时,子叶宽显著减少(P<0.05);叶绿素和氮含量随AgNPs浓度的增加趋势基本一致,浓度为200 mg·L-1时开始显著降低(P<0.05);与对照组相比较,各浓度处理组(除20 mg·L-1外)的鲜质量与干质量均显著减少(P<0.05),最小值均出现在600 mg·L-1时,分别为0.1426 g和0.0062 g。
如图3所示,随着AgNPs溶液浓度升高,蒙古黄芪幼苗地上部分和地下部分的抗氧化酶CAT、POD和SOD活性变化趋势基本一致,且POD和SOD活性明显高于CAT活性。由图3(a)可知,AgNPs浓度为10 mg·L-1时激发黄芪幼苗产生过氧化氢酶应激,地上和地下部分活性均明显高于对照组,而其他处理的活性与对照组相比差别不大。由图3(b)和(c)可知,POD在10~400 mg·L-1AgNPs和SOD在10~200 mg·L-1AgNPs的范围内,二者地上和地下部分活性均高于对照组。
2.3 AgNPs的毒性与蒙古黄芪种子萌发和幼苗生长的关系
在表1中列出了不同AgNPs浓度处理后蒙古黄芪种子萌发和幼苗指标的抑制率,可知AgNPs对蒙古黄芪种子萌发和幼苗产生了不同程度的毒害作用。1 000 mg·L-1时,AgNPs对蒙古黄芪幼苗生长有毒害作用,幼苗的生长指标已无法测定;AgNPs对最终发芽率的抑制随着浓度升高而增强,1 000 mg·L-1显著抑制种子萌发(P<0.05),抑制率为89.92%;AgNPs对胚根长、子叶长、子叶宽、总鲜质量和总干质量的抑制率在浓度为600 mg·L-1时达到最高;但胚轴长的抑制不受AgNPs浓度影响,各浓度间无显著性差异;叶绿素含量的抑制率最高达到38.33%,对氮含量抑制率最高达到29.43%。
2.4 AgNPs对蒙古黄芪种子萌发与幼苗生长影响评价及验证
2.4.1 隶属函数分析及综合评价
不同浓度AgNPs处理下蒙古黄芪各指标的隶属函数值如表2所示,其中10、20、60和100 mg·L-1AgNPs处理综合评价值均高于对照组,分别提高了17.45%、11.35%、5.67%和5.53%,说明低浓度AgNPs对蒙古黄芪的生长有一定促进作用;浓度200 mg·L-1和400 mg·L-1的AgNPs处理综合评价值与对照相比分别降低了1.70%和17.30%,这表明,中浓度AgNPs对蒙古黄芪的生长有一定的抑制作用,而600 mg·L-1和1 000 mg·L-1AgNPs处理综合评价值与对照相比分别降低了62.27%和94.18%,可见高浓度AgNPs对蒙古黄芪具有毒害作用,严重影响了蒙古黄芪生长发育。
2.4.2 主成分分析
为保持原始各指标数值的相对稳定性,对原始数据进行标准化处理后再分析,标准化处理后的数据如表3所示。主成分分析对原有变量总体描述情况如表4所示,由表4提取了2个主成分,其累积方差贡献率达到85.817%。由软件直接得出的初始因子载荷矩阵得分除以相应的特征值的平方根,以计算载荷得到主成分载荷矩阵(即每个主成分中每个指标对应的系数),结果如表5所示。根据方程计算出不同浓度的各主成分及综合得分(表6)。由本实验结果进行主成分分析结果发现,提取了2个主成分,浓度为10 mg·L-1的综合得分最高,为2.414。
由以上分析过程得到相应的主成分表达式如下:
F1=0.28X1-0.255X2+0.281X3+0.18X4+0.275X5+0.272X6+0.248X7+0.271X8+0.28X9+0.282X10+0.138X11+0.151X12+0.26X13+0.256X14+0.253X15+0.251X16
F2=-0.094X1-0.055X2-0.042X3-0.301X4-0.145X5-0.154X6-0.258X7-0.159X8+0.056X9+0.041X10+0.605X11+0.594X12+0.046X13-0.028X14+0.097X15+0.15X16
F=0.87F1+0.13F2

图2 AgNPs对蒙古黄芪幼苗生长的影响Fig. 2 Effects of AgNPs on the growth of A. mongholicus seedlings n=9)

图3 AgNPs对蒙古黄芪幼苗地上和地下部分抗氧化酶的影响注:CATS表示地上过氧化氢酶,CATR表示地下过氧化氢酶,PODS表示地上过氧化物酶,PODR表示地下过氧化物酶, SODS表示地上超氧化物歧化酶,SODR表示地下超氧化物歧化酶。Fig. 3 Effects of AgNPs on antioxidant enzymes of aboveground and underground portions of A. mongholicus seedlingsNote: CATS and CATR represent shoot- and root catalase; PODS and PODR represent shoot- and root peroxidase; SODS and SODR represent shoot- and root superoxide dismutase.

表1 不同AgNPs浓度对蒙古黄芪种子和幼苗指标的抑制率Table 1 Inhibition rate of indexes of A. mongholicus seed and seedling under different AgNPs concentrations
2.4.3 冗余分析
由图4(a)可知,TGP、RL、SL、TFW、TDW、Chl与CATS相关性强,而CATR、SODS、SODR与PODS相关性较强。AgNPs浓度在0~50 mg·L-1时对蒙古黄芪的CATR、SODS、SODR和PODS影响较大,在50~100 mg·L-1时对蒙古黄芪的PODR影响较大,而蒙古黄芪其余指标受AgNPs浓度变化影响不明显。由图4(b)可知,TFW与Chl、TDW与RL相关性较强,CAT、POD与SOD相关性强,AgNPs浓度在0 mg·L-1时(对照组)对TDW和RL、0~50 mg·L-1对SL、50~100 mg·L-1对TGP、100~1 000 mg·L-1对TFW和Chl影响较大。
2.4.4 Meta分析
为进一步明确不同浓度的AgNPs对植物种子萌发和幼苗生长指标的影响,利用Meta分析来进行讨论。由图5可知,AgNPs浓度<50 mg·L-1时,对TGP、MGT、GI和TFW的影响为显著正效应,而对TDW影响不显著;浓度50~100 mg·L-1和100~1 000 mg·L-1时,对TGP、GI没有显著影响;3个AgNPs浓度区间均使得RL和SL显著减少;浓度<50和100~1 000 mg·L-1时对叶绿素a、叶绿素b和总叶绿素影响不显著。
3 讨论(Discussion)
人们对纳米材料安全性的认知需求伴随着纳米技术的迅速发展与纳米材料的广泛应用而不断增强。种子萌发实验是一种快速的植物毒性检测方法,具有灵敏度高、操作简单和成本低等优点,故常用于进行纳米颗粒毒性评价实验[14-15]。比如,AgNPs对水稻种子萌发和幼苗的生长具有明显的剂量依赖性抑制作用,AgNPs在设置的浓度范围内(0.1、1、10、100和1 000 mg·L-1)都会影响幼苗的生长[16]。AgNPs颗粒似乎由于浓度和受供试植物种类不同而对植物产生不同的影响。AgNPs浓度为0.5 mg·L-1和2.5 mg·L-1时对西葫芦种子萌发有促进作用,而2 mg·L-1时提高了西瓜发芽率[17]。AgNPs浓度中使用的AgNPs是经过聚乙烯吡咯烷酮(PVP)包被,增加了其稳定性,且蓖麻经AgNPs处理后其POD和SOD活性增强,并产生活性氧(reactive oxygen species, ROS)[18]。由此可以推测,AgNPs经过表面或生物修饰变得较稳定,不会对植物产生显著的负面影响,这或许是降低纳米粒子毒性的有效措施。本研究中,随着AgNPs浓度的升高,蒙古黄芪最终发芽率降低;而低浓度AgNPs对幼苗的生长无影响,高浓度使幼苗后期的生长严重受到影响。这说明高浓度的AgNPs积累过多,对植物生长产生了强烈的胁迫[19]。同样的,将水稻幼苗暴露于不同浓度的AgNPs后,观察到根伸长、茎和根鲜质量、总叶绿素和类胡萝卜素含量显著降低,这可能是因为AgNPs暴露导致ROS生成量增加,引起细胞毒性[20]。虽然关于纳米粒子的研究较多,但纳米毒性的机理仍不清楚。据推测纳米毒性可能来自化学成分本身具有的化学毒性(如有毒离子的释放)和颗粒表面、大小以及形状引起的压力或刺激[21]。

表2 不同AgNPs浓度下蒙古黄芪种子和幼苗指标的隶属函数值Table 2 Sobordinative function values among indexes of A. mongholicus seeds and seedlings under different AgNPs concentrations

表3 标准化处理后的数据Table 3 Standardized data

表4 主成分分析总方差分析表Table 4 Total variance explained table in principal component analysis
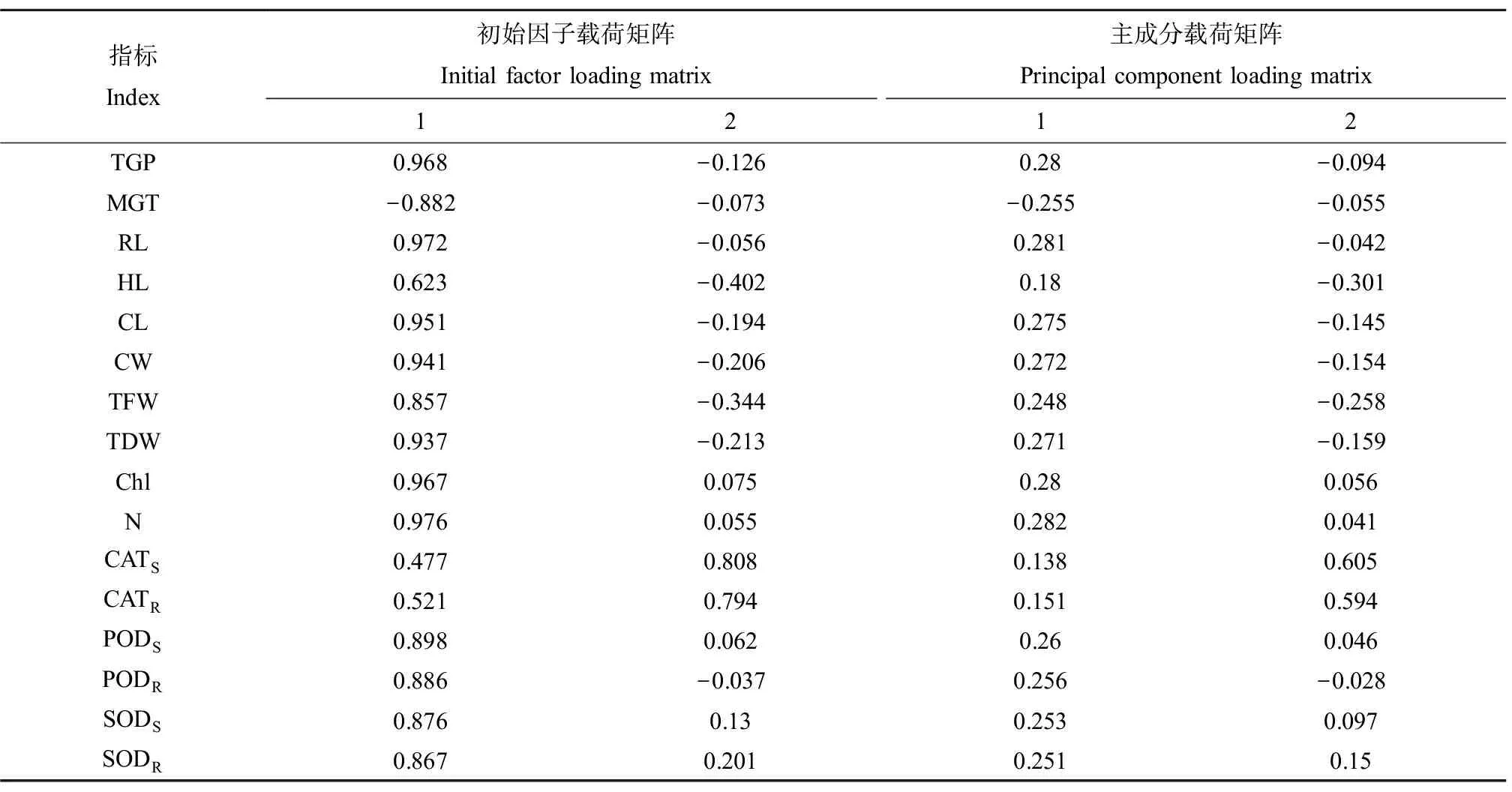
表5 载荷矩阵分析Table 5 Loading matrix analysis

表6 不同浓度AgNPs对蒙古黄芪种子萌发和幼苗生长综合评价表Table 6 Comprehensive evaluation form of seed germination and seedling growth of A. mongholicus with different concentrations of AgNPs

图4 不同浓度AgNPs对蒙古黄芪(a)、其他植物(b)种子萌发和幼苗生长参数RDA二维排序图注:SL表示茎长;◇表示AgNPs浓度区间,包括0、0~50 mg·L-1、50~100 mg·L-1、100~1 000 mg·L-1; 数据来源于参考文献[6-9,11,15-21,23-25,27, 29-30]。Fig. 4 RDA two-dimensional ordination diagram of seed germination and seedling growth parameters of A. mongholicus (a) and other plants (b) with different concentrations of AgNPsNote: SL stands for shoot length; ◇ represents the AgNPs concentration range, including 0, 0~50 mg·L-1, 50~100 mg·L-1, 100~1 000 mg·L-1; data refers to references [6-9,11,15-21,23-25,27, 29-30].
纳米颗粒对植物的影响体现在不同方面,首先根系被认为是植物暴露于纳米颗粒的主要途径,可能导致植物的物理或化学毒性[22-23]。Gusev等[24]在含有AgNPs的培养基中培养甜菜,发现根系生长受到抑制。本实验研究结果与此一致,蒙古黄芪胚根的伸长随着AgNPs浓度的升高受到抑制。而且纳米粒子可以由根部运输至叶片,或者被气孔直接吸收蓄积在叶片等,叶片的生长也会受到影响[25]。此外,叶绿素含量、含氮量及氧化应激水平的变化可以解释蒙古黄芪幼苗形态学的变化[26]。叶绿素和氮含量在AgNPs浓度为200 mg·L-1时开始显著降低,随着AgNPs浓度升高,叶绿素含量降低,这与前人的研究结果一致[6,25]。10 mg·L-1的AgNPs激发黄芪幼苗产生过氧化氢酶应激,地上和地下部分CAT活性均明显高于对照组。Cvjetko等[27]的研究表明一般根部暴露于较低浓度的AgNPs则引起较高的CAT活性。POD在10~400 mg·L-1AgNPs和SOD在10~200 mg·L-1AgNPs的范围内,二者地上和地下部分活性均高于对照组,说明抗氧化酶系统在这个范围内较好保护了蒙古黄芪幼苗。在无压力和压力温和的条件下,由于抗氧化酶的适当活性,ROS的形成和去除达到平衡。而在较高浓度下,SOD活性增加不足以抵御ROS形成增加,ROS形成过量时防御系统可能无法承受[27]。故高浓度AgNPs (600 mg·L-1和1 000 mg·L-1)的毒性较强,蒙古黄芪幼苗体内的抗氧化酶系统不足以抵抗,组织细胞受到一定的损伤,所以幼苗开始发霉腐烂或死亡,不能正常生长。有研究表明,AgNPs可通过影响植物体内的活性氧、植物激素和能量代谢等途径来影响植物生长发育[28]。但是,具体的活性氧物质以及AgNPs如何与植物互作还需进一步研究。
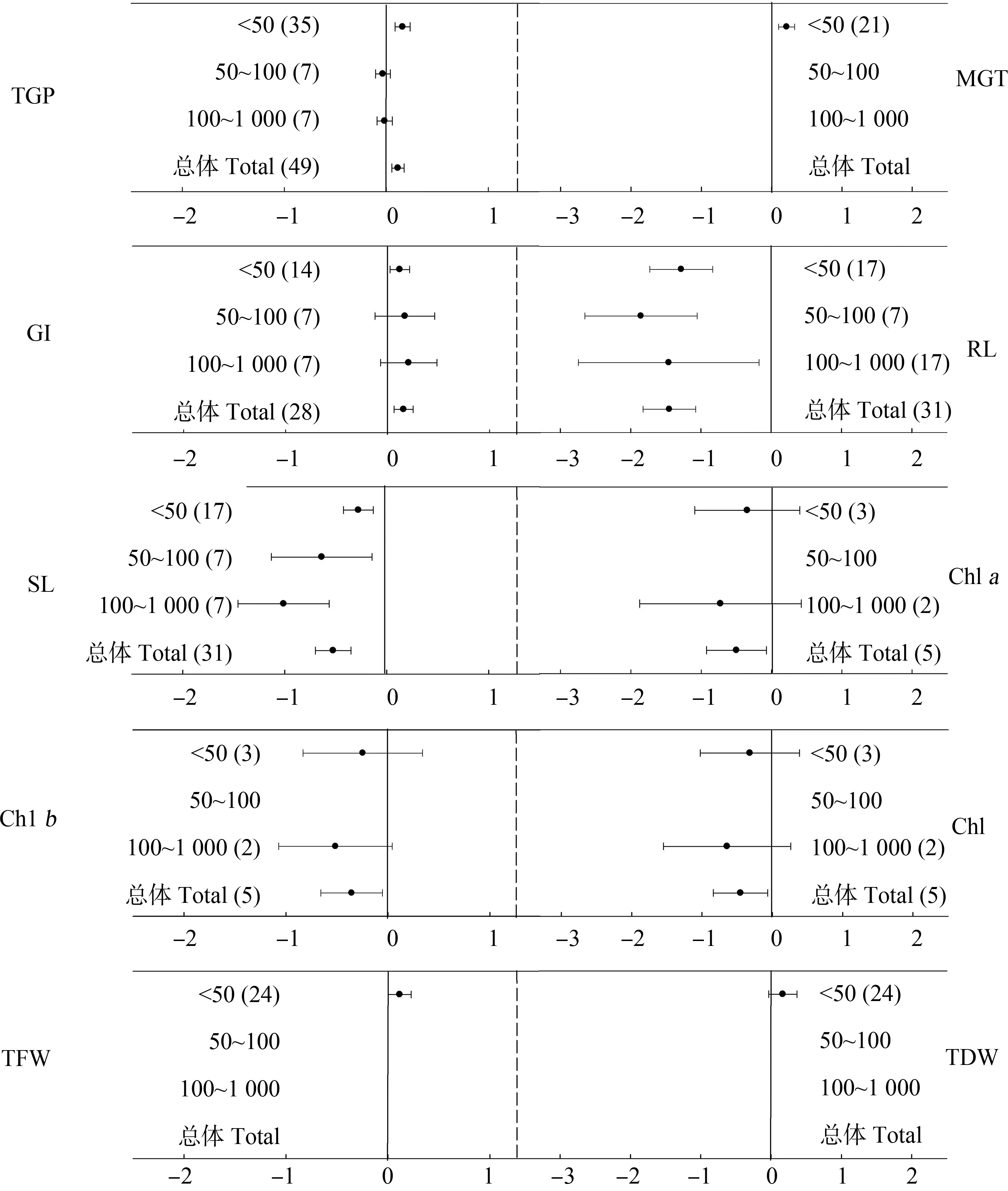
图5 不同浓度AgNPs对植物种子萌发和幼苗生长影响的平均效应大小注:GI表示发芽指数;<50、50~100、100~1 000表示AgNPs浓度区间,包括<50 mg·L-1、50~100 mg·L-1、100~1 000 mg·L-1, 括号内的数字表示样本量,误差线表示95%置信区间,数据来源于参考文献[17-18,24,29]。Fig. 5 Mean effect sizes of different concentrations of AgNPs on plant seed germination and seedling growthNote: GI stands for germination index; <50, 50~100, 100~1 000 represent the AgNPs concentration range, including <50 mg·L-1, 50~100 mg·L-1, 100~1 000 mg·L-1; the number in parentheses represents the sample size for each variable; error bars represent 95% confidence intervals; data refers to references [17-18,24,29].
由于单一指标并不能准确全面地概括不同浓度AgNPs对蒙古黄芪的影响[13],故对所有测定指标的结果用隶属函数法分析和主成分分析来进行综合评价,二者虽然是不同的计算方法但结果一致,更加证明了结果的可靠性。结果表明,低浓度的AgNPs可以促进蒙古黄芪生长发育,但随着浓度的升高,产生抑制作用,高浓度AgNPs对蒙古黄芪甚至具有毒害作用,符合之前的研究结果[19,29-30]。冗余分析发现同一类型的指标相关性较强,且浓度影响某些指标的变化,尤其是CAT、POD和SOD,而预测结果和实际结果的其他各指标和划分的浓度区间分布位置和距离并不相同(图4),可能是受到实验设计、种子或幼苗类型等的影响。而meta分析中AgNPs的3个浓度区间均影响植物根和茎的伸长(图5),本研究结果符合这一预测结果。由此可以说明,meta分析的结果比冗余分析更适用于单一物种趋势的预测。综上所述,AgNPs对单一植物蒙古黄芪的作用部分符合大数据分析的趋势,这可能是由于AgNPs对植物生长产生的影响是综合性结果,不同植物由于其不同的生长时期(比如萌发期、幼苗期、花期和果期等)和生理特性(抗氧化系统活性、光合作用和气孔开合等)对环境条件的响应表现出一定的差异性,故目前现存的数据挖掘分析结果并不能概括所有的植物类型。根据文献发现AgNPs对植物的影响可以概括为抑制(AgNPs表现出植物毒性)、促进和无影响3种结果,因此在讨论AgNPs对植物生长发育的影响时,按照具体的植物类型来进行分析是很有必要的。

