中药抗菌剂对费氏弧菌的单一及联合毒性效应
徐怡婷,孙昊宇,林志芬,印春生,*
1. 上海海洋大学海洋生态与环境学院,上海 201306 2. 污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092
近年来,随着抗生素的广泛以及不合理使用,环境中产生了大量的耐药菌。目前,临床中耐药菌的检出率有逐年增加的趋势,更有研究报道了超级耐药细菌的出现[1],这可能导致抗生素在治疗感染性疾病时的药效降低甚至完全失效,对人类的健康构成了极大威胁。因此,研究人员试图寻求新的抗菌药物来替代传统的抗生素类药物,以缓解目前抗生素大量使用导致的细菌耐药性问题。
中药作为我国传统医学的重要组成部分,在治疗感染性疾病方面有着悠久的历史,具有资源丰富、价格低廉、成分复杂、作用靶点多、抗菌谱广、安全性高和毒副作用小的特点。例如,Peng等[2]发现小檗碱对无乳链球菌具有抑制作用,且最低抑菌浓度(minimum inhibitory concentration, MIC)为78 g·mL-1,初步的机制研究发现小檗碱可能通过破坏细菌的细胞膜结构和抑制蛋白质与DNA的合成,最终导致无乳链球菌死亡。Chinnam等[3]研究发现黄岑素对大肠杆菌具有较强的抑菌作用,其抑制作用的半抑制浓度(half maximal inhibitory concentration, IC50)约为0.29 mmol·L-1。此外,有研究表明细菌对中药不易产生耐药性[4-5]。因此,以中药为母体,从中药材中提取有效的、环境友好的抗菌药物,将可能是一种缓解目前细菌耐药性污染的新途径。
目前,从中药中提取的具有抗菌活性的成分可以被称为中药抗菌剂,主要有蒽醌类、萜类、生物碱类、黄酮类、有机酸类、挥发油类、糖类和皂苷类等物质[6]。其中,蒽醌类和萜类化合物在自然界分布广泛,是许多中草药的重要组成部分。此外,蒽醌类化合物因其分子内含有蒽醌结构,能够抑制细菌的呼吸代谢、破坏细菌的细胞壁和细胞膜、抑制蛋白合成及作用于遗传物质、干预细菌生物膜形成过程、抗内毒素,从而对多种细菌表现出抑制作用[7]。大黄素(emodin, EMO)是一种存在于大黄、何首乌、决明子和虎杖等多种中药材中的羟基蒽醌类衍生物。目前,已有研究发现EMO具有广谱抑菌作用,对白喉、枯草、副伤寒、流感杆菌及肺炎球菌和卡他球菌有效,且对厌氧菌有很强的抑制作用,同时金黄色葡萄球菌对其不易产生耐药性,链球菌亦对其敏感[8]。大黄酸(rhein, RH)是大黄的主要有效成分之一,亦为蒽醌类衍生物,其药理作用广泛。近年来,有诸多研究表明RH具有很好的抑菌效果。例如,Azelmat等[9]研究发现RH对牙龈卟啉单胞菌具有较强的抑制作用,其MIC为2.5 μg·mL-1。芦荟大黄素(aloe-emodin, AE)是从芦荟、大黄及决明子等传统中药中提取的一种蒽醌类生物活性成分,对大肠埃希菌、变形杆菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、幽门螺旋杆菌及结核分枝杆菌等表现出明显的抗菌活性[10]。双氢青蒿素(dihydroartemisinin, DHA)是青蒿素经硼氢化钠还原得到的衍生物,属于萜类化合物,其抗菌效应的报道多集中于对抗生素的增强作用上。例如,Li等[11]发现DHA与β-内酰胺类抗生素联用时,可以通过作用于大肠杆菌的药物外排泵AcrB而增加β-内酰胺类抗生素在细菌体内的蓄积,达到协同抗菌作用。
抗菌剂往往被联合使用以起到提高抗菌效果的目的。例如,任皓等[12]测定了盐酸金霉素、吉他霉素、盐霉素和黄霉素对明亮发光杆菌的联合毒性,发现吉他霉素与盐酸金霉素、盐霉素和黄霉素的二元组合对细菌的联合毒性表现出较强的协同作用。Wang等[13]发现磺胺、磺胺增效剂和四环素的三元混合物对费氏弧菌、大肠杆菌和枯草芽孢杆菌这3种细菌都呈现出协同效应。那么,中药抗菌剂的联合毒性效应如何?其联合毒性作用又会呈现出怎样的形式呢?这个问题对未来中药抗菌剂应用后的生态风险研究具有重要意义,但目前还鲜有报道。
本文以费氏弧菌(Aliivibriofischeri,A.fischeri)作为模式生物,由于费氏弧菌发光敏感的特点,以其生物荧光作为测试终点,以研究已证明具有抑菌性能的EMO、RH、AE和DHA作为中药抗菌剂的代表,通过快速、有效和简便的急性毒性试验[14]测定了它们对A.fischeri生物荧光的单一和多元联合毒性效应,同时进行了抑菌作用机理的初步讨论,不仅有利于更全面和深入地认识中药抗菌剂联合暴露对细菌的影响,为今后中药抗菌剂使用后的生态风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 试剂和生物
实验所用EMO、RH和AE均购自上海麦克林生化科技有限公司(上海,中国),DHA购自上海源叶生物科技有限公司(上海,中国),具体信息如表1所示。进行毒性测试所用化合物配制使用助溶剂二甲基亚砜(dimethyl sulfoxide, DMSO),DMSO为分析纯,购自上海阿拉丁生化科技股份有限公司(上海,中国),体系中DMSO的终浓度控制在总体积的0.5%(V/V)以下,以减少DMSO对细菌的影响。EMO、RH、AE和DHA这4种化合物因为溶解度有限,配制的最大母液浓度分别是1.92×10-5、1.23×10-5、9.55×10-5和2.23×10-4mol·L-1。本实验模式生物费氏弧菌A.fischeri(ATCC 7744)冻干粉购自美国模式培养物保藏所(American Type Culture Collection,马纳萨斯,维吉尼亚州,美国)。
1.2 菌液配制
在无菌操作台中,从第3代菌株斜面上取一接种环大小的菌种接入5 mL的液体培养基中,在22 ℃恒温振荡培养箱中培养12~14 h至对数生长期成为摇瓶菌液。取对数生长期摇瓶菌液加入到2% NaCl溶液中,磁力搅拌40 min,调整细菌生物荧光的光值(相对光度单位, relative light units, RLU)至75 000~80 000,即可将制成的工作菌液用于毒性测定。
1.3 毒性试验
受试中药提取抑菌剂对A.fischeri的毒性实验在Luminoskan Ascent发光分析仪(赛默飞世尔科技有限公司,美国)上使用非透明96孔板以生物荧光作为测试终点进行,具体步骤如下:取受试化合物用适量DMSO配制成浓度较高的标准溶液,再用2% NaCl稀释成等对数浓度梯度系列。将化合物溶液加入96孔板中,每孔包含160 μL的受试化合物(作为实验组)或2%的NaCl溶液(作为对照组)和40 μL准备好的菌液。振荡均匀静置15 min后测定孔的RLU值。每个浓度点至少3个平行样。然后,以化合物浓度的对数为横坐标,抑制率为纵坐标,绘制剂量-效应曲线(concentration-response curve, CRC)。由于DHA在实验最大溶解度条件下,抑制率达不到50%,故根据单一化合物的抑制率达到40%时对应的化合物浓度(EC40),分别配制等毒性比的二元、三元、四元混合溶液[15],然后按照单一毒性测定方法测定系列混合溶液的联合毒性,再绘制相应的CRC。化合物毒性用其对A.fischeri生物荧光的抑制率表述[16],如式(1)所示:

表1 实验药品信息Table 1 Experimental drug information
(1)
式中:x0代表对照组的RLU值,x代表实验组的RLU值。
1.4 独立作用(IA)模型判别联合毒性作用
加和作用(concentration action, CA)和独立作用(independent action, IA)模型近年来经常用于混合污染物的联合毒性评价。然而,由于CA模型预测时可能存在某些预测盲区[17],即需要保证混合物中的各个组分单独存在时效应浓度能够对应,因此考虑到某些药物在低浓度时可能存在Hormesis效应,中药抗菌剂混合物的联合毒性作用使用IA模型进行判别。IA是一种基于混合物组分具有不同作用模式的假设而被广泛用来评价联合毒性的参考模型[18]。其计算公式为:
(2)
式中:cmix和E(cmix)代表混合物的总浓度和总效应;E(ci)代表组分i在混合物中对应ci浓度时的单一效应。IA曲线的统计学不确定性以95%置信区间表示。混合物的联合毒性作用通过比较实际的CRC和IA曲线进行判别[19]:(1)实际的CRC在IA曲线(包含95%置信区间)的下方,此时混合物联合毒性呈现拮抗作用;(2)实际的CRC位于IA曲线(包含95%置信区间)的中间,此时混合物联合毒性呈现相加作用;(3)实际的CRC在IA曲线(包含95%置信区间)的上方,此时混合物联合毒性呈现协同作用。
2 结果与讨论(Results and discussion)
2.1 中药抗菌剂对A. fischeri的单一毒性
EMO、RH、AE和DHA对A.fischeri的单一毒性的结果如图1所示。通过拟合剂量-效应曲线获得了EC40,来表征各中药抗菌剂对A.fischeri的毒性。EMO、RH、AE和DHA的EC40分别为6.39×10-7、2.37×10-6、1.74×10-5和1.25×10-4mol·L-1。可以看出,EMO的EC40最小,毒性最大,而DHA的EC40最大,毒性最小;受试中药提取抑菌剂的毒性顺序为:EMO>RH>AE>DHA。在之前的研究中,Wu等[20]发现药用大黄中几种羟基蒽醌化合物的抑菌效果为:RH>EMO>AE。该研究与本文实验结果的差异可能源于模式生物和测试终点的不同:Wu等[20]使用的模式生物是金黄色葡萄球菌,测试终点是金黄色葡萄球菌的生长量;而本文以A.fischeri作为模式生物,测试终点是A.fischeri的生物荧光发光值。

图1 中药提取抑菌剂(TCM)对A. fischeri的单一毒性Fig. 1 The single toxicity of traditional Chinese medicine (TCM) antibacterials to A. fischeri
A.fischeri的生物荧光来源于以下两步酶促反应[21-23]:
NADH+H++FMN→NAD++FMNH2
(3)
FMNH2+RCHO+O2→FMN+H2O+ RCOOH+light (490 nm)
(4)
式中:NADH表示还原型烟酰胺腺嘌呤二核苷酸,FMN表示黄素单核苷酸,NAD+表示氧化型烟酰胺腺嘌呤二核苷酸,FMNH2表示还原型黄素单核苷酸,RCHO表示醛,RCOOH表示羧酸;反应(3)由NADH/FMN氧化还原酶催化,而反应(4)由荧光素酶催化。
已有研究表明,蒽醌化合物EMO对NADH氧化酶和NADH脱氢酶均有较强的抑制作用,且抑制率随药物浓度的增加而增强;而蒽醌化合物RH、AE对NADH氧化酶的抑制作用不明显,对NADH脱氢酶有一定的抑制作用,且AE对NADH脱氢酶的抑制程度比RH弱[24]。那么,EMO、RH和AE是如何抑制NADH氧化酶或NADH脱氢酶的活性的呢?从EMO、RH和AE的结构可以看出这3种中药抗菌剂均属于羟基蒽醌类化合物。已有研究表明,羟基蒽醌类药物易与功能蛋白通过氢键形成稳定的复合物,从而阻断功能蛋白的生物学作用[25-26]。因此,我们推测EMO与NADH氧化酶以及NADH脱氢酶结合形成稳定复合物,RH和AE与NADH脱氢酶结合形成稳定复合物,抑制了NADH氧化酶或NADH脱氢酶的活性,从而阻断线粒体呼吸链电子传递,影响组织细胞生命活动所需能源的供应,最终抑制发光反应表现出毒性作用。有研究发现青蒿素能够通过抑制NADH脱氢酶而影响线粒体膜的正常功能[27],因此推测DHA也是通过与NADH脱氢酶相互作用来抑制生物荧光。但由于DHA不具有羟基蒽醌结构,因此可能无法像EMO、RH和AE那样通过氢键形成稳定的复合物,从而表现出其对A.fischeri的毒性比EMO、RH和AE小。综上,推测受试中药抗菌剂EMO、RH、AE和DHA对A.fischeri生物荧光的抑制作用机制如图2所示。
2.2 中药抗菌剂对A. fischeri的联合毒性
根据单一毒性数据计算拟合出IA曲线,同时测定了EMO、RH、AE和DHA对A.fischeri生物荧光的多元联合毒性并拟合出相应的CRC,以判别各混合体系的联合毒性作用。
由图3可知,在实验最大溶解度条件下,EMO-RH的最高抑制率最大,高达94.55%,RH-AE次之,最高抑制率为62.03%,而其余4种中药抗菌剂的二元混合物的最高抑制率均未达到50%,其中AE-DHA的最高抑制率最小,为31.44%。
EMO、RH、AE和DHA的二元混合物的联合毒性作用模式结果如表2所示。由图3和表2可知,EMO-RH、EMO-DHA均呈现明显的拮抗作用,而EMO-AE、RH-AE、RH-DHA以及AE-DHA二元混合物实际的CRC与IA曲线发生了交叉,表现为联合作用模式随混合物浓度发生变化。其中,AE-DHA展现出了低浓度协同、中浓度相加和高浓度拮抗的联合作用模式,而EMO-AE、RH-AE以及RH-DHA在低浓度区呈相加作用,在高浓度区呈拮抗作用。
由上可见,在对A.fischeri的生物荧光产生抑制作用的高浓度区间内,4种中药抗菌剂的二元混合物的联合毒性作用模式均为拮抗。如图2所示,推测可能是在高浓度区,EMO、RH、AE和DHA以等毒性比二元混合时,化合物之间互相竞争性地对NADH脱氢酶产生抑制作用,导致对发光反应的抑制作用减弱,最终导致联合毒性降低,表现出拮抗的联合毒性作用模式。
根据图4可知,比较4种中药抗菌剂的三元混合物的联合毒性效应发现,在实验最大溶解度条件下,EMO-RH-AE的毒性最强,最高抑制率达52.17%,EMO-RH-DHA的毒性较弱,最高抑制率为22.58%,而EMO-AE-DHA、RH-AE-DHA对A.fischeri无毒性作用。此外,三元混合物实际的CRC与IA曲线均发生了交叉。其中,除了RH-AE-DHA展现出了随混合物浓度升高依次相加、协同、相加、拮抗的联合作用模式,其余三元混合物均在低浓度区呈相加作用,在高浓度区呈拮抗作用。同时,通过观察图3和图4发现,在EMO-RH、EMO-AE、RH-AE二元混合的基础上加入DHA,对A.fischeri的联合毒性作用明显减弱。如图2所示,推测可能是EMO、RH、AE和DHA三元混合时,竞争关系更为激烈,对NADH脱氢酶的抑制作用大大减弱,最终导致对发光反应的抑制作用急剧减弱,联合毒性大大降低。

图2 中药抗菌剂对A. fischeri的毒性作用机制假设图注:NADH表示还原型烟酰胺腺嘌呤二核苷酸,FMN表示黄素单核苷酸,NAD+表示氧化型烟酰胺腺嘌呤二核苷酸,FMNH2 表示还原型黄素单核苷酸,RCHO表示醛,RCOOH表示羧酸;表示中药抗菌剂对酶的抑制作用,越多表示抑制作用越大。Fig. 2 The hypothesis of toxic mechanism of TCM antibacterials on A. fischeriNote: NADH represents reduced nicotinamide adenine dinucleotide; FMN represents flavin mononucleotide; NAD+ represents oxidized nicotinamide adenine dinucleotide; FMNH2 represents reduced flavin mononucleotide; RCHO represents aldehyde; RCOOH represents carboxylic acid; stands for the inhibition of enzyme by TCM antibacterials and the more “” means the greater the inhibition.
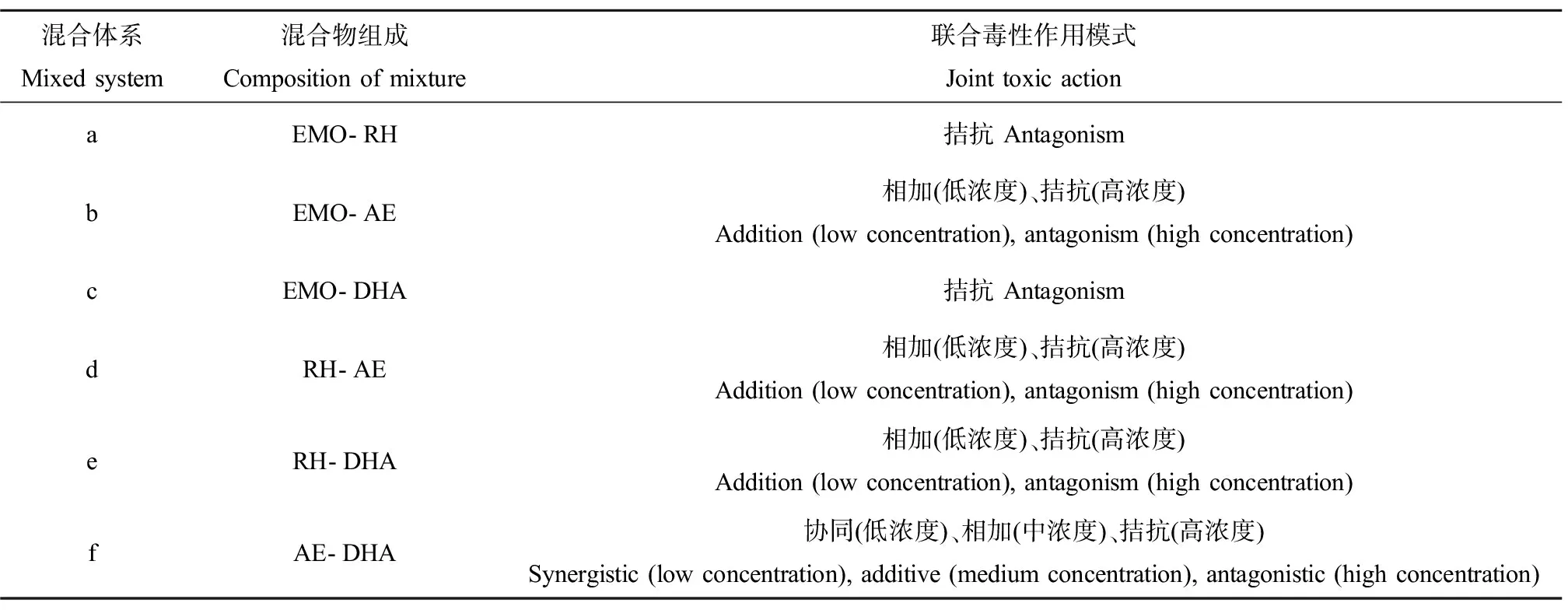
表2 等毒性比组成的二元混合物联合毒性Table 2 Joint toxicity of binary mixture in the equal toxic ratio

图3 中药抗菌剂的二元混合物的剂量-效应曲线(CRCs)与独立作用(IA)曲线(包含95%置信区间)注:── 表示中药抗菌剂的二元混合物的CRCs;──表示中药抗菌剂的二元混合物的IA曲线;┅┅表示IA曲线的95%置信区间。Fig. 3 The concentration-response curves (CRCs) and the independent action (IA) curves with 95% confidence bands for the binary mixture of TCM antibacterialsNote: ── shows the CRCs for the binary mixture of TCM antibacterials; ── shows the IA curves for the binary mixture of TCM antibacterials; ┅┅ shows the 95% confidence bands of IA curves.
由图5可知,在实验最大溶解度条件下,EMO-RH-AE-DHA对A.fischeri几乎无毒性作用。4种化合物的四元混合物实际的CRC与IA曲线同样发生了交叉,展现出了在低浓度区呈相加作用,在高浓度区呈拮抗作用。通过观察图4和图5发现,在EMO-RH-AE三元混合的基础上加入DHA,对A.fischeri的联合毒性作用急剧减弱,可能原因是在实验最大溶解度条件下,这4种中药抗菌剂联合暴露时,它们会竞争性地对NADH脱氢酶产生抑制作用,这种竞争关系很强,最终导致对发光反应几乎不产生抑制作用,联合毒性大大降低。
综上,本文分别测定了EMO、RH、AE和DHA这4种中药抗菌剂对A.fischeri生物荧光的单一和多元联合毒性,结果表明,EMO、RH、AE和DHA的EC40分别为6.39×10-7、2.37×10-6、1.74×10-5和1.25×10-4mol·L-1。受试中药抗菌剂的毒性顺序为:EMO>RH>AE>DHA。DHA的单一毒性比EMO、RH和AE小,推测是由于DHA不具有羟基蒽醌结构,因此可能无法像EMO、RH和AE那样通过氢键与NADH脱氢酶形成稳定的复合物,从而其对A.fischeri的毒性比EMO、RH和AE小。而测定EMO、RH、AE和DHA的联合毒性时发现,在高浓度区间时,联合毒性作用模式均为拮抗,对A.fischeri的联合抑制效果反而不如单一作用时强,推测是化合物之间互相竞争性地抑制NADH脱氢酶的活性,导致受试中药抗菌剂对发光反应的抑制作用减弱,联合毒性减弱,联合毒性作用模式均为拮抗。

图4 中药抗菌剂的三元混合物的CRCs与IA曲线(包含95%置信区间)注:── 表示中药抗菌剂的三元混合物的CRCs;──表示中药抗菌剂的三元混合物的IA曲线;┅┅表示IA曲线的95%置信区间。Fig. 4 The CRCs and the IA curves with 95% confidence bands for the tertiary mixture of TCM antibacterialsNote: ── shows the CRCs for the tertiary mixture of TCM antibacterials; ── shows the IA curves for the tertiary mixture of TCM antibacterials; ┅┅ shows the 95% confidence bands of IA curves.

图5 中药抗菌剂的四元混合物的CRCs与 IA曲线(包含95%置信区间)注:── 表示中药抗菌剂的四元混合物的CRCs;──表示中药抗 菌剂的四元混合物的IA曲线;┅┅表示IA曲线的95%置信区间。Fig. 5 The CRCs and the IA curves with 95% confidence bands for the quaternary mixture of TCM antibacterialsNote: ── shows the CRCs for the quaternary mixture of TCM antibacterials; ── shows the IA curves for the quaternary mixture of TCM antibacterials; ┅┅ shows the 95% confidence bands of IA curves.
通过本文的研究,我们发现,这些中药抗菌剂单一作用时对细菌具有较强的毒性作用,但是混合暴露时由于具有相同的靶蛋白,导致其联合毒性减弱,因此,具有相同靶蛋白的中药抗菌剂联合暴露的生态风险可能低于其单一暴露;在后续研究中,我们考虑将不同结构、作用于不同靶位点或靶蛋白的药物进行研究或将中药抗菌剂和传统抗生素联合进行联合毒性研究。需要指出的是,本文研究的是EMO、RH、AE和DHA对A.fischeri的等毒性比联合毒性,但是有时联合毒性的结果与使用的目标化合物的浓度存在很大的关系,不同的浓度配比可能会出现不同的联合毒性结果。因此,在后续研究中建议增加这些化合物对A.fischeri的非等比联合毒性效应研究。本研究为中药抗菌剂的联合毒性的研究提供了参考,为今后中药抗菌剂使用后的生态风险评价提供了新的依据和新的思路。

