转Cry1Ie基因玉米和转CP4-EPSPS基因大豆对斑马鱼的生态毒性
董姗姗,章嫡妮,于赐刚,王长永,刘燕
生态环境部南京环境科学研究所,环境保护生物安全重点实验室,南京 210042
以转基因技术为核心的现代生物技术为保障粮食安全、推动农业可持续发展提供了新的途径。2019年,全球4种主要转基因作物——棉花、大豆、玉米和油菜的平均应用率为52.8%,其中转基因大豆和转基因玉米的应用率分别为74%和31%[1]。转基因作物大规模商业化种植的潜在生态环境风险已引起了人们的广泛关注。目前,转基因作物的环境安全评价仍主要集中在陆地生态系统,对水生生态系统的研究相对匮乏。
转基因作物中的外源蛋白可通过植物残体、花粉和根际分泌物等途径进入农田土壤和水体,并随地表径流和地表径流沉积物进入邻近水域。已有研究显示,转Bt玉米田间的地表水和沉积物中Cry1Ab蛋白浓度可分别达130 ng·L-1和143 ng·L-1[2-4],玉米田附近河流中淡水河蚌的腮、性腺和消化腺等组织内均能检测到cry1Ab基因的存在[5]。转基因蛋白在水体中的存续和累积可能对水生生物的安全构成潜在风险。此外,转基因作物的凋落物和残体可以为水生动物直接或间接地提供食物,是其邻近水域内生物群落重要的能量和营养来源,长期大规模种植转基因作物可能会诱发影响水生动物群落结构、种群数量以及摄食行为等诸多因子的变化[6]。鱼类是水生生态系统的重要生物组成之一,通过检测鱼类生理和行为反应可以有效监测水环境质量的变化[7]。近年来,已有研究以鱼类为模式动物评价转基因作物的生态毒理效应,大多数研究是通过开展转基因作物的饲喂实验,调查鱼类的生长表现、组织病理、脏器发育、运动行为、应激和免疫反应以及繁殖能力等,评估转基因作物的外源基因及其表达蛋白对鱼类的安全性[8-9]。在调查鱼类的各项指标时,通常是在饲喂实验结束时,集中采集样本进行检测分析,没有对喂养期间鱼类的生长、发育、病理以及生理等方面的变化进行动态监测,这可能会影响最终的结果判定。而且,在鱼类的不同生长发育时期,其摄取转基因饲料后的反应可能会不同[10-11]。对喂养期间鱼类的生长发育、生理等指标进行跟踪监测,更有利于全面评估转基因作物的潜在生态毒性或非预期效应。
斑马鱼(Daniorerio)基因组与人类基因组具有较高同源性,是发育生物学、毒理学、基因功能以及人类代谢疾病研究中的理想模型[12-13]。由于斑马鱼体型小、世代周期短、易于饲养和繁殖,近些年也被推荐作为转基因作物安全性评价中的模式动物[14-15]。本研究以斑马鱼为受试动物,以我国自主研制的转Cry1Ie基因玉米IE09S034和转CP4-EPSPS基因大豆中作J9331为原料分别配制饲料,检测转基因饲料的营养成分和霉菌毒素含量,通过98 d的喂养实验,调查斑马鱼的摄食、生长、抗氧化酶活性和繁殖等指标,分析不同喂养阶段斑马鱼的组织病理及敏感蛋白mRNA表达水平,探讨转基因作物对鱼类的生态毒理效应,为转基因作物对水生动物的环境安全评价提供技术支撑。
1 材料与方法(Materials and methods)
1.1 试验材料
供试的玉米材料为转Cry1Ie基因抗虫玉米IE09S034及其非转基因近等基因系综31,供试的大豆材料为转CP4-EPSPS基因耐除草剂大豆中作J9331及其非转基因近等基因系中黄30,均由中国农业科学院作物科学研究所提供。
受试动物为野生型AB品系斑马鱼,由中国科学院水生生物研究所国家斑马鱼资源中心购买的种鱼所繁殖。幼鱼开口期的饵料为草履虫(Parameciumcaudatum),孵化出20 d后喂食丰年虫(Artemiasalina),每天早、中、晚喂食3次。幼鱼在静水中饲养30 d左右,转移至斑马鱼养殖系统(Aquatic habitats ZF0601, Apopka, FL, USA)中养殖,该系统为循环水,每天换水量为10%。鱼龄达到60 d时开始喂食商业颗粒饲料,每天喂食量为其体质量(湿质量)的4%。斑马鱼鱼龄达到90 d时开始试验,测量受试鱼初始体质量和体长。
1.2 试验饲料的制备及检测
试验饲料制备前,对所有玉米和大豆材料的主要营养成分进行检测,为后续饲料配制提供参考。根据美国国家研究委员会(National Research Council, NRC)制定的鱼类营养需求标准配制人工饲料[16],饲料配方如表1所示。饲料加工前,将玉米和大豆种子用商用磨粉机(FLBP-250,上海菲力博)打磨成粉,过100目筛网备用,加工时先将明胶和加丽素红溶于80 ℃左右的纯净水中,搅拌均匀,然后按照比例“由小到大”的顺序依次填加表1中的其他饲料成分,添加过程中用搅拌机不断搅拌使其充分混合,混合均匀的饲料用家用料理机制作成直径1.5 mm的条状,平铺于托盘上,置于阴凉处自然风干,再根据斑马鱼口径大小进行研磨和过筛,使饲料颗粒直径为450~550 μm,4 ℃冷藏。商业颗粒饲料为购买自日清丸红(天津)饲料科技有限公司的热带鱼饲料,主要成分为鱼粉、豆粕、小麦淀粉、鱼肝油、复合维生素及矿物质等。通过酶联免疫法(ELISA)检测抗虫转基因玉米饲料中的Cry1IE蛋白,ELISA试验的单克隆抗体和检测方法均由中国农业科学院作物科学研究所刘允军博士提供。采用CP4-EPSPS蛋白检测试纸条(Agdia Elkhart, IN, USA)检测耐除草剂转基因大豆饲料中的CP4-EPSPS蛋白。同时,采用转基因蛋白检测试纸条(Agdia Elkhart, IN, USA)检测了商业饲料中的Cry1Ab/Ac及CP4-EPSPS外源蛋白。对转基因和非转基因玉米饲料中伏马毒素B1(FB1)、黄曲霉毒素B1(AFB1)、玉米赤霉烯酮(ZEB)和呕吐毒素(DON)的含量也进行了检测(英格尔检测技术服务(上海)有限公司)。
1.3 试验设计
选择体质量和体长相近的斑马鱼随机分成5组,即转基因玉米组(GMM)、非转基因玉米组(Non-GMM)、转基因大豆组(GMS)、非转基因大豆组(Non-GMS)和商业饲料对照组(CF),每组设置3个平行(3缸),每缸50条斑马鱼(10 L)。试验期间的饲养条件与幼鱼期饲养条件保持一致,试验周期为98 d。每天喂食量为受试鱼初始体质量的3%~4%,分3次投喂(8:30、12:30、16:30),并根据受试鱼体质量的变化调整喂食量。试验期间每天对斑马鱼的游动、集群、栖息水层、食性及外观的状况进行观察,并记录身体异常(如呼吸急促、不协调的游动和反常的静止)和死亡情况等。试验期间斑马鱼养殖系统的水温为(27.2±0.5) ℃、pH为7.2±0.4、电导率为(507±18) μS·cm-1,溶解氧为(10.2±1.1) mg·L-1,符合斑马鱼生长条件。

表1 试验饲料配方成分和比例(%)Table 1 Composition and proportion (%) of the experimental feeds
1.4 生长指标的测定
在试验开始后的第14、28、42、56、70、84和98天,每缸随机选取10条斑马鱼称量(湿质量)、测量体长,并根据测得的数据计算特定增长率和饲料转化率。
1.5 组织病理学分析
在试验开始后的第28、56和98天,将斑马鱼禁食12 h后,每缸随机选取4条固定于10%的福尔马林溶液中,脱水处理后将整条鱼横切成头、胸腹、臀和尾4段,然后用石蜡包埋机(HistoStar, Thermo Fisher Scientific, USA)进行组织蜡块包埋,再利用全自动石蜡切片机(Shandon Finesse, Thermo Fisher Scientific, USA)切为4 μm左右的连续切片,采用苏木精-伊红(HE)将石蜡切片染色,最后在荧光显微镜(DX45, Olympus, Japan)下进行组织病理学检查。根据检查结果,按照病变由轻到重的程度进行打分,分别标记为1、2、3和4分,无明显病变为0分,极轻度病变为0.5分。
1.6 繁殖指标检测
每缸随机选取5对斑马鱼按照雌雄比1∶2进行配对产卵,从试验的第70天开始至喂养结束,每14 d配对一次,总共配3次,记录每对斑马鱼的产卵量、孵化率、孵化出仔鱼的畸形和异常行为等。
1.7 肝脏和肠道超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性测定
在试验开始后的第98天,每缸随机选取雌性和雄性斑马鱼各2条,大体解剖后取其肝脏和肠道组织样本,分别采用SOD试剂盒(Sigma, USA)和CAT试剂盒(Biovision, USA)检测雌、雄鱼肝脏和肠道组织中的SOD和CAT活性。
1.8 斑马鱼脏器组织中SOD、CAT和热激蛋白70(HSP70) mRNA表达量检测
在试验开始后的第28、56和98天,每缸随机选取雌性和雄性斑马鱼各3条,大体解剖后取其肝脏、肠道和性腺组织样本,采用微量RNA提取试剂盒(Qiagen, Germany)提取脏器组织的总RNA。通过超微量分光光度计(DS-11, DeNovix, USA)和琼脂糖凝胶电泳,检测RNA的纯度和完整性。RNA经反转录合成cDNA后,采用实时荧光定量PCR检测斑马鱼肝脏、肠道和性腺组织中SOD、CAT和HSP70的mRNA表达水平,以actin为内参基因,采用相对定量法2-ΔΔCT计算SOD、CAT和HSP70的mRNA表达量,其中ΔΔCT=(CT目的基因-CT内参基因)试验组-(CT目的基因-CT内参基因)对照组,各基因的特异性引物序列和检测方法均参照董姗姗等[17]的方法。
1.9 数据统计与分析
根据斑马鱼体质量和摄食量计算特定生长率(special growth rate, SGR)和饲料转化率(feed conversion ratio, FCR),特定生长率和饲料转化率计算公式如下:
SGR=(lnWt-lnW0)/t×100
FCR=C/(Wt-W0)
式中:Wt和W0分别为试验结束时和试验开始时的鱼体湿质量(mg);t为试验时间(d);C为摄食量(mg)。
采用多因素方差分析(multi-way ANOVA)分别检验玉米组(包括转基因玉米组、非转基因玉米组和商业饲料对照组)和大豆组(包括转基因大豆组、非转基因大豆组和商业饲料对照组)中组别、性别、取样时间以及它们之间的交互作用对不同脏器组织中敏感蛋白mRNA表达量和抗氧化酶活性的影响。单因素方差分析(one-way ANOVA)检验不同组别斑马鱼的体质量、体长、特定生长率、饲料转化率、组织病理以及繁殖等指标的差异,显著性水平设为α=0.05,若检验结果显著,则采用Tukey法进行不同组别间的多重比较。利用独立样本T检验(T-test)比较雌性和雄性斑马鱼脏器组织中敏感蛋白mRNA表达量及抗氧化酶活性的差异(α=0.05)。以上分析均使用SPSS 19.0统计软件完成。试验数据用平均数±标准误表示。
2 结果与分析(Results and analysis)
2.1 试验饲料的营养成分、霉菌毒素含量以及外源基因表达蛋白
饲料营养成分的分析结果显示,转基因饲料与相应的非转基因饲料在主要营养成分上没有明显差异,且都能够满足斑马鱼的生长需求(表2),但与商业饲料相比,人工饲料中的粗蛋白、粗脂肪和粗灰分含量明显偏低,而淀粉含量明显偏高。对转基因和非转基因玉米饲料中霉菌毒素的检测结果显示,非转基因玉米饲料中的FB1、DON和AFB1含量略高于转基因玉米饲料中的,不过两者均远低于《饲料卫生标准》(GB 13078—2017)中规定的最高限量水平(表2)[18]。在转基因玉米饲料和转基因大豆饲料中均检测到了外源基因表达蛋白,而相应的非转基因饲料和商业饲料中Cry1Ac和CP4-EPSPS蛋白呈阴性(表2)。
2.2 生长表现
受试斑马鱼的初始平均体质量和体长分别为(124.78±4.69) mg和(23.0±0.3) mm,在试验期间各组斑马鱼的体质量和体长均呈明显增加趋势。转基因组与相应非转基因组斑马鱼的各项生长指标整体上无显著差异(图1),但在试验98 d时,转基因玉米组斑马鱼体质量显著低于非转基因玉米组的(P<0.05),与商业饲料组相比,人工饲料组斑马鱼的体长、体质量和特定生长率均显著偏低,饲料转化率显著偏高(图1)。
2.3 组织病理
斑马鱼肝脏、肠道和脑组织的病理检测结果整体上为无明显病变、极轻度或轻度病变。肝脏病变主要表现为肝细胞脂变,多数为轻度,少数为中度,个别重度。少数斑马鱼肠壁黏膜上皮中的杯状细胞数量增多,提示肠道黏液分泌增加。各组斑马鱼脑组织神经细胞和白质未见明显病变,只在试验28 d时非转基因玉米组有1条受试鱼的个别神经细胞坏死。对组织病理评分的方差分析结果显示,在试验56 d时,商业饲料组斑马鱼肠道病变程度显著高于转基因大豆组(P<0.05)(表3),其他取样时间点各组间斑马鱼肝脏、肠道和脑组织病变程度无显著差异。随着试验时间推移,各组肝脏病变(肝细胞脂变)程度有加重趋势(表3)。
2.4 繁殖指标
斑马鱼配对产卵结果显示,在每组随机选取的45对斑马鱼中,转基因和非转基因玉米组有75%左右的雌鱼产卵,转基因和非转基因大豆组有68%左右的雌鱼产卵,商业饲料组有84%产卵,转基因饲料组与非转基因饲料组的平均产卵量和受精卵孵化率均无显著差异(图2),不过试验饲料组的产卵量和孵化率与商业饲料组相比整体偏低(135±15vs175±23,(53.1±4.5)%vs(60.8±2.3)%),各组孵化出的幼鱼均未见身体畸形和明显异常行为。
2.5 肝脏和肠道中抗氧化酶活性
玉米组多因素方差分析结果显示(表4),组别和性别对斑马鱼肠道中的SOD酶活有显著影响,非转基因玉米组斑马鱼SOD酶活显著高于商业饲料组的,商业饲料组雌鱼SOD酶活相对于雄鱼显著偏低。性别以及性别与组别的交互作用对玉米组斑马鱼肠道中的CAT酶活有显著影响,即在不同组别中,雌鱼和雄鱼的表现不一致,T检验发现仅在转基因玉米组中雌鱼肠道中的CAT酶活显著高于雄鱼(图3)。大豆组多因素方差分析结果显示(表4),组别和性别对斑马鱼肝脏中的SOD酶活有显著影响,转基因大豆组显著高于非转基因大豆组和商业饲料组,雄鱼的SOD酶活显著高于雌鱼。

表2 饲料的营养成分、外源蛋白和霉菌毒素含量Table 2 Nutrient composition, exogenous protein and the content of mycotoxins of the diets

图1 不同组别斑马鱼的体长、体质量、特定生长率和饲料转化率注:不同大写字母表示转基因玉米组、非转基因玉米组和商业饲料组之间在P<0.05水平上差异显著; 不同小写字母表示转基因大豆组、非转基因大豆组和商业饲料组之间在P<0.05水平上差异显著;下同。Fig. 1 Length, weight, specific growth rate and feed conversion ratio of zebrafish in different groupsNote: Different capital letters represent significant difference between GMM, Non-GMM and CF at P<0.05; different lowercase letters represent significant difference between GMS, Non-GMS and CF at P<0.05; the same below.

表3 不同组别斑马鱼肝脏、肠道和脑组织病理学检测结果Table 3 Histopathological results of liver, intestinal tract and brain of zebrafish in different groups

图2 不同组别斑马鱼的产卵量和受精卵孵化率Fig. 2 The egg-laying amount and hatching rates of fertilized eggs of zebrafish in different groups
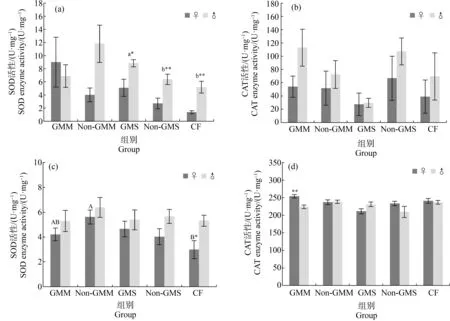
图3 不同组别斑马鱼肝脏和肠道中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性注:(a)和(b)为肝脏,(c)和(d)为肠道;*和**分别表示同组雌鱼与雄鱼间在P<0.05和P<0.01水平上差异显著。Fig. 3 Superoxide dismutase (SOD) and catalase (CAT) activity in the liver and intestinal tract of zebrafish in different groupsNote: (a) and (b) are liver, (c) and (d) are intestinal tract; *and **represent significant difference between female and male zebrafish at P<0.05 and P<0.01, respectively.
2.6 不同脏器组织中SOD、CAT和HSP70的mRNA表达量
对玉米组斑马鱼肝脏、肠道和性腺组织中,敏感蛋白mRNA表达量的多因素方差分析结果显示(表5),试验持续时间与组别和性别的交互作用对脏器组织中SOD、CAT和HSP70 mRNA表达量有显著影响,说明在不同取样时间点、不同组别和性别间差异的表现不同。例如:在试验28 d时,转基因玉米组斑马鱼肝脏中CATmRNA表达量显著高于商业饲料组,但在98 d时,转基因和非转基因玉米组CATmRNA表达量均显著低于商业饲料组;在28 d时,雌鱼肝脏中的HSP70 mRNA表达水平与雄鱼相比显著偏高,到98 d时显著偏低(表6)。大豆组的多因素方差分析结果显示(表5),组别对斑马鱼肝脏和肠道中的SOD和CATmRNA表达量有显著影响,转基因和非转基因大豆组的SOD和CATmRNA表达量均显著低于商业饲料组(表7),试验时间与组别和性别的交互作用显著影响性腺组织中SOD和CATmRNA的表达水平,各组之间的差异在不同取样时间点没有一致的表现。通过对玉米组和大豆组中不同处理组间的多重比较,发现组别之间的差异主要来自人工饲料组与商业饲料组之间,而不是转基因与非转基因饲料组之间(表8)。而且随着试验时间的推移,斑马鱼脏器组织中的敏感蛋白mRNA表达水平并没有表现出明显升高或下降的趋势。

表4 组别和性别对斑马鱼肝脏和肠道中抗氧化酶活性影响的多因素方差分析Table 4 Multi-way ANOVA of the effects of group and sex on the antioxidant enzymes activities in liver and intestinal tract of zebrafish

表5 组别、性别和试验时间对斑马鱼脏器组织中敏感蛋白mRNA表达水平影响的多因素方差分析Table 5 Multi-way ANOVA of the effects of group, sex and experimental duration on mRNA expression levels in tissues of zebrafish
3 讨论(Discussion)
3.1 转基因作物对斑马鱼生长表现的影响
抗虫转基因玉米和耐除草剂转基因大豆对斑马鱼的体质量、体长、饲料转化率和特定生长率整体上没有显著影响,但在试验98 d时,转基因玉米组斑马鱼的体质量显著低于非转基因对照组。生长指标的变化通常被认为是生物体中各种生物因素综合变化的结果,并且可能作为评估鱼类生态毒性效应的终点指标[19]。一般情况下,生长指标的降低会伴随着饲料摄取量和转化率的下降,本研究未发现转基因与非转基因玉米组斑马鱼的饲料转化率有显著差异,而且整个试验期间仅在最后一次调查中发现转基因玉米组的体质量显著偏低,这种差异可能是测量中的随机效应导致,没有生物学意义。在用含有抗虫转基因玉米(MON810)的饲料喂食大西洋鲑的研究中,同样发现转基因玉米组的最终体质量显著低于非转基因玉米组,推测可能是由于饲料中某些成分的差异,比如:直链淀粉与支链淀粉的比例或纤维素含量的差异等,可能会影响鱼类的消化率进而引起生长指标的变化[10]。
值得注意的是,与4个试验饲料组相比,商业饲料组斑马鱼的生长表现更好,之前在以商业饲料作为对照的研究中也有类似结果[17,20]。尽管我们配制的试验饲料能够满足斑马鱼的营养需求,但在加工工艺上与商业饲料有较大差别。为了最大限度保证转基因作物中的外源蛋白在饲料制备过程中不被降解,我们没有对试验饲料进行加热加压处理,而商业饲料是经高温、高压处理后的颗粒饲料,其适口性和消化率都优于试验饲料,这可能会直接影响斑马鱼的摄食量和饲料利用率。此外,商业饲料中粗蛋白和粗脂肪的含量相对较高,可能更利于营养成分的吸收和利用[21],从而提高斑马鱼的特定增长率。
3.2 转基因作物对斑马鱼组织病理的影响
98d的喂养试验结果显示,抗虫转基因玉米和耐除草剂转基因大豆对斑马鱼肝脏、肠道和性腺的组织病理没有显著影响。但随着试验时间增加,各组斑马鱼肝细胞脂变程度表现出从无明显病变至轻度病变的趋势,推测与饲料中的脂肪和蛋白质配比、霉菌毒素、抗营养因子以及营养素(比如:胆碱、维生素)等因素有关,长期饲喂可能影响斑马鱼的脂肪代谢,导致肝脏脂肪沉积[22-23]。已有文献报道,经过7个月的长期喂养,转基因大豆组和非转基因大豆组大西洋鲑肠道均出现轻微炎症,推测可能是大豆中抗营养因子诱发的炎症[24]。在用含有抗虫转基因玉米的饲料连续喂食2代斑马鱼的研究中,转基因组和非转基因组子一代斑马鱼都有个别样本的肠道组织出现轻微炎症[25]。
3.3 转基因作物对斑马鱼繁殖的影响
抗虫转基因玉米和耐除草剂转基因大豆对斑马鱼的繁殖性能无显著影响,各组斑马鱼的平均产卵量为(144±17)粒,与文献报道的相近[25]。但试验饲料组的产卵量和受精卵孵化率,与商业饲料组相比均略偏低,可能主要由于试验饲料与商业饲料在适口性和营养成分上的差异,影响斑马鱼的摄食、饲料转化和营养物质吸收,在一定程度上对其性腺等生殖器官的发育产生不利影响,导致产卵量和孵化率偏低[26-27]。目前国际上在转基因作物对鱼类的饲用安全性研究中,涉及繁殖能力的还很少,主要因为大部分研究以大西洋鲑为受试动物,其性成熟时间较晚,仔鱼孵化期长,对环境条件要求较高,试验操作比较困难,而斑马鱼生育周期短、易于人工繁殖[9]。一项以斑马鱼为模式动物,调查转Bt玉米对其繁殖能力影响的研究显示,尽管转基因玉米组亲鱼的产卵量略高于非转基因对照组(P>0.05),但2组胚胎的DNA甲基化水平和仔鱼的行为活动均无显著差异[25]。
3.4 转基因作物对斑马鱼脏器组织中抗氧化酶活性和mRNA表达水平的影响
斑马鱼脏器组织中敏感蛋白mRNA的表达水平,没有随时间呈现明显的规律性变化,各组间mRNA表达量的差异(92.6%)主要来自于试验饲料组与商业饲料组之间,转基因作物对其没有显著影响。这与Sagstad等[23]对大西洋鲑的研究结果相似,他们发现转基因与非转基因大豆组大西洋鲑脏器组织中的SOD、CAT和HSP70 mRNA表达量没有显著差异,但与鱼粉饲料组相比,2组大西洋鲑肠道中的HSP70 mRNA表达水平均表现出上调趋势,推测可能与大豆中的抗营养因子(如大豆凝集素)有关。已有文献报道大豆凝集素能够与大西洋鲑小肠上皮细胞特异性结合,影响肠道的结构和功能[28-29]。本研究中,性别与试验时间的交互作用对斑马鱼脏器组织中的mRNA表达量有显著影响,在不同取样时间和不同检测指标上雌鱼与雄鱼的差异表现不同。Sissener等[20]对喂食转基因大豆饲料的雌性和雄性斑马鱼检测发现,转基因大豆组雌鱼肝脏中SOD的mRNA转录水平显著低于非转基因大豆组,而雄鱼在2组间没有显著差异。已有研究显示,转基因大豆与非转基因大豆中大豆异黄酮等植物雌激素的含量可能存在差异[30],雌鱼和雄鱼对植物雌激素的敏感程度也有所差别[31],植物雌激素能够诱导雄鱼肝脏中卵黄蛋白原的合成、影响鱼的性腺发育和繁殖[32]。
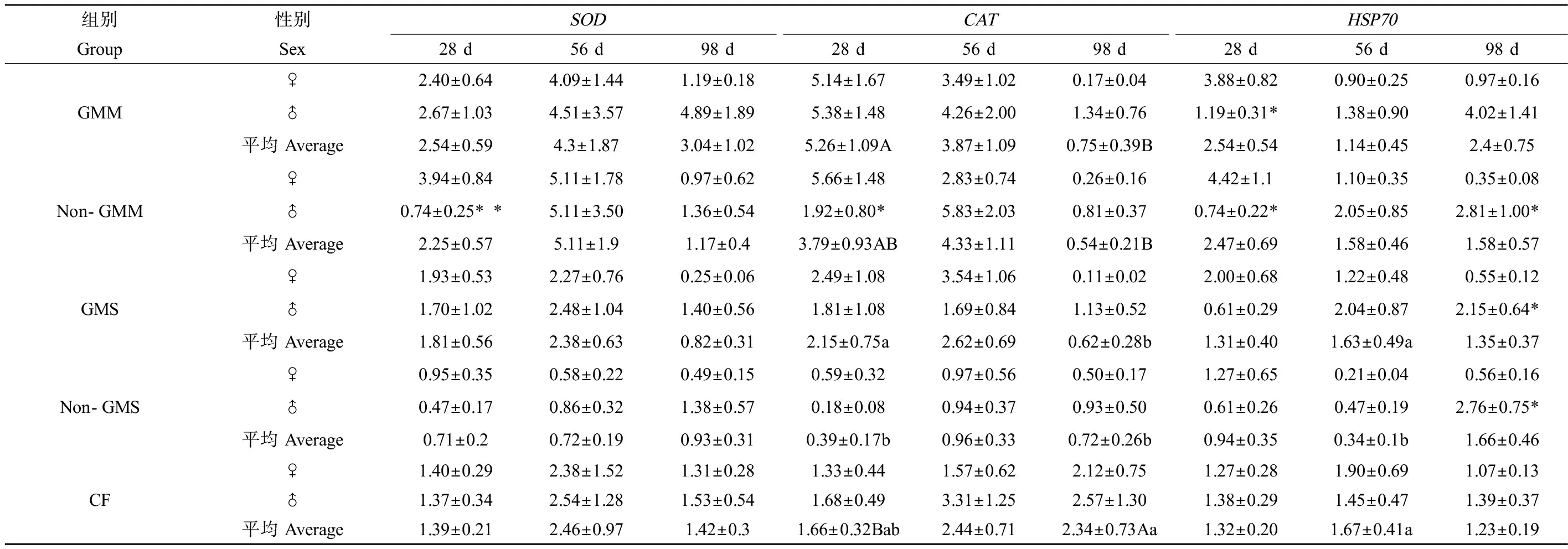
表6 不同组别斑马鱼肝脏中的SOD、CAT和HSP70 mRNA表达水平Table 6 SOD, CAT and HSP70 mRNA expression levels in the liver of zebrafish in different groups
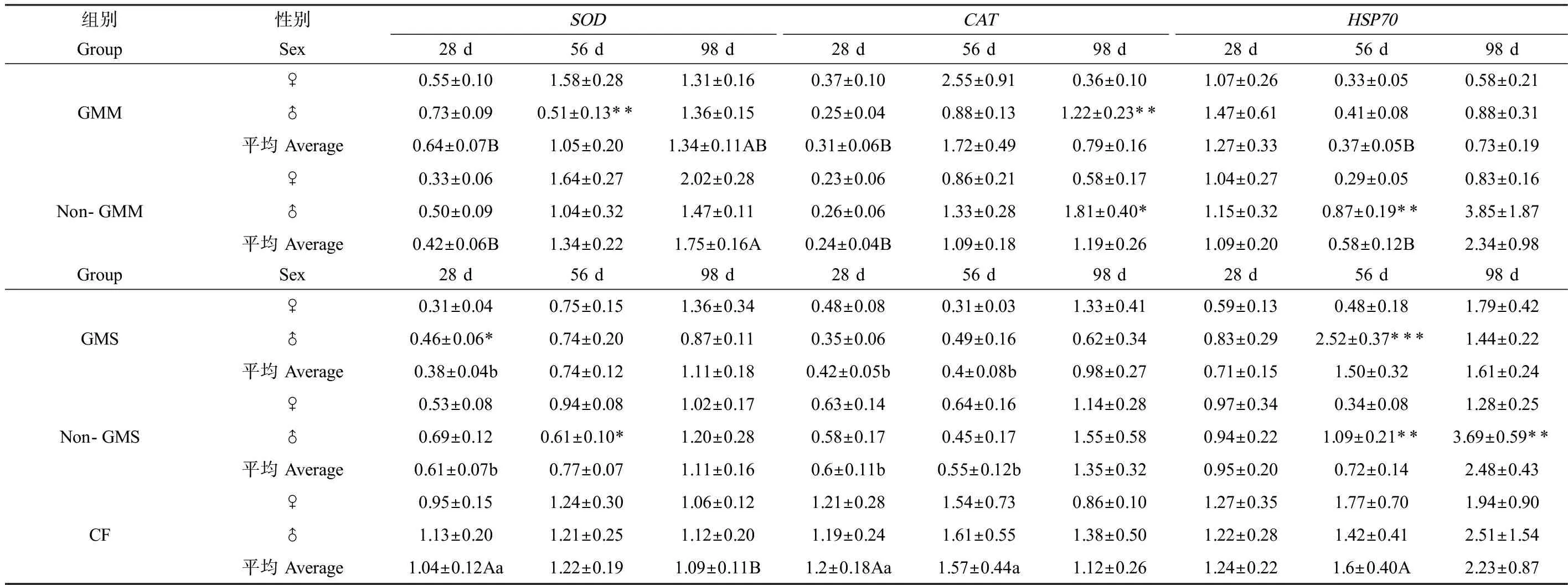
表7 不同组别斑马鱼肠道中的SOD、CAT和HSP70 mRNA表达水平Table 7 SOD, CAT and HSP70 mRNA expression levels in the intestinal tract of zebrafish in different groups
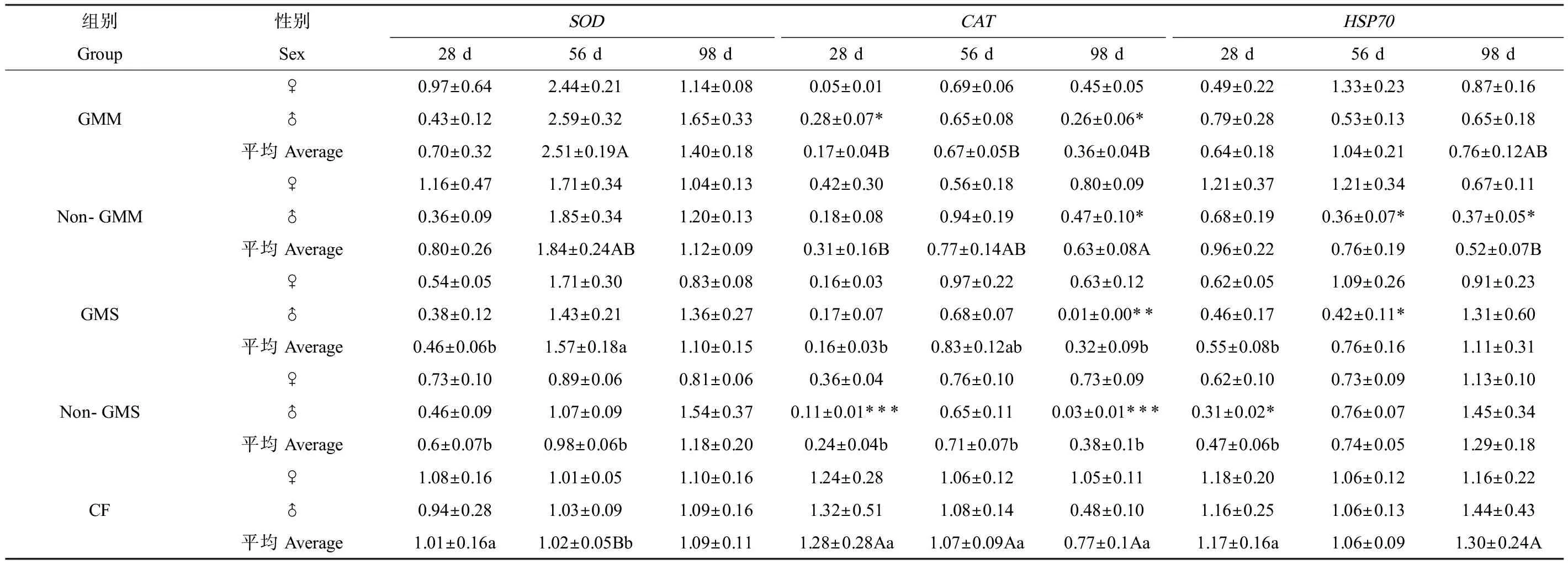
表8 不同组别斑马鱼性腺组织中的SOD、CAT和HSP70 mRNA表达水平Table 8 SOD, CAT and HSP70 mRNA expression levels in the gonad tissues of zebrafish in different groups
斑马鱼脏器组织中的抗氧化酶活性与其mRNA表达量之间没有明显的相关性,可能主要与基因表达过程中转录和翻译调控有关。值得注意的是,玉米组雌鱼和雄鱼肠道中SOD酶活与其98 d时的mRNA表达量显著相关,非转基因玉米组的SOD酶活及其mRNA表达量均显著高于商业饲料组,可能是饲料组成和营养成分上的差异导致。肠道是营养物质消化吸收的主要器官,也是生物体免疫防御的重要屏障,肠道中抗氧化酶活性的变化可以指示胁迫条件下机体的氧化应激反应。本研究中,非转基因玉米饲料的FB1、DON和AFB1含量均略高于转基因玉米饲料,已有文献报道高剂量的霉菌毒素暴露可以诱导鱼脏器组织中SOD基因转录水平上调[33-34],DON和AFB1在鱼体中的靶标器官分别是肠道和肝脏[35],因此,推测非转基因玉米组斑马鱼肠道中的SOD酶活和mRNA表达量显著偏高,可能也与饲料中霉菌毒素含量相对偏高有关。
综上所述,摄食含有抗虫转基因玉米和耐除草剂转基因大豆饲料的斑马鱼,在生长表现、组织病理和繁殖性能上与非转基因对照组相比均无显著差异。转基因大豆组斑马鱼肝脏中的SOD酶活显著高于非转基因大豆组和商业饲料组,且雄鱼显著高于雌鱼(P<0.05)。斑马鱼脏器组织中敏感蛋白mRNA的表达水平,没有随时间呈现明显的规律性变化,喂养时间与组别和性别之间存在显著的交互作用。总体上看,转Cry1Ie基因抗虫玉米和转CP4-EPSPS基因耐除草剂大豆对斑马鱼没有明显的生态毒性效应。但是,试验饲料组斑马鱼的生长表现、肝脏中SOD酶活以及mRNA表达量与商业饲料组相比有显著差异,可能与饲料的适口性和营养成分上的差异有关。

