乙酰柠檬酸三丁酯围产期暴露对子代小鼠认知能力的影响
刘旭东,朱思洁,刘良禹,张玉超,杨旭
1. 茅台学院食品科学与工程系,仁怀 564507 2. 茅台学院酿酒工程系,仁怀 564507 3. 华中师范大学生命科学学院,武汉 430079
邻苯二甲酸酯(phthalic acid esters, PAEs),是一类能够显著增加塑料制品柔韧性和拉伸性的持久性有机污染物,由于具有强烈的内分泌干扰作用,目前已经被多个国家和地区限制使用[1]。乙酰柠檬酸三丁酯(acetyl tributyl citrate, ATBC)由于其极低的内分泌干扰作用被认为是PAEs的替代物,美国食品药品管理局已批准ATBC可在食品包装材料中限量使用[2]。但是与PAEs类似,ATBC依然可以从包装材料中迁移至产品中,迁移速率甚至高于PAEs[3],人们可以通过多种途径暴露于ATBC中。
目前对于ATBC的动物实验研究证明,250~1 000 mg·kg-1·d-1的ATBC暴露未对实验动物产生明显的生殖发育毒性,因此认为ATBC是一类相对安全的增塑剂,安全暴露剂量可达250 mg·kg-1·d-1以上[4-5],而对于其非生殖发育毒性的研究相对较少。虽然目前认为ATBC的安全暴露浓度比较高,但是对于一些敏感性特殊人群,这些看似安全的暴露剂量可能并不安全。
一些基于实验动物的研究显示,围产期的污染物暴露会引起子代神经递质的水平异常、脑组织损伤、神经炎症以及神经行为异常[6-7]。对于PAEs的毒性研究证明PAEs暴露后引起的氧化应激是其重要的致损伤机制之一[8],而脑组织作为耗氧量高、脂质含量高而抗氧化系统薄弱的组织,很容易受到氧化应激的影响[9]。研究表明,PAEs暴露会导致小鼠脑组织中活性氧(ROS)含量显著升高,抗氧化性物质含量/活性下降,引起生物大分子的损伤,持续高水平的氧化应激可诱发神经炎症反应,促炎症因子表达量上升,进而导致神经细胞损伤,动物认知能力出现下降[10-11]。而对于ATBC围产期暴露对于子代认知能力及脑组织的影响尚未见报道。
本研究通过对子代小鼠的认知能力和脑组织病理变化进行检测,研究在看似安全的暴露剂量下(<250 mg·kg-1·d-1),围产期ATBC暴露是否会对子代小鼠造成脑组织损伤,认知能力是否会受到影响。同时对子代小鼠脑组织中胶质细胞活化、脑组织氧化应激和促炎症因子水平进行检测,探讨可能的致损伤机制,为全面了解ATBC的安全性,确保ATBC的安全应用提供一定参考。
1 材料与方法(Materials and methods)
1.1 实验动物
SPF级C57BL/6小鼠雄性60只,雌性30只,6~8周龄,(22±2) g,购自于湖北省实验动物研究中心,饲养于SPF级实验动物房中,小鼠置于无病原专用鼠笼内,每天12 h光照和12 h黑暗,允许自由进食和饮水。动物饲养室内温度控制在20~25 ℃,室内相对湿度为50%~70%,保持室内安静,避免强光照。小鼠适应性饲养3 d后按雄性∶雌性数量为2∶1的比例进行合笼过夜,次日以发现阴栓作为雌性小鼠受孕的标准,记为妊娠第1天(E1),将每只孕鼠置于一个单独的鼠笼中进行饲养。
1.2 主要仪器与试剂
主要仪器:酶标仪(ELx800,Bio-Tek,美国),多功能荧光酶标仪(Hide Chameleon V,Hidex,芬兰),低温冷冻离心机(5424R,Eppendorf,德国),显微镜(DP73,Olympus,日本),荧光显微镜(BZ-X,KEYENCE,日本),Morris水迷宫分析软件(ANY-MazeTM,Stoeling Co.,美国),小鼠跳台实验分析系统(JLBehv-SD,上海吉量软件科技有限公司,中国),Image Pro Plus (IPP) 6.0(Media Cybernetics,美国)。
主要试剂及试剂盒:ATBC(纯度>99%)、2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)和硫代巴比妥酸(TBA)均购于美国Sigma-Aldrich公司,其他试剂均为国产分析纯。兔抗小鼠-胶质纤维酸性蛋白(GFAP)抗体,兔抗小鼠-巨噬细胞特异性蛋白(Iba1)抗体和FITC标记的山羊抗兔IgG均购于美国Abcam公司。小鼠还原型谷胱甘肽(GSH)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、5-羟基色胺(5-HT)检测试剂盒和乙酰胆碱(ACh)检测试剂盒均购于南京建成生物工程研究所(中国)。小鼠肿瘤坏死因子α(TNF-α)检测试剂盒和白介素17(IL-17)检测试剂盒购于蓝基生物公司(上海,中国)。
1.3 实验分组与染毒
将孕鼠随机分为4组,每组至少5只孕鼠,对孕鼠进行连续的ATBC灌胃暴露,染毒浓度以预实验结果以及增塑剂研究常用染毒剂量作为参考[12],选择在以往的ATBC毒性研究中对正常小鼠相对安全的暴露浓度作为本研究的暴露剂量[4-5],将暴露剂量设定为2、20和200 mg·kg-1·d-1,以生理盐水灌胃作为对照组(0 mg·kg-1·d-1)。将亲代小鼠生产记为产后第1天(P1),继续对亲代小鼠进行灌胃暴露一直持续到子代小鼠断乳(产后第21天,P21)。为排除行为学实验中由于小鼠体力消耗对结果带来的干扰,选择体力相对较好的雄性子代小鼠进行实验,从每个暴露组的雄性子代小鼠中随机选择10只,作为实验对象。
1.4 Morris水迷宫实验
在P15~P21,通过Morris水迷宫实验对不同暴露组子代小鼠的认知能力进行检测[13],实验前5天(P15~P19)为定向航行实验,主要用来测试子代小鼠的学习能力,通过对比不同暴露组子代小鼠在水池中找到目标平台所花费的时间,即逃逸潜伏期来判断不同暴露组子代小鼠的学习能力强弱。每天对每只子代小鼠进行3次训练,记录每只子代小鼠的逃逸潜伏期。实验的第6天(P20)停止实验,为遗忘期。第7天(P21)开始空间探索实验,旨在测定不同暴露组子代小鼠的记忆能力,撤去逃逸平台,让子代小鼠在迷宫中游满60 s,记录子代小鼠在目标平台所在象限的时间和进入次数及游泳轨迹。
1.5 跳台实验
在P19~P21,通过跳台实验对不同暴露组的子代小鼠的认知能力进行检测[14]。P19~P20为训练期,训练时将小鼠轻轻置于金属网上的木制平台上,给小鼠2 min适应周围环境。2 min后对金属网通电(36 V, 50 Hz),通电持续5 min。一旦小鼠跳下平台就会受到电击,小鼠通常会再次跳回平台。通过2 d的训练,在P21对小鼠的记忆能力进行测定。记录小鼠从置于平台开始到第1次跳下平台所持续的时间,即潜伏期;以及整个通电过程中小鼠跳下平台的次数,即错误次数。
1.6 脑组织样品的制备
在P22,用颈椎脱臼法处死子代小鼠,取小鼠全脑组织。每组随机选择3只小鼠全脑置于4%的多聚甲醛中进行固定,制作组织切片进行病理观察,其余全脑组织用于制备脑组织匀浆。将小鼠脑组织置于冷的磷酸盐缓冲液(PBS)(pH=7.5)中洗净,用吸水纸吸干水分,然后放至玻璃匀浆器中,加入冷的PBS制成10%的组织匀浆,然后在4 ℃下以10 000 r·min-1离心10 min,脑组织匀浆中蛋白质含量采用Lowry法进行测定[15],将上清液分装置于-80 ℃冰箱待用。
1.7 脑组织病理切片制作及免疫荧光观察
对子代小鼠脑组织进行石蜡包埋和切片,进行H&E和Nissl染色[16],随后在显微镜下进行切片观察。对Nissl染色切片在脑海马区随机选择5个视野区域,使用Image Pro Plus(IPP)6.0(Media Cybernetics,美国)软件测出Nissl染色每张切片的光密度值(OD)进行图像定量分析[17]。采用抗体稀释液将兔抗小鼠GFAP和Iba1抗体进行稀释(1∶200)作为一抗,FICT标记的山羊抗兔IgG为二抗,对脑切片进行免疫荧光染色[18],随后在荧光显微镜下进行观察,同样使用IPP 6.0对荧光强度进行OD值测定。
1.8 5-HT和ACh含量测定
取1.6中制备的子代小鼠脑组织匀浆上清液,使用5-HT和ACh检测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.9 ROS含量测定
用PBS将1.6中制备的子代小鼠脑组织匀浆上清液稀释100倍,采用DCFH-DA法检测ROS含量[19],利用荧光酶标仪在485 nm激发光、525 nm发射光的条件下测定荧光强度,反映样品中含有ROS的水平。
1.10 MDA含量测定
取1.6中制备的子代小鼠脑组织匀浆上清液,使用TBA法测定丙二醛(MDA)的含量[20],MDA能够与TBA反应缩合形成红色产物,分别在532、600和450 nm波长下测定光吸光度值,按照公式:MDA (μmol·L-1)=6.45×(OD532-OD600)-0.56×OD450计算MDA的含量。
1.11 GSH含量测定
取1.6中制备的子代小鼠脑组织匀浆上清液,使用GSH检测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.12 SOD活性测定
取1.6中制备的子代小鼠脑组织匀浆上清液,使用SOD活性检测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.13 TNF-α和IL-17含量测定
取1.6中制备的子代小鼠脑组织匀浆上清液,使用TNF-α和IL-17测试剂盒进行测定,具体操作步骤参见试剂盒说明书。
1.14 统计分析
采用方差分析(ANOVA)对实验数据的差异性进行检测,数据统计图使用GraphPad Prism 8.0(San Diego,美国)生成,用SPSS 13.0(SPSS,美国)分析数据。采用多重ANOVA进行水迷宫定向航行实验数据分析,使用t检验确定各暴露组之间的差异性,其他数据采用单因素ANOVA,使用t检验分析差异性。P<0.05和P<0.01表示两组相比具有显著性差异,分别使用“*”和“**”标示。
2 结果(Results)
2.1 子代小鼠认知能力的变化
Morris水迷宫实验结果显示,通过为期5 d的定向航行训练,各暴露组子代小鼠的逃逸潜伏期都在变短。在P18和P19,200 mg·kg-1·d-1暴露组子代小鼠逃逸潜伏期和对照组相比均出现了显著性的下降(表1)。经过P20的遗忘期,P21的空间探索实验结果显示,200 mg·kg-1·d-1暴露组子代小鼠在目标平台所在象限滞留时间(图1(a))及进入次数(图1(b))显著低于空白组子代小鼠。如图1(c)所示,对照组子代小鼠游泳轨迹目的性强,这些小鼠的游泳轨迹相对集中于目标平台所在象限,而200 mg·kg-1·d-1暴露组子代小鼠游泳的无规则性较强,轨迹混乱。
跳台实验结果显示,200 mg·kg-1·d-1ATBC暴露对子代小鼠跳台潜伏期和错误次数均有显著性影响。与对照组子代小鼠相比,200 mg·kg-1·d-1暴露组子代小鼠跳台潜伏期显著性下降(图2(a))而错误次数显著上升(图2(b))。
2.2 子代小鼠脑组织病理学观察
围产期ATBC暴露之后子代小鼠脑海马组织结构的变化如图3所示。H&E染色(图3(a))结果显示,空白对照组子代小鼠脑海马CA1区锥体细胞分布均匀,细胞整齐排列,细胞形态完整,呈多角形,锥体细胞顶状树突明显可见,表现清晰。随着暴露浓度增加至200 mg·kg-1·d-1,子代小鼠CA1区锥体细胞排列松散,混乱,细胞肿胀变圆,顶状树突消失。同时Nissl染色(图3(b))结果显示,20 mg·kg-1·d-1和200 mg·kg-1·d-1暴露组子代小鼠CA1区还出现了Nissl染色颜色变浅,OD值显著下降(图4),Nissl小体数量下降。
2.3 子代小鼠胶质细胞活化情况
本研究选用星形胶质细胞标志物GFAP及小胶质细胞标志物Iba1对围产期ATBC暴露后子代小鼠星形胶质细胞和小胶质细胞的活化程度进行测定。如图5(a)所示,对照组子代小鼠大脑皮层区域星形胶质细胞形态正常,胞体小,树突细长,而随着ATBC暴露浓度的升高细胞的胞体变大,树突变短变粗,GFAP表达量也出现了明显的上升(图6(a))。如图5(b)所示,对照组子代小鼠大脑皮层区域小胶质细胞形态正常,树突纤细,未有显著的Iba1表达,而随着暴露浓度升高,细胞胞体变大,树突变短变粗,且出现刺棘,Iba1表达量也明显上升(图6(b))。

表1 不同暴露组子代小鼠每天的逃逸潜伏期Table 1 The escape latency of offspring mice of each training day in different groups (s)

图1 Morris水迷宫实验结果注:(a)目标象限停留时间;(b)进入目标象限次数;(c)游泳轨迹;ATBC表示乙酰柠檬酸三丁酯;*P<0.05、**P<0.01,与对照组相比。Fig. 1 The results of Morris water mazeNote: (a) The target quarter retention; (b) The number of target quarter entries; (c) The swimming route of each group offspring mice; ATBC means acetyl tributyl citrate; P<0.05, **P<0.01, compared with control group.
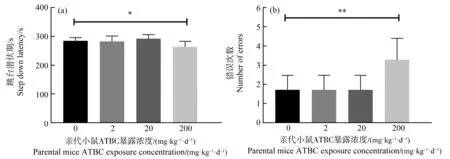
图2 跳台实验结果注:(a)跳台潜伏期;(b)错误次数;*P<0.05、**P<0.01,与对照组相比。Fig. 2 The results of step-down passive avoidance testNote: (a) Step down latency; (b) Number of errors; P<0.05, **P<0.01, compared with control group.
2.4 子代小鼠脑组织5-HT和ACh含量的变化
子代小鼠脑组织中5-HT和ACh含量变化如图7所示。200 mg·kg-1·d-1ATBC暴露后子代小鼠脑组织中5-HT和ACh含量均出现了显著性的下降。
2.5 子代小鼠脑组织氧化应激水平的变化
子代小鼠脑组织中氧化应激相关指标变化如图8所示。20 mg·kg-1·d-1和200 mg·kg-1·d-1ATBC暴露后子代小鼠脑组织中ROS水平均显著性升高(图8(a))。200 mg·kg-1·d-1ATBC暴露组子代小鼠还出现了脑组织MDA含量显著升高(图8(b))。20 mg·kg-1·d-1和200 mg·kg-1·d-1ATBC暴露组子代小鼠脑组织中GSH含量显著性下降(图8(c))。同时,200 mg·kg-1·d-1ATBC暴露组子代小鼠脑组织SOD活性也出现了显著性的下降(图8(d))。

图3 各暴露组子代小鼠脑组织病理观察(10×40;bar=50 μm) 注:(a)H&E染色;(b)Nissl染色。Fig. 3 Offspring mice brain histopathological observation of each group (10×40; bar=50 μm)Note: (a) H&E stains; (b) Nissl stains.
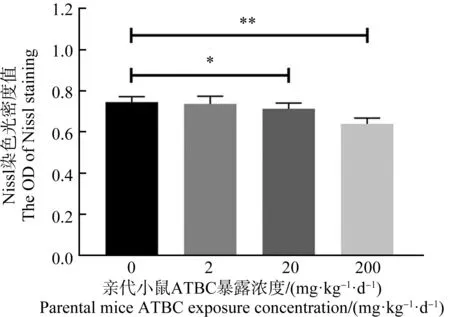
图4 各暴露组子代小鼠脑组织Nissl染色光密度值注:*P<0.05、**P<0.01,与对照组相比。Fig. 4 The optical density of Nissl staining of offspring mice brain in different groupsNote: P<0.05, **P<0.01, compared with control group.
2.6 子代小鼠脑组织TNF-α和IL-17含量的变化
子代小鼠脑组织中TNF-α和IL-17含量变化如图9所示。200 mg·kg-1·d-1ATBC暴露后子代小鼠脑组织中TNF-α和IL-17含量均有显著性的升高。
3 讨论(Discussion)
环境污染物暴露已被证明和很多疾病的发生有关[21],虽然ATBC具有极低的生殖发育毒性,安全暴露剂量被认为可达250 mg·kg-1·d-1,但是对于正常群体安全的ATBC暴露剂量对于特殊群体是否依然安全尚待研究,对于系统性评价ATBC安全性尤为重要。本研究选择对于正常实验动物相对安全的暴露剂量(2、20和200 mg·kg-1·d-1),对围产期的小鼠进行暴露,探究这些看似安全的暴露剂量对于特殊群体是否安全。

图5 各暴露组子代小鼠脑组织免疫荧光染色观察(10×40;bar=200 μm)注:(a) GFAP;(b) Iba1。Fig. 5 Offspring mice brain immunofluorescence staining observation of each group (10×40; bar=200 μm)Note: (a) GFAP; (b) Iba1.

图6 各暴露组子代小鼠脑组织免疫荧光光密度值注:(a) GFAP光密度值;(b) Iba1光密度值;*P<0.05、**P<0.01,与对照组相比。Fig. 6 The optical density of offspring mice brain immunofluorescence staining in different groupsNote: (a) OD of GFAP; (b) OD of Iba1; P<0.05, **P<0.01, compared with control group.

图7 各暴露组子代小鼠脑组织5-羟基色胺(5-HT)(a)和乙酰胆碱(Ach)(b)含量的变化注:*P<0.05、**P<0.01,与对照组相比。Fig. 7 Serotonin (5-HT) (a) and acetylcholine (Ach) (b) content in offspring mice brain of each groupNote: P<0.05, **P<0.01, compared with control group.
在Morris水迷宫定向航行实验中,亲代小鼠围产期200 mg·kg-1·d-1的ATBC暴露导致子代小鼠需要花费更多的时间才能找到逃逸平台,训练第4天和第5天的逃逸潜伏期与对照组相比均出现了显著性上升,说明子代小鼠的学习能力出现了下降。而在随后的空间探索实验中,200 mg·kg-1·d-1暴露组子代小鼠在目标平台所在象限中停留的时间以及进入该象限的次数与对照组相比都出现了显著性的下降,游泳轨迹同样体现出该组子代小鼠游泳具有盲目性,说明子代小鼠的记忆能力受到了影响。在跳台实验中,200 mg·kg-1·d-1暴露组子代小鼠表现出了跳台潜伏期显著下降,而错误次数显著上升,同样说明子代小鼠的记忆力受到影响。神经行为学检测结果表明,亲代小鼠围产期200 mg·kg-1·d-1的ATBC暴露会导致子代小鼠认知能力下降,而其他暴露组的子代小鼠并未出现显著性变化。
脑海马组织在认知能力的形成中扮演着重要角色。当大脑皮质神经元对信息进行访问时,神经元会传递信息到海马体,海马会产生反应神经网络,促进信息持久存在,形成记忆[22]。Nissl小体是细胞内合成蛋白质的重要物质,很多蛋白质包括神经递质合成所需要的很多酶类都由Nissl小体合成,所以Nissl小体在很多神经细胞损伤的研究中被视为一个重要指标[23]。小胶质细胞和星形胶质细胞。是脑组织中2种重要的胶质细胞,以往的研究显示,二者的高度活化会产生大量的ROS和细胞因子,这与很多神经疾病以及神经细胞损伤有关,而ROS、细胞因子和损伤的细胞等又可以进一步激活这2类主要的胶质细胞,以此循环反复,最终可能导致疾病和损伤的发生[24-25]。神经递质在大脑的发育中起着至关重要的作用,包括神经发生、迁移和突触的形成。它们还参与了正常大脑功能的许多方面,包括学习和记忆[9]。本研究的结果显示,200 mg·kg-1·d-1暴露组子代小鼠脑海马组织椎体神经元形态改变,Nissl小体含量下降,同时脑组织中神经递质5-HT和Ach含量出现了显著性下降。随着暴露浓度的提高,子代小鼠脑组织中胶质细胞的活化程度也显著上升。子代小鼠认知能力的下降与以上变化有一定的联系。
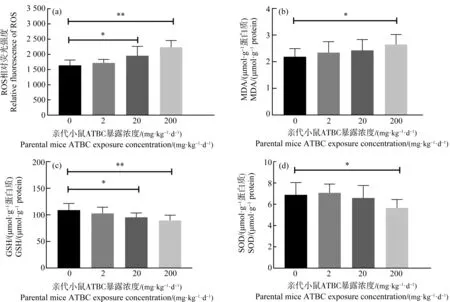
图8 各暴露组子代小鼠脑组织活性氧(ROS)水平(a)、丙二醛(MDA)含量(b)、还原性谷胱甘肽(GSH)含量(c)、 超氧化物歧化酶(SOD)活性(d)的变化注:*P<0.05、**P<0.01,与对照组相比。Fig. 8 The reactive oxygen species (ROS) level (a), malondialdehyde (MDA) content (b), glutathione (GSH) content (c) and superoxide dismutase (SOD) activity (d) in offspring mice brain of each groupNote: P<0.05, **P<0.01, compared with control group.

图9 各暴露组子代小鼠脑组织TNF-α(a)、IL-17(b)含量的变化注:*P<0.05、**P<0.01,与对照组相比。Fig. 9 TNF-α content (a) and IL-17 content (b) in offspring mice brain of each groupNote: P<0.05, **P<0.01, compared with control group.
氧化应激是引起机体细胞损伤、死亡的重要机制之一,ROS含量增加会导致生物大分子的损伤[26-27],在PAEs类塑化剂的毒性研究中已被证实[6]。本研究的结果显示,亲代小鼠围产期200 mg·kg-1·d-1ATBC暴露会导致小鼠脑组织中ROS的大量积累,脂质过氧化程度增加,MDA含量显著升高,而GSH和SOD等还原性物质的含量/活性则出现了相应的下降。这说明,亲代小鼠围产期200 mg·kg-1·d-1ATBC暴露会导致子代小鼠脑组织氧化应激水平显著性提高。根据氧化应激分级模型,持续的高水平氧化应激会进一步诱导炎症反应的发生,激活炎症信号通路,可以将氧化应激信号转换成多种细胞内活动的信号,其中就包含增加促炎症因子表达量[28]。在本研究中,亲代小鼠围产期200 mg·kg-1·d-1ATBC暴露会导致子代小鼠脑组织促炎症因子TNF-α和IL-17含量显著性提高,说明子代小鼠脑组织中高水平的氧化应激诱发了炎症水平的提高。
综上所述,亲代小鼠围产期200 mg·kg-1·d-1ATBC暴露会引起子代小鼠脑组织氧化应激,导致认知能力下降、脑组织出现病理改变。200 mg·kg-1·d-1的ATBC暴露剂量在以往的研究中虽未能导致生殖发育毒性,但在本研究中,200 mg·kg-1·d-1的ATBC围产期暴露对子代小鼠显示出了一定程度的神经毒性,而2 mg·kg-1·d-1和20 mg·kg-1·d-1的ATBC围产期暴露对子代小鼠则相对安全。该研究结果为全面评价ATBC的安全性,确保其在人类生活中的安全使用提供了一定的参考。

