信息素调控质粒介导的粪肠球菌耐药基因接合转移机制研究进展
杨雨桐,杨晓波,王尚,薛斌,李辰宇,赵辰,张曦,谌志强,王景峰,邱志刚
军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050
粪肠球菌(Enterococcusfaecalis)是一种革兰氏阳性球菌,广泛分布于在动物、人体胃肠道内以及水体和土壤等环境中。其主要来源是人畜粪便,并通过饮食、呼吸以及皮肤接触途径感染人类,从而引起感染性心内膜炎、菌血症等相关疾病[1-2]。粪肠球菌还可以作为一种指示微生物反映水环境中病原微生物的污染情况,对生态安全的风险控制具有重要意义[3]。粪肠球菌的细胞壁较厚,对氨基糖苷类及头孢类抗生素具有固有耐药性[4-5]。而近年来在畜牧业、水产养殖业以及临床上广泛应用的抗生素,也使得耐药菌株尤其是多重耐药菌株的检出率呈现逐年递增的趋势。更加严重的是,世界各地均检测出了目前仍无特效药的耐万古霉素肠球菌[6]。耐药细菌可通过医院废水、畜牧厂废水等各种途径向环境中扩散,使自然水体或土壤中耐药细菌广泛传播,进而通过食物链等途径影响人类健康[7]。粪肠球菌多重耐药性的急剧发展对人类健康及生态安全都构成了严重威胁,引发了科研人员的广泛关注。
粪肠球菌耐药的严峻之处在于其携带抗生素抗性基因的质粒、转座子等可移动遗传元件可通过水平转移在种属内或跨种属的细菌间进行传播,使其他更危险的细菌获得耐药性[8-9]。基因在细菌间的水平转移主要分为转化、转导和接合3种方式,其中接合是指通过细菌间接触从而转移质粒的方式,其转移质粒的频率和效率最高[10]。质粒是独立于染色体的能够自我复制的闭合环状DNA,有研究发现耐药基因及其相关的可移动基因元件存在于质粒上,是引起细菌耐药基因水平转移的主要原因之一[11]。肠球菌质粒一般分为接合质粒和非接合质粒,接合质粒分为信息素调控质粒和非信息素调控质粒[12]。其中,信息素调控质粒在粪肠球菌菌属中非常常见,其大小通常在37~128 kb,拷贝数较低,并且具有一种利用多肽信息素作为信号分子且仅限于肠球菌间转移的特殊接合转移机制[13-14]。信息素调控质粒相较于R质粒等其他质粒接合转移频率更高,耐药基因扩散速度更快,自然状态下R质粒接合频率只有10-6[15],而粪肠球菌携带质粒接合转移频率却可达10-3,能够造成耐药基因的快速扩散。因此研究信息素调控质粒介导的粪肠球菌耐药基因的接合转移过程对防控耐药基因水平转移具有重要意义。
1 我国部分地区环境中粪肠球菌耐药现状(Current status of drug resistance of E. faecalis in the environment in some areas of China)
在全国各地的调研中发现,耐药粪肠球菌检出率逐年攀升,耐药问题日趋严峻。不仅耐药的范围和类别逐步扩增,而且多重、交叉耐药的现象也逐渐加剧。易秀丽等[16]从鱼塘、污水沟等环境中分离出共99株粪肠球菌,其中污水沟中粪肠球菌对红霉素、土霉素等耐药率可达89.3%;多重耐药现象也十分严重,其中21%的菌株可达五重耐药。吴丽云等[17]从福建省部分河流中分离出粪肠球菌31株,发现其对红霉素的耐药率可达80.65%,对四环素的耐药率也可达74.19%。陈玉红等[18]从闽江流域的不同水样中分离出40株肠球菌菌株,发现其对检测的土霉素、红霉素、环丙沙星、氯霉素和氨苄西林5种常用抗生素均具有耐药性,其中对土霉素的耐药率可达70%。林云琴等[19]在养殖场管网水环境中分离出的42株肠球菌样本中,呈多重耐药趋势,其中就包括对万古霉素耐药,其耐药率可达14.29%。可见当前自然环境中粪肠球菌耐药形势严峻,对耐药细菌蔓延的控制刻不容缓。随着合理使用抗生素的意识逐步普及,以及粪肠球菌的实验室监测进一步深入,粪肠球菌的耐药问题是可以得到控制的,因此深入透彻地研究粪肠球菌的耐药机制也是非常必要的。
2 粪肠球菌耐药基因转移的机制(Drug resistance gene transfer mechanism of E. faecalis)
2.1 信息素调控质粒的主要特点
在临床粪肠球菌分离株中,已鉴定出多种受到信息素调控的接合质粒,其中包括携带四环素抗性基因的pCF10质粒[20-21],编码溶血素的pAD1质粒[22],携带万古霉素抗性基因的pAM373质粒[23]等等。在信息素调控质粒介导的接合转移过程中,多肽信息素将作为供、受体菌的配对信号,通过2种具有拮抗效应的信息素更高效地调控接合转移过程[24-25]。信息素调控质粒的关键调控区域大部分是高度保守的,例如质粒pCF10、pAM373和pAD1在cDNA链上均携带2个5’末端存在重叠区域的操纵子,如图1所示。这种结构可能导致转录干扰从而产生二者之间的相互负调控,在这个重叠区域内同时还编码质粒的负调控信息素[26-30]。而正是由于关键调控区域的高度保守,使得信息素调控质粒的接合转移现象和机制高度类似。本文将主要以接合质粒pCF10为例,探讨信息素调控质粒介导的耐药基因接合转移的机制。pCF10可以编码抗四环素的耐药基因,也可以响应供体细胞对多肽信息素cCF10的感应从而进行快速且有效地传播[31]。
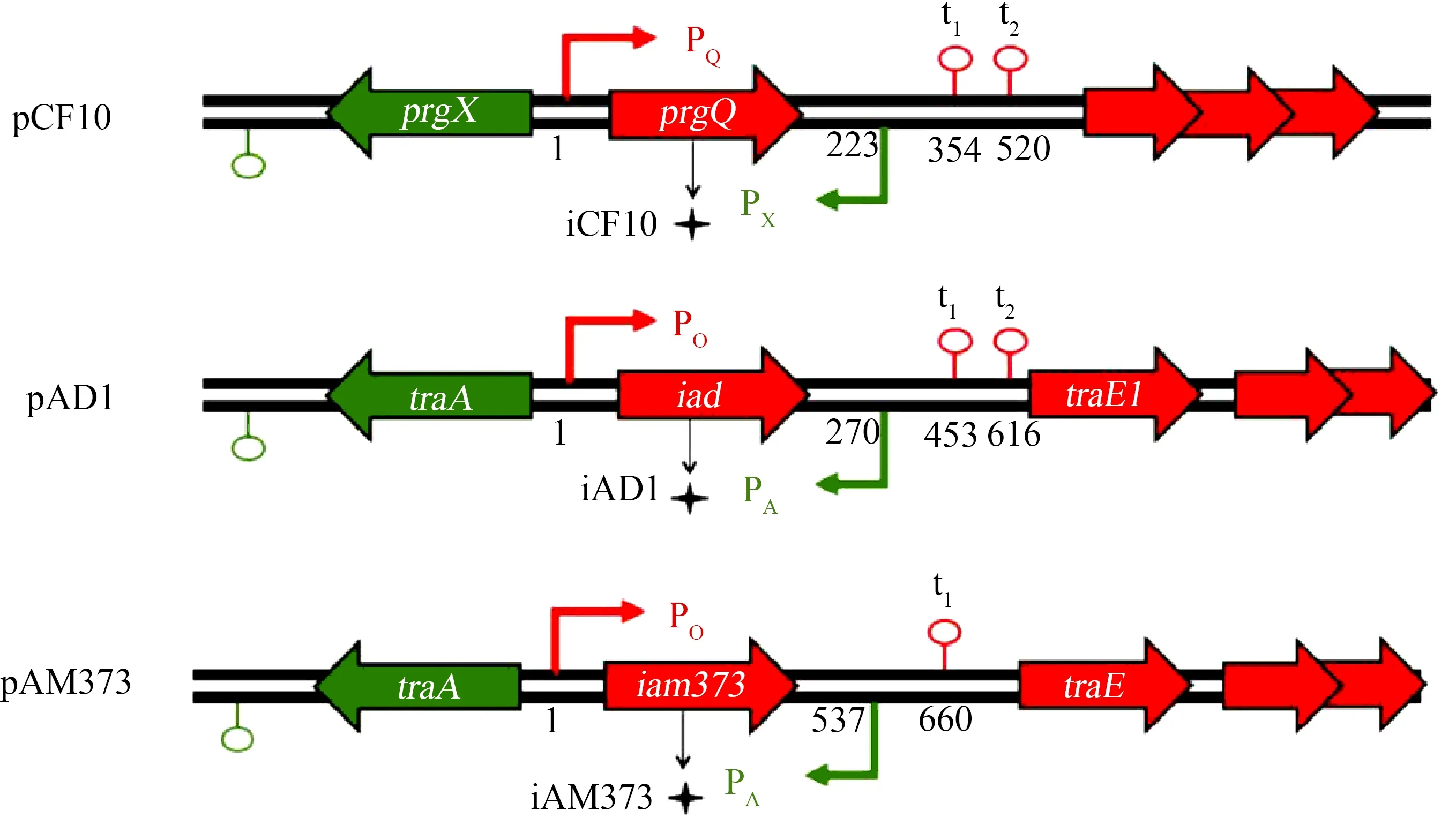
图1 信息素调控质粒中高度保守的调控区域[32]注:pCF10质粒、pAD1质粒和pAM373质粒的信息素调控区域的比较;PQ、PO、PX、PA分别表示prgQ、 iad、iam373、prgX和traA的转录起始点,重叠区域始于PQ和PO(表示为“1”),终于PX和PA(对应数字为 重叠区域核苷酸序列长度);重叠区域同时编码负调控信息素iCF10、iAD1和iAM373,在负调控信息素编码 基因与下游基因之间的区域,编码调控RNA,进而控制转录终止子t1下游接合基因的转录。Fig. 1 Substantial conservation of the critical regulatory regions in pheromone-responsive plasmids [32]Note: Comparison of the pheromone-responsive region of pCF10 to the sex pheromone plasmids pAD1 and pAM373 in their regulatory regions; PQ, PO, PX, PA indicated the transcription start sites of prgQ, iad, iam373, prgX and traA; the overlapping region start from PQ and PO(indicated as “1”), and terminate in PX and PA(the length of nucleotides of the overlapping region indicated as revelant numbers); the overlapping region also encodes the inhibitor pheromone iCF10, iAD1 and iAM373; the region between the inhibitor determinant and the downstream genes is of great regulatory importance, as it is known to encode a small regulatory RNA that participates in controlling the transcription of conjugation genes downstream of the transcriptional terminator t1.
2.2 信息素调控质粒的主要机制
2.2.1 细胞间紧密接触为接合转移提供条件
粪肠球菌主要通过基因的水平转移获得抗生素抗性基因。粪肠球菌的临床分离株中普遍存在可移动遗传元件(MGEs),如上文所述的pCF10、pAD1等接合质粒或转座子[33]。虽然信息素调控质粒可在粪肠球菌中进行高效且高频地水平传播,但该质粒的转移受到分子调控机制中信号分子的严格调控,并且只受到靠近提供质粒的供体细胞的受体细胞诱导[34]。在质粒转移频率较高的供、受体细胞混合培养液中,经常可以观察到细菌细胞有明显的聚集现象,这是由于接合转移过程中在细菌细胞间紧密接触形成了“接合桥”[35]。前期研究发现,在接合转移过程中存在一种聚集诱导剂,可以诱导聚集形成从而促进细胞配对。相关的实验结果也证实了聚集和质粒转移之间存在正相关关系[36]。接合转移过程中受体细胞将一系列信息素释放到环境中,受到诱导的供体细胞对特异性的信息素做出特异性反应产生聚集诱导剂。聚集诱导剂是接合过程中质粒编码产生的一种称为“聚集性物质”的粘性蛋白,该蛋白可以促进配对形成,进而使得质粒从供体细胞转移到受体细胞[37]。聚集性物质的表达促使供体细胞和受体细胞间进行紧密的物理接触,使得供体的质粒转移频率高达10-1[34]。Olmsted等[38]通过用特定的抗Asc10抗体阻止聚集体的形成等实验证实质粒pCF10的聚集诱导物质就是Asc10蛋白。受体细胞紧密地和供体细胞联系在一起,使得供体细胞受信息素诱导加剧,最终促进质粒的转移,为接合转移提供了先决条件。
2.2.2 拮抗信号分子对接合转移的影响
Clewell[39]在实验中发现,将受体细胞的培养基滤液加入到供体细胞中,在没有受体细胞的情况下也可以观察到细胞间的聚集现象,加入受体细胞后也可以在短时间内发生接合转移;若供体细胞未提前接触受体细胞的培养基滤液,在较短时间内不会观察到明显的转移现象。这使得人们了解到受体细胞分泌的信息素促进了供受体菌间耐药基因的接合转移。质粒pCF10的表达由受体细胞分泌的多肽信息素cCF10诱导[40],使接合转移基因和毒力基因高表达[32,41]。此外,pCF10质粒编码的多肽iCF10充当cCF10的竞争性抑制剂,防止供体细胞分泌的内源信息素进行自我诱导,并且可以抑制紧邻供体的受体细胞所分泌的cCF10的活性[32,42]。信息素cCF10和iCF10都是调节接合转移过程的信号分子,且cCF10促进接合转移进程,iCF10降低接合转移进程,二者互为拮抗作用。而在其他的信息素应答质粒中也存在类似的拮抗信号分子对,例如质粒pAD1和pAM373同样对各自的正调控信息素cAD1和cAM373做出应答,促进接合转移,同时分别编码各自的负调控信号分子多肽iAD1和iAM373作为竞争性抑制剂,防止自我诱导[43-46]。正调控信息素对质粒的接合转移有积极的影响,而负调控信息素对质粒的接合转移则有着负面调节的作用,二者之间相辅相成,互相调节,才使得接合转移过程更加高效,耐药基因扩散更加广泛。
2.2.3 通过质粒编码蛋白调控信息素的机制
信息素在进入细胞后,与一系列受体蛋白结合,从而影响接合转移过程。以质粒pCF10为例,cCF10在进入受体细胞后,将与质粒pCF10编码的主要转录调控因子PrgX结合[47-48]。当细胞中cCF10缺乏时,PrgX对编码产生抑制剂iCF10的prgQ操纵子的启动子(PQ)产生了抑制[49-50]。当供体细胞将cCF10导入受体细胞的细胞质,cCF10与PrgX结合后,PrgX对PQ的抑制将会解除,从而诱导接合转移[31,51-53]。信息素cCF10和iCF10对诱导受体细胞过程的调节通过对信号肽受体蛋白PrgX的结构域调整实现。cCF10和iCF10都与PrgX的同一结构域结合,在与cCF10和iCF10结合形成的络合物中,PrgX在晶体和溶液中都形成了四聚体,iCF10将稳定四聚体结构,而cCF10与PrgX的结合将破坏四聚体的稳定,使PrgX的结构发生了改变,其与操纵子prgQ结合位点间的相互作用被破坏[48,54]。所以当外源cCF10或产生cCF10的受体细胞加入,导致细胞内cCF10水平的增加,使PrgX结构从抑制构象转变为非抑制构象,导致抑制解除,最终诱导接合的发生。pCF10通过诱导编码iCF10的prgQ操纵子和质粒转移所启动的接合转移机制如图2所示[47]。除此之外,还有其余一些质粒编码的蛋白也能影响接合转移的过程,例如质粒编码的膜蛋白PrgY,它可以降低由供体细胞所产生的信息素的活性。PrgY的胞外结构域可以与cCF10相互作用并对其进行修饰或降解,从而降低供体细胞的内源信息素活性[55]。又如质粒上prgU基因编码的表面粘附素PrgU,Bhatty等[56]证明缺少prgU基因的细胞,cCF10的诱导具有高度毒性,会严重损害细胞包膜的完整性;而携带prgU基因的细胞过表达粘附素PrgU后,细胞对信息素不敏感,cCF10的诱导毒性降低。因此,PrgU对pCF10接合进程起到另一层负调控作用。总的来说,整个接合转移过程由质粒pCF10携带的多个基因所编码的不同种类的蛋白通过协同作用共同调节,通过相关基因蛋白调控信息素对供受体细胞的效应影响整个接合转移进程。质粒pCF10是信息素调控质粒家族中的重要代表,研究其接合转移机制对研究信息素调控质粒介导的接合转移机制具有广泛的参考价值,为防止环境中耐药基因的扩散,维护生态安全也具有重要意义。
3 展望(Prospect)
综上所述,粪肠球菌不但具有较强的天然耐药性,更因其特殊的接合转移机制,极易被诱导而发生高效的耐药基因水平转移。粪肠球菌还可以将耐药基因水平传递给其他肠球菌或其他种属的革兰氏阳性菌,包括毒力更强的金黄色葡萄球菌,导致耐药金黄色葡萄球菌的出现。一旦耐药金黄色葡萄球菌出现并造成传播,将会给人类健康和环境生态安全到来巨大的威胁[57]。目前已有研究证明,金属离子、消毒副产物等环境因素在抗生素抗性基因的扩散中产生了巨大影响[58-60]。阐明环境影响因素下耐药基因扩散规律和机制已成为环境科学领域的研究热点,是阻断耐药基因产生和控制耐药基因扩散不可或缺的科学基础。环境因素影响耐药基因扩散揭示了耐药基因水平转移的新途径,同时也提示我们关注环境污染物的生物效应形式和机制,需要我们重新认识其在环境中的行为。例如目前水体环境中广泛存在的具有生物活性或激素效应的环境污染物是否可以模拟信息素效应从而调控粪肠球菌中耐药基因的接合转移过程,还亟待进一步研究。
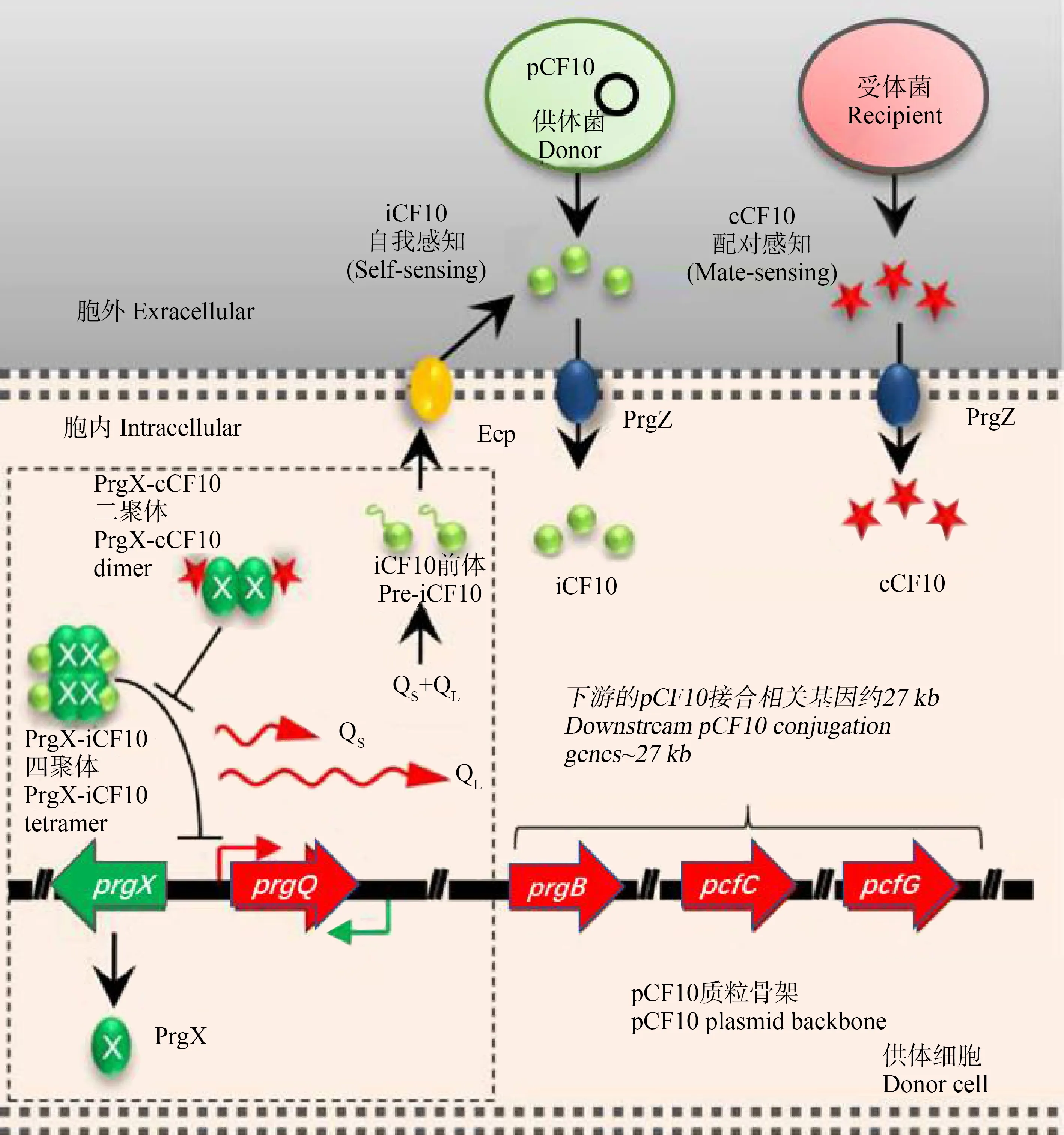
图2 粪肠球菌中2种多肽信号对接合转移的调控机制[47]注:拮抗信号分子cCF10和iCF10分别由受体细胞和供体细胞编码,并被供体细胞摄取;在供体细胞中,这些信号分子竞争性地与PrgX结合; PrgX与iCF10的复合物抑制prgQ转录启动,而PrgX与cCF10的复合物不抑制转录启动;在未诱导的供体细胞中,prgQ转录产生转录本QS和 QL,二者编码iCF10前体,前体被加工成iCF10后将分泌到胞外;当cCF10浓度足够时,prgQ转录启动,进一步影响下游基因表达。Fig. 2 Control of conjugation by two peptide signals in E. faecalis[47]Note: Antagonistic signaling molecules cCF10 and iCF10 are released by recipient and donor cells, respectively, and imported into the donor cell; these signals compete for binding to PrgX in donor cells; PrgX-iCF10 complexes repress transcription initiation of prgQ, whereas PrgX-cCF10 complexes do not; in uninduced donor cells, transcription of prgQ generates transcripts QS and QL; both of them encode for the preiCF10 polypeptide, which is processed into iCF10 and secreted into the extracellular; sufficient cCF10 is produced to induce prgQ transcription, encoding downstream genes.

