稀有鮈鲫作为鱼类胚胎急性毒性试验受试鱼种的敏感性研究
王绿平,张京佶,赵华清
上海市检测中心生物与安全检测实验室,上海 201203
水生生物毒性测试广泛应用于评估化学品的水生态环境安全,而鱼类作为水生生态环境体系中的顶级脊椎动物,具有不可替代的地位,其生态毒性数据为水生生态风险评估与风险管理提供基础,具有重要的作用和意义[1-4]。随着替代(replacement)、减少(reduction)、优化(refinement)(3Rs)原则[5]在哺乳动物毒性测试中的广泛认可,近年来,该理念在环境毒理学领域的延伸也逐渐被关注[6]。欧盟分别于2009年和2013年,禁止用化妆品原料进行脊椎动物试验以及禁止销售用动物试验检测的化妆品原料及成品。此外,欧洲《化学品的注册、评估、授权和限制》(REACH)法规也高度关注化学品毒性测试中实验动物福利问题,提倡减少测试中脊椎动物的数量,推动非动物测试(如胚胎、细胞和组织等)和替代策略的开发和验证[7]。目前,国际上首选鱼类急性毒性试验的替代方法,在2012年完成验证[8-9],于2013年由国际经济合作与发展组织(OECD)颁布,鱼类胚胎急性毒性试验(Test No. 236: Fish embryo acute toxicity (FET) test,简称OECD 236)[10]方法中指定的实验生物为斑马鱼(Daniorerio)受精卵。
采用胚胎进行毒性试验除了可满足现行动物福利法规的要求,还存在以下几个优势。(1)亲鱼体型小,易于饲养、管理方便。(2)产卵量大。通常情况下亲鱼每次可产卵几百枚至上千枚不等,对于单个试验而言,同一来源的大批量受精卵可满足统计学意义上的各类分析。(3)试验体系小。整个试验可在24孔细胞板中完成,节约了空间和成本的同时,还减少了样品的用量和废液的排放。(4)测试周期短,试验周期为96 h。从受精卵开始,通过卵黄囊吸收营养,胚胎可在24孔细胞板中存活多天,完全可以满足试验需求。且与传统鱼类急性毒性试验一致,结果具有一定可比性。(5)斑马鱼胚胎具有光学透明性[11],可通过显微镜观察各发育阶段的形态特征,定期观察各种效应指标(致死或致畸),为毒理学研究提供依据。(6)运用一定的标记技术,可透过细胞膜,准确地观察某个基因在组织器官或个体中的表达。
鱼类胚胎急性毒性试验在技术上操作方便,试验结果稳定性及重复性较高[12]。与传统的成鱼或幼鱼的急慢性试验相比,更为灵敏且能提供更多的观察效应指标。不仅可用于研究化学品的环境毒性,还可用于对污水、废水的监测和控制。在德国,斑马鱼胚胎已经作为水质监测的标准实验材料,取代了用成鱼进行的毒理学研究[13-14]。由于胚胎期对外源化学物质相对敏感,研究也表明,鱼类胚胎急性毒性数据与鱼类急性毒性数据之间有着高度相关性[15]。因此,很多欧美国家已逐渐避免使用成鱼或幼鱼作为毒性研究材料,越来越多改用胚胎试验获取毒性数据。
目前全球大部分生态毒性测试,从方法到试验物种,都是在欧美国家的应用研究基础上提出来的,对保护我国生态环境安全没有针对性。就鱼类胚胎急性毒性试验而言,OECD 236中指定的试验物种为斑马鱼(Daniorerio)受精卵,并没有涉及其他鱼种。然而生态环境保护是具有区域特异性的,研究化学品对特定区域环境的毒性效应需要有符合我国环境保护特点的试验物种进行测试。稀有鮈鲫(Gobiocyprisrarus)是我国特有的一种小型鲤科鱼类[16],我国《化学品测试方法》已将稀有鮈鲫列为推荐受试鱼种之一[17-19]。其亲鱼性成熟时间短,繁殖季节长,产卵量大,可常年人工繁殖,因此具有成为中国特有模式鱼种的潜能。由于其胚胎也具有光学透明性,可透过卵膜清晰观察胚胎发育,同时其胚胎的形态特征、发育过程及孵化时间也与多数淡水硬骨鱼类似[20]。因此,以稀有鮈鲫为实验材料,开展相关的胚胎毒理学研究有一定的基础依据。此外,稀有鮈鲫生物学特征研究已较为系统,研究工作涉及鱼病学、遗传学、环境科学、胚胎学和生理学等领域[21-24]。在此基础上,开展稀有鮈鲫在胚胎领域的毒理学研究将推动我国特有标准试验鱼种用于生态毒性测试的可持续战略,拓展稀有鮈鲫在毒性测试中的使用范围,为其最终成为国际公认的标准试验物种创造条件。
无论是科学研究、环境监测还是毒性检测,实验动物的质量是实验数据可重复性(repeatability)、再现性(reproducibility)和敏感性(sensibility)的基石。研究表明,稀有鮈鲫在鱼类胚胎急性毒性试验中的结果重复性良好[25],需评估稀有鮈鲫在鱼类胚胎急性毒性试验中的敏感性。本研究选取16种不同种类的化学品开展稀有鮈鲫胚胎急性毒性试验,通过试验和已有文献资料相结合的方式,分别将稀有鮈鲫胚胎与斑马鱼胚胎,稀有鮈鲫胚胎与其成鱼进行比较,研究稀有鮈鲫胚胎的敏感性和可比性。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1 实验动物
本研究中所使用的稀有鮈鲫亲鱼源自中国科学院水生生物研究所,为野生型封闭群(Ihb: IHB),或引种后自行繁育。为保证良好的受精率,选择实验室驯养条件下无肉眼可观察到感染或疾病、未经任何药物处理且已繁殖至少2次以上的稀有鮈鲫。鱼类驯养室内昼夜由定时器控制,提供12 h(光)∶12 h(暗)的循环光照;水温维持在(23±2) ℃,每日投喂冷冻水蚯蚓(Limnodrilushoffmeisteri)2次(早晚各1次)。试验用鱼卵以分组产卵方式获得,即将6尾性成熟的稀有鮈鲫(雌雄比为1∶2),于试验当天早晨置于交配盒中,为防止亲鱼捕食鱼卵,在交配盒中放入网架(孔径大小约为(2±0.5) mm)。为能够获得足够数量的鱼卵,平行准备6组。待灯光转暗后1~2 h,取出亲鱼,收集鱼卵。
斑马鱼亲鱼来源于国家斑马鱼资源中心,为野生型AB系。实验室驯养条件下的斑马鱼无肉眼可观察的感染或疾病,且未经任何药物处理。试验所使用的亲鱼已繁殖至少2次以上,以保证有良好的受精率。鱼类驯养室内昼夜由定时器控制,提供12 h(光)∶12 h(暗)的循环光照;水温维持在(23±2) ℃,每日投喂冷冻水蚯蚓(Limnodrilushoffmeisteri)2次(早晚各1次)。试验用鱼卵以分组产卵方式获得,即将6尾性成熟的斑马鱼(雌雄比为1∶2),于试验前一天晚上置于交配盒中,为防止亲鱼捕食鱼卵,在交配盒中放入网架(孔径大小约为(2±0.5) mm)。为能够获得足够数量的鱼卵,平行准备6组。第2天待灯光转亮后1~2 h,取出亲鱼,收集鱼卵。
采用体视显微镜观察,选择受精且无明显不规则分裂(如不对称、囊泡形成)或破损的鱼卵进行试验。如果试验用鱼卵为n,则取总数为2n的鱼卵进行镜检,挑选出合格受精卵(x)备用,并计算其受精百分率(x/2n×100%)。
1.1.2 受试化学品
参考OECD斑马鱼胚胎急性毒性试验验证报告[9]和实验室已有数据,选取16种不同类别的化学品(表1)进行鱼类胚胎急性毒性试验。同时,进行其中14种化学品的鱼类急性毒性试验。
1.1.3 试验用水
试验用水为标准稀释水(表2),并在恒温储水箱中连续曝气至氧饱和,恒温(23±2) ℃。水硬度为100~300 mg·L-1(以CaCO3计),pH为6.5~8.5。
1.1.4 仪器设备和试验容器
体式显微镜(Lumar V12,Carl Zeiss,德国);药品稳定性试验箱(MT-750B,施都凯仪器设备有限公司,中国);多参数水质分析仪(WTW 3430,Thermo Fisher,美国);电子分析天平(AL204,Mettler Toledo,瑞士);精密型照度仪(KIMO HQ210,法国);总有机碳分析仪(Multi N/C 3100,耶拿公司,德国);微电脑总硬度浓度测定仪(HI96735,HANNA仪器公司,德国)。灭菌24孔标准带盖板;5 L玻璃圆缸。
1.2 鱼类胚胎急性毒性试验方法
按照《OECD化学品测试准则No. 236鱼类胚胎急性毒性试验》[10]进行试验设计并制定试验方案,选用3,4-二氯苯胺(3,4-DCA)、五水硫酸铜(CSP)、2,3,6-三甲基苯酚(2,3,6-TMP)、二甲基亚砜(DMSO)、七水硫酸锌(ZSH)、三甘醇(TEG)、氯化钠(SC)、十二烷基硫酸钠(SDS)、重铬酸钾(PD)、甲基异噻唑啉酮(MIT)、二苯甲酮(BP)、二氯苯氧氯酚(TCS)、1,2-苯并异噻唑啉-3-酮(BIT)、三唑酮(T)、多菌灵(C)和N-(4-氯苯基)-N’-(3,4-二氯苯基)脲(三氯卡班,TCC)16种化学品分别进行稀有鮈鲫和斑马鱼胚胎急性毒性试验,评价稀有鮈鲫胚胎对化学品的敏感性。
1.2.1 试验原理
将新受精的鱼类胚胎暴露于不同浓度的样品水溶液中96 h。期间每24 h,观察并记录以下1~4个死亡表征:(1)卵凝结;(2)体节缺失;(3)尾部未分离;(4)无心跳。当暴露结束时,通过上述4个表征的阳性结果确定急性毒性,并计算半数致死浓度(LC50)值。

表1 受试化学品基本信息Table 1 The basic information of the test chemicals

表2 标准稀释水的配制方法Table 2 The preparation method of standard diluted water
1.2.2 试验条件
试验用水为标准稀释水,并在储水箱中24 h连续曝气;试验温度(26±1) ℃;每天12 h光照。暴露时间:96 h。试验开始:最晚在16细胞期前暴露于试验溶液中。试验方式:更新式,更新频率为24 h。试验溶液:在已预处理24 h的24孔板中,每孔注入新鲜制备的试验溶液。
1.2.3 试验操作
母液制备:可溶化学品(CSP、DMSO、ZSH、TEG、SC、SDS、PD和MIT)均于试验当天,称取适量样品直接溶于一定体积的试验用水中配制成高浓度的样品母液,其中CSP和ZSH用去离子水配制。低水溶性化学品(3,4-DCA、2,3,6-TMP、BP、TCS、BIT、T和C)于试验前3 d,称取适量样品添加到一定体积的的试验用水中,避光连续磁力搅拌72 h,经0.45 μm硝酸纤维素膜过滤后配制成试验体系下的样品饱和溶液作为样品母液。难溶性化学品(TCC)用助溶剂DMSO配制系列浓度的样品母液。
试验溶液制备:根据母液实测浓度,将适量的样品母液添加到试验用水中,配制成一定浓度的试验溶液。
暴露浓度:根据文献数据和预试验结果,各化学品设置5或6个试验浓度组(表3),均以几何级数分布,浓度的间隔系数不超过2.2,同时,每组设1个空白对照组(试验用水),对于斑马鱼,另设置1个4 mg·L-1的3,4-DCA阳性对照组,所有试验组均不设平行。
胚胎分配:所有试验均在标准24孔板中完成,每孔1个受精卵。样品组各浓度20个/板;以试验用水为介质,在上述各板中另放入4个鱼卵作为板内质控;空白对照组24个/板;阳性对照组(3,4-DCA,4 mg·L-1,斑马鱼适用)(图1)。
观察与记录:按1.2.4描述的原则进行观察和记录。试验结束时,如板内质控死亡超过1个,则整板无效,该浓度组剔除。
水质参数测定:在试验开始和结束时测定对照组和最高浓度样品组的硬度和电导率,试验期间每次更新前后测定空白对照组和最高浓度样品组的pH。在试验结束时,测定空白对照组和最高浓度样品存活胚胎组的溶解氧浓度。试验期间,每日测定1次温度,测定温度时,随机选取3个试验容器进行测定。
1.2.4 死亡表征的观察和判定
每个受试胚胎每24 h观察以下几个终点:卵凝结、体节未形成、尾部未与卵黄囊分离、失去心跳,观察到上述表征之一即可判定死亡。此外,从48 h开始,每日观察1次样品组和空白对照组的孵化数。
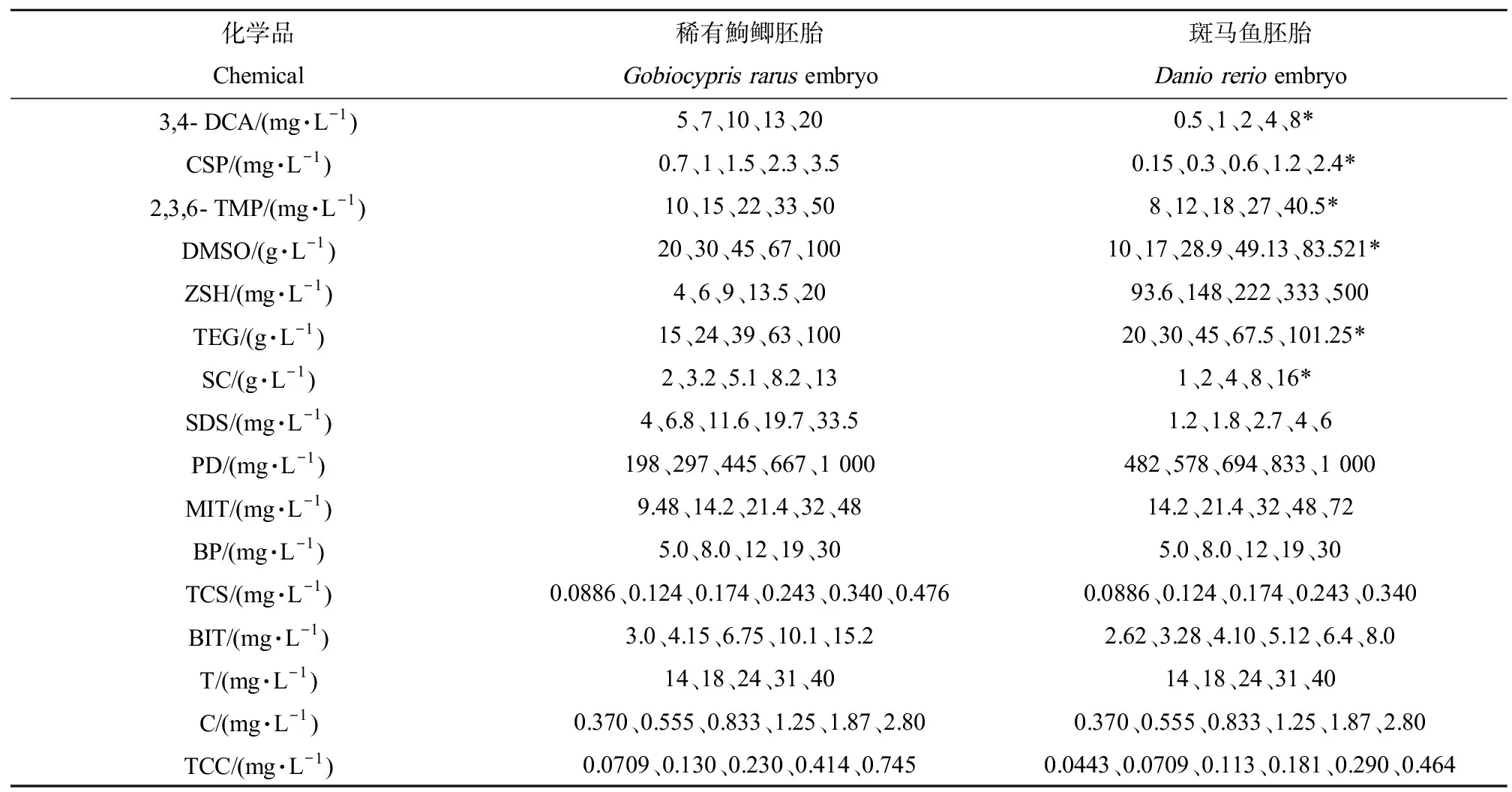
表3 各化学品在鱼类胚胎急性毒性试验中的浓度设置Table 3 Concentrations of each chemical in Fish Embryo Acute Toxicity (FET) test
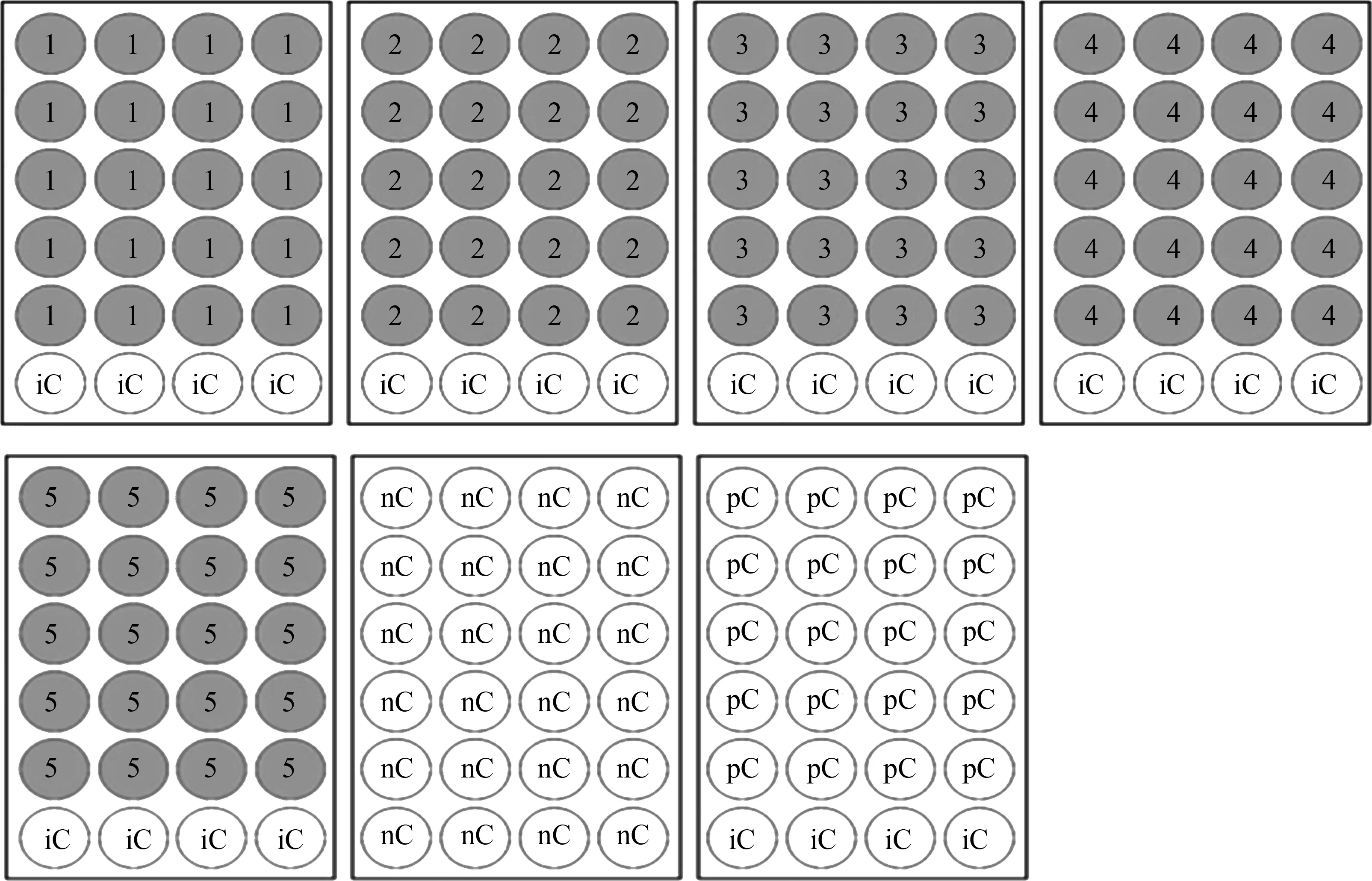
图1 鱼类胚胎急性毒性(FET)试验24孔板布局图注:1~5为5个试验浓度样品组;nC为空白对照组(试验用水);iC为板内质控(试验用水); pC为阳性对照组(3,4-DCA,4 mg·L-1,斑马鱼适用)。Fig. 1 Layout of 24-well pate for Fish Embryo Acute Toxicity (FET) testNote: 1~5 represent five test concentration groups; nC represents blank control group (test water); iC represents quality control in test plate (test water); pC represents positive control group (3,4-DCA, 4 mg·L-1, for Danio rerio).
1.2.5 试验有效性判断
参照OECD TG 236,本试验有效性判断原则为:试验用胚胎总受精率≥70%;试验期间,试验容器中温度维持在(26±1) ℃之间;试验结束时,空白对照组胚胎存活率≥90%,空白对照组胚胎孵化率≥80%,阳性对照组(3,4-DCA,4 mg·L-1,斑马鱼适用)死亡率至少为30%,空白对照组和最高浓度样品组试验溶液的溶解氧含量≥80%空气饱和值。
1.2.6 数据处理
计算试验开始后24、48、72和96 h各试验组(各板)胚胎的累计死亡率,绘制浓度-死亡率曲线图。采用点估计法估算96 h-LC50值及95%置信限。分析用软件ToxCalc(v5.0.32)完成。
1.3 鱼类急性毒性试验方法
按照《OECD化学品测试准则No. 203鱼类急性毒性试验》[12]进行试验设计并制定试验方案,选用CSP、2,3,6-TMP、DMSO、ZSH、TEG、SC、SDS、MIT、BP、TCS、BIT、T、C和TCC 14种化学品进行鱼类急性毒性试验,评价稀有鮈鲫对化学品的敏感性。
1.3.1 试验原理
在规定条件下,将试验鱼暴露于不同浓度的样品水溶液中96 h。在24、48、72和96 h时分别记录试验鱼的死亡数,确定96 h-LC50。
1.3.2 试验条件
试验用水为标准稀释水,并在储水箱中24 h连续曝气;试验温度(23±2) ℃;每天12 h光照。暴露时间96 h,试验方式为更新式,更新频率为24 h。
1.3.3 试验操作
母液制备:可溶化学品(CSP、DMSO、ZSH、TEG、SC、SDS和MIT)均于试验当天,称取适量样品直接溶于一定体积的试验用水中配制成高浓度的样品母液。低水溶性化学品(2,3,6-TMP、BP、TCS、BIT、T和C)于试验前3 d,称取适量样品添加到一定体积的的试验用水中,避光连续磁力搅拌72 h,经0.45 μm硝酸纤维素膜过滤后配制成试验体系下的样品饱和溶液作为样品母液。难溶性化学品(TCC)用助溶剂DMSO配制系列浓度的样品母液。
试验溶液制备:根据母液实测浓度,将适量的样品母液添加到试验用水中,配制成一定浓度的试验溶液。
暴露浓度:根据预试验结果,13种化学品设置5或6个试验浓度组(表4),均以几何级数分布,浓度的间隔系数不超过2.2;化学品C设置1个试验浓度组进行限度试验,同时,每组设1个空白对照组(试验用水),对于使用助溶剂的样品,另设置1个助溶剂对照组,所有试验组均不设平行。
试验鱼分配:所有试验均在盛有4 L试验溶液的5 L玻璃圆缸中完成,所有试验对照组和各浓度组均放入7尾鱼。试验开始前在驯化群随机选择10尾鱼进行体质量和总长的测定,并计算试验鱼的承载量。
观察与记录:在试验开始后0、24、48、72和96 h观察并记录各试验容器内试验鱼的死亡数和异常表征。
水质参数测定:在试验开始前测定一次试验用水的硬度和总有机碳(TOC)。在试验开始、每一次更新前后及试验结束时,测定并记录所有试验溶液的pH值、溶解氧和温度。
1.3.4 试验有效性判断
参照OECD TG 203,本试验有效性判断原则为:试验结束时,空白对照组试验鱼的死亡率≤10%,试验期间,试验容器中温度维持在(23±2) ℃之间,溶解氧含量≥60%空气饱和值。
1.3.5 数据处理
计算试验开始后24、48、72和96 h各试验组试验鱼的累计死亡率,绘制浓度-死亡率曲线图。采用点估计法估算96 h-LC50值及95%置信限。分析用软件ToxCalc(v5.0.32)完成。
2 结果与讨论(Results and discussion)
2.1 化学品对2种鱼类胚胎急性毒性结果比较
各次试验开始时胚胎受精率均超过70%,空白对照组存活率为100%,孵化率为91.7%~100%;斑马鱼试验中,阳性对照组(3,4-DCA,4 mg·L-1)死亡率为95.0%~100%;样品组板内质控均无死亡发生。试验溶液温度维持在(26±1) ℃之间,空白对照组和最高浓度样品组试验溶液的溶解氧含量均超过80%空气饱和值,根据1.2.5描述的原则,本试验有效。
如表5所示,16种化学品对稀有鮈鲫胚胎和斑马鱼胚胎的96 h-LC50值比较可知,稀有鮈鲫胚胎和斑马鱼胚胎对其中15种化学品的敏感性相近,其中TEG、PD、MIT和BIT等4种化学品,稀有鮈鲫胚胎的敏感性优于斑马鱼。ZSH对稀有鮈鲫胚胎的96 h-LC50值为10.4 mg·L-1,斑马鱼的为238 mg·L-1,两者差异约22.9倍,可见稀有鮈鲫胚胎对ZSH异常敏感。此外,3,4-DCA、CSP、2,3,6-TMP、DMSO、SC、SDS、BP、TCS、T、C和TCC等11种化学品,斑马鱼胚胎的敏感性略优于稀有鮈鲫胚胎,但毒性值差异在1.02倍~6.05倍之间,有很好的可比性。鉴于化学品理化性质的不同和生物物种间的差异,稀有鮈鲫胚胎的敏感性不亚于斑马鱼胚胎,适宜鱼类胚胎急性毒性试验的应用。

表4 各化学品在鱼类急性毒性(FAT)试验中的浓度设置Table 4 Concentrations of each chemical in Fish Acute Toxicity (FAT) test

表5 化学品对2种鱼类胚胎的96 h半数 致死浓度(96 h-LC50)Table 5 The median lethal concentration of chemicals at 96 h (96 h-LC50) to two kinds of fish embryos
2.2 化学品对稀有鮈鲫胚胎和成鱼急性毒性结果比较
鱼类胚胎阶段作为鱼类全生命周期的最初期,通常其敏感性会优于或不亚于其他时期。如表6所示,16种化学品对稀有鮈鲫胚胎及其成鱼的96 h-LC50值比较可知,稀有鮈鲫胚胎及其成鱼对其中15种化学品的敏感性相近,其中2,3,6-TMP、ZSH、TEG、TCS、BIT和C等6种化学品,稀有鮈鲫胚胎的敏感性优于稀有鮈鲫成鱼。对于3,4-DCA、CSP、DMSO、SC、SDS、PD、MIT、BP、T和TCC等10种化学品,稀有鮈鲫成鱼的敏感性略优于稀有鮈鲫胚胎,这可能是化学品试验溶液暴露条件的不同导致的[28],但毒性值差异在1.13倍~5.57倍之间,有很好的可比性。此外,通过分析软件SPSS Statistics 17.0对稀有鮈鲫胚胎及其成鱼96 h-LC50值进行相关性分析,得出两者具有较好的相关性(P=0.879)。由此可见,稀有鮈鲫胚胎与其成鱼相比,敏感性类似,具有成为成鱼急性毒性试验替代方法的应用潜力。Dang等[29]和Lammer等[30]的研究表明,部分化学品理化性质的差异会导致化学品对成鱼的敏感性优于胚胎,但胚胎和成鱼之间均具有较好的相关性,试验数据为鱼类胚胎急性毒性试验替代鱼类急性毒性试验提供了有力的科学支持,与本文结论一致。
此外,关于胚胎急性毒性试验(FET)作为成鱼急性毒性试验(AFT)的替代测试,有研究通过985个斑马鱼胚胎试验和1 531个成鱼试验,建立数学模型[15],借助FET数据预测AFT值,实现试验和非试验相结合,在尽可能减少动物试验的前提下,为化学品环境管理提供更多基础数据。研究将16种化学品的FET试验数据代入公式(log FET LC50=(0.989×log AFT LC50)-0.195[15]),预测AFT值(表7)。结果可见,所有AFT预测值和试验值相比,差异均未超过一个数量级,表明2种数据间相互预测和使用具有一定的可操作性。如后续有更多数据累积,可通过相互关系,建立稀有鮈鲫特有的FET与AFT的推断公式,届时,数据将更为可靠。

表6 化学品对稀有鮈鲫胚胎和成鱼的96 h-LC50Table 6 The 96 h-LC50 of chemicals to Gobiocypris rarus embryos and adult Gobiocypris rarus

表7 化学品对稀有鮈鲫的FET和成鱼急性毒性 试验(AFT)与非试验结果Table 7 The results of chemicals to Gobiocypris rarus in FET, adult fish acute toxicity test (AFT) and non-test results
2.3 化学品对鱼类胚胎和/或成鱼的96 h-LC50毒性分级
由于国内现用稀有鮈鲫作为试验材料,对不同种类化学品进行胚胎急性毒性试验的数据有限,且就敏感性与斑马鱼和/或稀有鮈鲫成鱼进行比较的数据有限,同时各试验条件、暴露周期都不尽相同,因此现阶段无法就稀有鮈鲫胚胎的敏感性优劣作直接判断。但由表5和表6仍可知,稀有鮈鲫胚胎急性毒性结果无论与同一种属不同生命周期比较,还是与不同鱼种(斑马鱼)相比,敏感性均类似[30]。
此外,依据《新化学物质危害评估导则》(HJ/T 154—2004)[31]和《化学品分类和标签规范 第28部分:对水生环境的危害》(GB 30000.28—2013)[32]的危害分级标准:96 h-LC50值≤1 mg·L-1,毒性极高;96 h-LC50值为1~10 mg·L-1,毒性高;96 h-LC50值为10~100 mg·L-1,毒性中等;96 h-LC50值>100 mg·L-1,毒性低。16种化学品胚胎急性毒性试验结果中(表8),稀有鮈鲫和斑马鱼有11个毒性分级一致,另有5个仅相差1个等级;稀有鮈鲫胚胎和成鱼有12个毒性分级一致,另有3个仅相差1个等级,仅1个相差2个等级。由此可见,虽然稀有鮈鲫胚胎毒性数据与斑马鱼或稀有鮈鲫成鱼比较有数值上的不同,但其敏感性就毒性等级划分而言,均没有实质的差异。
综上所述:本次研究选取16种不同种类的化学品开展稀有鮈鲫胚胎急性毒性试验,通过实验和已有文献资料相结合的方式,分别将稀有鮈鲫胚胎与斑马鱼胚胎,稀有鮈鲫胚胎与其成鱼进行比较。结果表明,可能由于不同试验暴露体系的不同、化学品理化性质的不同、生物物种间的差异等原因,导致毒性值存在差异,但稀有鮈鲫胚胎的敏感性与两者均类似,具有成为成鱼急性毒性替代试验的应用潜力。
由此可见,稀有鮈鲫胚胎生物学特征与斑马鱼类似,急性毒性试验结果也体现了良好的稳定性和可重复性,其胚胎敏感性也处于可接受水平。作为一种中国本土的标准试验鱼种,适宜进行鱼类胚胎急性毒性试验的应用。另外,本研究的实施,既可顺应国际上的替代技术研究趋势,同时也可以拓展本土鱼种稀有鮈鲫在替代试验中的应用范围,为建立稀有鮈鲫全生命周期的国家标准提供数据基础。

表8 化学品对鱼类胚胎和成鱼 的96 h-LC50毒性分类Table 8 The toxicity classification of 96 h-LC50 of chemicals to fish embryos and adult fish

