miR-140-3p在侵袭性念珠菌感染患者中的诊断意义及预后价值
乔智灏, 李嘉莹, 刘昶
(1.南方医科大学 第七附属医院 重症医学科, 广东 佛山 528300; 2.广东同江医院 药剂科, 广东 佛山 528300; 3.广东同江医院 重症医学科, 广东 佛山 528300)
真菌感染不断增加,对生命和健康构成巨大威胁[1].侵袭性念珠菌感染(invasive candida infection,ICI)是临床上常见的感染类型[2].统计显示ICI是血液感染的第4大原因之一,并且每年有超过25万人因ICI致病,并且致死率高达40%[3].作为共生微生物,白色念珠菌主要定植于多个黏膜部位,包括口腔、胃肠道和泌尿生殖道,在健康个体中无症状[4].但是在易感染人群中,白色念珠菌可进入血液并引起经常致命的播散性感染[5].然而ICI后无明显的临床特征,并且常规的检测方法灵敏度不高[6],这就导致临床上易出现漏诊,延误最佳治疗时机.因此亟需寻找一种有效、准确的ICI诊断标志物来提升诊断水平.
microRNA(miR)是一种长度约18~24nt的非编码RNA,是非编码RNA家族重要成员[7-8].miR可通过与下游靶向mRNA互补序列配对,起到调节下游mRNA表达的作用[9].研究显示,miR参与了人类多种急性与慢性病、炎症、癌症、感染及器官损伤[10-11].miR-140-3p是人们早期发现的一种miR,位于人16q22.1染色体上[12].目前关于miR-140-3p的研究主要以肿瘤为主.例如miR-140-3p靶向PD-L1抑制大肠癌细胞生长和诱导细胞凋亡,miR-140-3p靶向FOXQ1抑制膀胱癌细胞增殖和侵袭[13].但是,近年来研究发现miR-140-3p可通过调节下游基因参与细菌感染,并具有抑制细胞炎症反应的作用[14].miR-140-3p在ICI中是否具有同样作用仍不明确.Muhammad等[15]在miR表达谱分析中发现ICI患者中miR-140-3p表达降低,这说明miR-140-3p可能参与了ICI的发生.
本研究旨在探究miR-140-3p在ICI患者中的诊断意义以及预后价值,为临床诊断与预后观察提供潜在观察标志物.
1 资料与方法
1.1 临床资料
选择2021年1月至2021年6月在广东同江医院确诊治疗的60例侵袭性念珠菌感染患者作为本研究实验组,另收集同期在广东同江医院进行体检的正常人50例作为对照组.本研究获得该院医学伦理委员会的批准.
1.2 纳入排除标准
1.2.1 纳入标准
患者符合2020年制定的《中国成人念珠菌病诊断与治疗专家共识》[16].患者血培养白念珠菌均为阳性,临床症状符合真菌感染.患者在本研究前并未进行过针对性治疗.
1.2.2 排除标准
单纯口腔、泌尿系统、阴道念珠菌感染患者,器官移植患者、粒细胞缺乏患者、免疫抑制患者、合并肿瘤患者及对本次药物不耐受患者.
1.3 治疗方案
实验组患者采用卡泊芬净降阶梯治疗,具体方案如下:注射用醋酸卡泊芬净(正大天晴药业集团股份有限公司;国药准字H20193172)每日400 mg静脉滴注,共5 d,随后改用氟康唑胶囊(上海健坤制药有限公司;国药准字H20073022)每日200 mg口服,根据患者的临床症状、影像学表现,血、痰和肺灌洗液等真菌连续培养阴性>1周,作为停药指标.
1.4 实时荧光定量聚合酶链反应(qRT-PCR)检测
使用TRIzol试剂对收集到的血清进行总RNA提取,采用PrimeScriptTMRT试剂盒对总RNA进行逆转录,收集cDNA为扩增准备.采用PowerUpTMSYBRTMGreen Master Mix试剂盒与ABI 7500 PCR仪进行PCR扩增.反应体系与反应条件按照试剂盒说明书进行配置.miR-140-3p采用U6作为内参,使用2-ΔΔ的Ct方法用于计算相对mRNA表达[17].每个实验进行3次.miR-140-3p上游引物5’-GCGCGTACCACAGGGTAGAA-3’,下游引物5’AGTGCAGGGTCCGAGGTATT-3’,U6上游引物5’-CTCGCTTCGGCAGCACA-3’,5’-AACGCTTCACGAATTTGCGT-3’.
1.5 观察指标
观察实验组与对照组血清中miR-140-3p表达水平和诊断价值.观察患者治疗前与治疗后(2周)miR-140-3p表达变化水平.分析影响ICI预后的危险因素.收集患者治疗前血清1-3-β-D葡聚糖数据,采用logistic回归对miR-140-3p与血清1-3-β-D葡聚糖进行预测得到联合诊断数据,采用ROC曲线分析联合检测价值.
观察治疗前后miR-140-3p与患者临床疗效之间的关系.
1.6 疗效评估
按卫生部颁发的抗感染药物临床研究指导原则[18]进行评价,疗效分为痊愈、显效、进步、无效 4个级别.(1)痊愈:侵袭性真菌感染的相关症状、体征、实验室检查、影像学检查及病原学检查全部恢复正常; (2)显效:病情明显好转,但上述症状、体征、实验室检查、影像学检查及病原学检查中有1项未完全恢复正常;(3)进步:用药后病情有好转,但不明显;(4)无效:用药后病情大改善或加重者.
1.7 统计学分析
采用SPSS 24.0统计学软件对数据进行分析处理,采用Graphpad 8绘制结果图形;计数资料采用卡方检验;计量资料以均数±标准差的形式表示,组间比较采用独立样本t检验,组内比较采用配对t检验;采用Logistic回归分析对患者预后进行评估;采用受试者工作曲线(ROC)分析miR-140-3p在ICI患者中的诊断价值;非正态分布数据用四分位数表示,采用非参数检验;对多因素Logistic回归有意义指标进行ROC曲线绘制;分析这些指标在预测临床疗效中的价值.P<0.05为差异具有统计学意义.
2 结果
2.1 基线资料比较
两组的临床基线资料显示,实验组与对照组患者年龄,性别,体质指数(body mass index,BMI),既往病史,吸烟史,均不存在统计学差异(P>0.05),见表1.
2.2 miR-140-3p在ICI中的表达与诊断价值
本研究通过qRT-PCR检测了ICI患者中血清中miR-140-3p相对表达水平,结果发现:与对照组相比,实验组患者血清中miR-140-3p表达水平明显降低,存在统计学差异(P<0.001);与对照组相比,实验组患者血清中1-3-β-D葡聚糖浓度水平明显上升,存在统计学差异(P<0.001).此外,绘制ROC曲线发现,miR-140-3p在诊断ICI的曲线下面积为0.834,特异度为73.46%,灵敏度78.33%,约登指数51.08%,Cut-off值为0.938.1-3-β-D葡聚糖在诊断ICI的曲线下面积为0.755,特异度为100.00%,灵敏度68.33%,约登指数68.33%,Cut-off值为65.34.而两者联合检测曲线下面积为0.924,特异度为83.33%,灵敏度91.83%,约登指数75.17%,Cut-off值为0.437,见图1.

表1 两组临床资料比较Table 1 Comparison of patient clinical data n(%)

1)P<0.001
2.3 治疗前后miR-140-3p在ICI中的表达
与治疗前相比治疗后患者血清中miR-140-3p表达水平出现上升,两组间比较存在显著差异(P<0.01),见图2.
2.4 miR-140-3p在ICI预后良好组中的表达
本研究进一步分析了治疗前后患者血清中miR-140-3p表达与临床疗效的关系.患者通过治疗后痊愈26例、显效10例、进步13例、无效11例.比较4组人群治疗前后血清中miR-140-3p表达发现,治疗前miR-140-3p表达随着疗效程度恶化表达逐渐升高,具有统计学差异(P<0.05),而治疗后miR-140-3p表达随着患者临床疗效的改善逐步降低,存在统计学差异(P<0.05),此外,根据疗效分组发现,预后良好组患者治疗前血清中miR-140-3p的表达明显低于预后一般组,存在统计学差异(P<0.01),见图3.

1)P<0.05

1)P<0.05;2)P<0.01
2.5 ICI预后危险因素分析
用单因素Logistic回归分析判断影响ICI预后的危险因素,以预后良好作为自变量(Y),收集到的因素作为因变量(X),见表2.结果发现miR-140-3p、年龄、糖尿病是ICI患者预后危险因素(P<0.05).随后,对单因素分析存在差异的指标进行多因素向后LR回归分析,发现miR-140-3p、年龄、糖尿病是ICI患者预后的独立危险因素(P<0.05),见表3.为了验证这些因素对ICI患者预后的预测价值绘制了ROC曲线,表明miR-140-3p在ICI患者预后的预测价值较高,见图4,表4.

表2 ICI预后因素的赋值表Table 2 Assignment table for prognostic factors

表3 ICI预后危险的多因素Logistic回归分析Table 3 Logistic regression analysis of prognostic risk of ICI
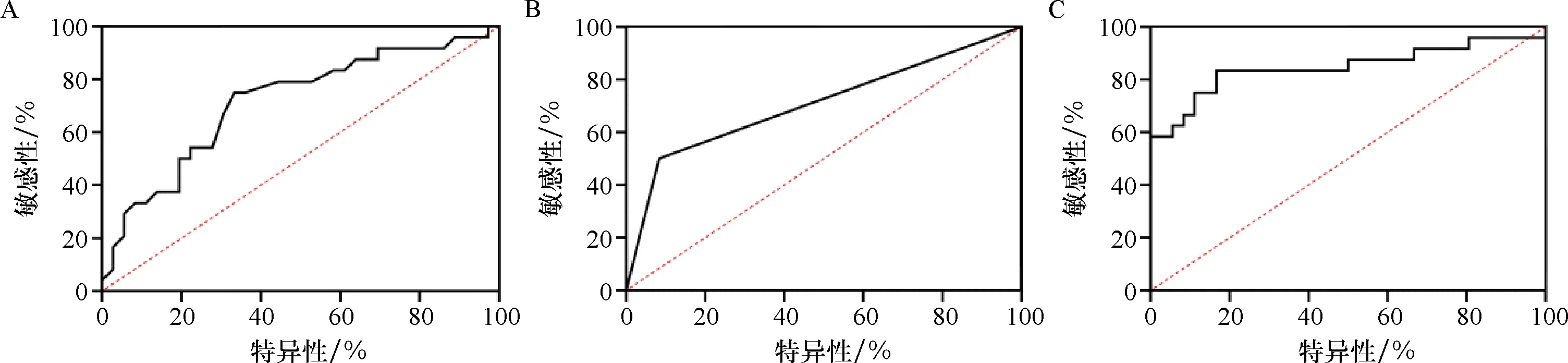
A:年龄因素;B:糖尿病因素;C:miR-140-3p因素.A:Age factor; B:Diabetes factor; C:miR-140-3p factor.

表4 预后因素的ROC参数Table 4 ROC parameters for prognostic factors
3 讨论
在美国的流行病调查中显示ICI是美国第4大血行感染疾病[19].并且近年来的研究发现,ICI在发展中国家的感染趋势逐渐严重[20].由于实验室真菌培养时间较长,确诊后患者可能错过了最佳的治疗时间[21].而病理检测作为有创检测可能会增加患者感染的可能[22].这就导致ICI患者早期诊断非常困难.因此,寻找检测时间短,检出率高的生物标志物就显得尤为重要.
miR是一种内源性小型RNA分子,可以调节信使RNA(mRNA)的丰度以及蛋白质的表达,还可以有多个甚至上百个mRNA靶标来结合,对于各种生物学过程可能均具有一定参与性[23].据报道有许多致病物种通过miR改变宿主的细胞反应,miR现在被认为是细胞机制的主要调节因子[24].miR-140-3p与miR-140-5p同属于miR-140家族.早期的研究中发现,miR-140-3p在肿瘤、炎症和免疫调节中起到了重要作用[25].Muhammad等[15]的研究中发现miR-140-3p在ICI患者血液分离出的白色念珠菌中低表达,这说明miR-140-3p可能参与了ICI的发生.研究表明真菌细胞壁中含有大量1-3-β-D葡聚糖成分,1-3-β-D葡聚糖浓度的上升可反应ICI病情的严重程度,是诊断ICI的重要手段[26].本研究通过对ICI患者血清中miR-140-3p与1-3-β-D葡聚糖的表达进行检测,结果发现miR-140-3p在ICI患者中的表达要远低于正常人群,而ICI患者中1-3-β-D葡聚糖表达远高于正常人群.ROC曲线分析发现miR-140-3p在诊断ICI中的曲线下面积>0.8,而1-3-β-D葡聚糖在诊断ICI中的曲线下面积<0.8,但是两者联合检测ICI的曲线下面积为0.924,这说明miR-140-3p低表达可以提升1-3-β-D葡聚糖在诊断ICI中诊断价值,提高其灵敏度.提示miR-140-3p可能是ICI的潜在的生物诊断标志物.
卡泊芬净作为抗真菌药物,通过抑制1-3-β-D葡萄糖合成破坏真菌细胞壁[27].1-3-β-D葡萄糖作为真菌细胞壁的抗原成分,在真菌结构完整中起到重要作用,一定程度上可以促进宿主体内炎症反应发生[28].研究发现卡泊芬净在体外和体内对念珠菌表现出极好的活性,它们具有杀灭活性、低耐药性和更高的安全性[29],因而其迅速成为治疗念珠菌血症和其他形式的侵袭性念珠菌感染的首选药物.本研究观察卡泊芬净治疗后患者血清中miR-140-3p的表达变化,发现血清中miR-140-3p的表达明显上升.早期研究发现miR-140-3p在PC12细胞的氧糖剥夺再灌注模型中表达明显降低,而通过上调减轻炎症的发生[30],这说明miR-140-3p可能参与了机体炎症反应.真菌感染会引起患者出现感染性休克,内毒素入侵使机体中炎症细胞释放大量炎症因子[31].因此推测患者采用卡泊芬净治疗后,念珠菌中1-3-β-D葡萄糖合成受到抑制,细胞壁受到破坏,导致患者体内炎症减轻,从而使得患者体内的miR-140-3p表达降低.
最后,本研究小组对患者治疗后的疗效进行了评估,根据临床疗效不同,比较了患者治疗前后血清中miR-140-3p表达与临床疗效的关系,结果显示患者血清中miR-140-3p随着患者临床疗效的恶化逐渐降低.进一步分组比较发现治疗前miR-140-3p表达水平在预后良好组中表达高于预后一般组.这说明miR-140-3p可能是ICI患者的预后预测指标.为了验证此项推测,我们进行了Logistic回归分析,结果证明,治疗前miR-140-3p,低表达是影响ICI患者预后的独立危险因素,并通过ROC曲线分析验证其价值.
综上所述,本研究初步确定了miR-140-3p在ICI中的诊断与预后价值.miR-140-3p在侵袭性念珠菌患者中低表达,可提升1-3-β-D葡聚糖对ICI的灵敏度,并且与患者预后密切相关,有望成为潜在的预后观察指标.但是本研究还存在一定的局限.首先,样本收集时间较短,患者人数较少,并且并未对患者进行长期的随访;其次,关于卡泊芬净具体是通过何种机制调节miR-140-3p改善ICI进程仍不明确;最后,本研究样本单一,仅对患者血清中miR-140-3p的表达进行检测,miR-140-3p在ICI患者外泌体、外周血单个核细胞是否同样存在表达,还需进一步验证,望在后续的研究中开展更多的临床与基础实验,来完善研究结论.
作者贡献声明
乔智灏:提出研究思路和框架,实验操作,撰写并修改论文;李嘉莹:指导实验,指导数据分析;刘昶:数据收集及分析.
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.
——谷物β-葡聚糖的最新研究进展

