改良同步化G显带及染色体微阵列分析在脐血产前诊断中的应用
邓国生 何才通 赖玉青 陈晓 潘金姐
广西玉林市妇幼保健院(广西玉林537000)
脐血染色体核型分析及染色体微阵列分析(chromosomal microarray analysis,CMA)对染色体病检测是用于对错过绒毛、羊水产前诊断及孕中晚期影像学结构异常需进行产前诊断的一个较好的补救措施。在超声引导下,经腹脐静脉穿刺采集脐带血进行胎儿染色体核型及CMA分析,判断胎儿的染色体是否正常。若为患严重染色体病的胎儿,则及时终止妊娠,是减少出生缺陷的有效途径,达到优生优育的目的。脐带血染色体核型分析与羊水、绒毛产前诊断相比较,具有培养时间短、简便、染色体制备相对容易和出报告快等优点,尤其可以满足大孕周的孕妇进行产前诊断的需要。虽然染色体核型分析技术仍然是细胞遗传学染色体疾病诊断的“金标准”,但小于5 Mb以下微小片段的缺失及重复难于检出[1-3]。而CMA 技术能够检出100 kb 以上染色体微小缺失及微重复的片段,从而弥补G显带染色体核型分析的不足[4-5]。因此,目前国内多个医院在产前诊断技术检测的策略是染色体核型分析联合CMA技术应用[6-8]。本研究通过对202 例具有产前诊断指征且错过绒毛、羊水产前诊断的孕妇脐血标本进行常规法G 显带、改良同步化G显带染色体核型分析和CMA检测,探讨改良同步化染色体G 显带及CMA 在脐血产前诊断中的应用价值,现将结果报道如下。
1 资料与方法
1.1 一般资料选取2020年1月至2021年4月在我院优生遗传科就诊的具有产前诊断指征且错过绒毛、羊水产前诊断的孕妇202 例,在B 超的引导下,经腹脐静脉穿刺采集脐带血标本。孕妇的年龄为(16 ~ 42)岁,孕周(24+~ 36+)周。202 例产前诊断指征包括单纯超声异常162 例,超声异常合并高龄9 例,单纯高龄6 例,血清学筛查高风险3 例,无创产前基因检测高风险3 例,其他指征因素19 例。本研究已获得医院医学伦理委员会批准。所有研究对象均已签署知情同意书。
1.2 方法
1.2.1 改良同步化G 显带染色体核型分析(1)临床医生超声的引导下,经腹行胎儿脐静脉穿刺,抽取24 周以上孕妇脐带血2 mL,分别注入1 支无菌BD 肝素抗凝管及1 支EDTA 抗凝管(EDTA 抗凝管先用来做母源性污染后进行CMA 检测)。(2)脐带血于当天下午分别接种于AB两线外周血淋巴细胞培养基(A线为常规培养法;B线为同步化培养法),每线加入22滴血(1 mL注射器垂直加入),接种后轻轻水平摇动几次混匀,直立于2个独立的37 ℃恒温培养箱培养72 h。常规方法在收获前加入20 μL 20 μg/mL 秋水仙素溶液3 h 后收获,而同步化培养在细胞培养48 h后,向培养液中加入0.1 mL溶液A,中止DNA的合成,使细胞周期停止在S期,避光培养过夜;18 h后向培养液中加入0.1 mL溶液B,解除溶液A 对DNA 合成的抑制,恢复细胞周期。3 h 后大部分细胞都处于分裂中期,加入0.1 mL 100 μg/mL秋水仙素溶液,10 min 后收获细胞。最后按常规方法制备染色体G 显带。AB 两线外周血淋巴细胞培养基均使用广州拜迪生物医药有限公司生产试剂盒、溶液A、B 同步化试剂盒由上海乐辰生物科技有限公司生产(溶液A 为5⁃氟尿嘧啶、溶液B 为胸腺嘧啶脱氧核苷)。(3)将打码制好的片分AB 线各1~2 张用美国徕卡全自动扫描显微镜和图像分析系统自动扫码,在GSL⁃120 全自动工作站分析软件上分析,计数20 个细胞,如果发现性染色体异常应加倍计数,如怀疑嵌合体,则加数到100 个细胞,分析5 个核型并参照《人类细胞基因组学国际命名体系》(ISCN2016)对染色体核型进行评价。
1.2.2 母血鉴定方法胎血鉴定采用法国Sebia Capillarys 公司生产的全自动毛细血管电泳仪及其配套试剂进行血红蛋白电泳分析,鉴定脐血是否混合母血。测定胎儿血红蛋白(HbF)及成人血红蛋白HbA 和HbA2 的含量,若HbF 含量大于85%、HbA2 含量为0 则为无母血污染。
1.2.3 CMA 检测方法采用CGX 芯片(8x60k,PerkinElmer)对无母源性污染的脐血DNA 进行全基因组拷贝数变异(copy number variant,CNV)检测,杂交24 h 后采用SureScan 扫描,图像数据由安捷伦Cytogenomic 软件处理,将处理数据导入Geno⁃glyphix 在线软件进一步分析,选择>100 kb 或>3个以上连续可信探针的CNVs 区域,依据ACMG指南对数据的临床意义解读分为5 类:致病性、可能致病性、临床意义不明、可能良性以及良性变异;所参考的数据库包括ClinVar、DECIPHER、OMIM、GeneReview、Orphanet、正 常人群 数据 库DGV,并通过PubMed 等文献搜索对检出的CNVs进行分析。对临床意义不明或者可能致病性的CNVs,抽取父母外周血样本进行染色体芯片分析验证遗传或新发变异,以便于临床意义分类。
1.3 统计学方法采用SPSS 16.0 统计软件进行数据分析。计数资料采用例数和百分数表示,比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 改良同步化培养与常规法不同显带水平下染色体核型结果改良同步化G 显带带纹的分辨达到500 ~ 550 条带,常规法G 显带带纹的分辨仅达到320 ~ 400 条带,改良同步化染色体培养技术的染色体长度及分辨率明显提高。两种培养方法比较,常规法有2 例结构异常被漏诊。见表1。染色体核型分析见图1~2。
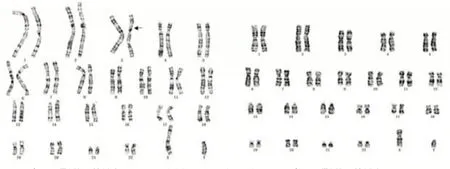
图1 病例1 染色体核型分析Fig.1 Chromosome karyotype analysis of case 1

表1 不同显带水平下染色体核型结果Tab.1 Karyotype results at different banding levels

图2 病例2 染色体核型分析Fig.2 Chromosome karyotype analysis of case 2
2.2 3 种技术方法对不同突变类型检出对比改良同步化G 显带与常规法G 显带染色体异常检出率比较,差异无统计学意义(χ2=0.26,P=0.610);改良同步化G 显带与CMA 染色体异常检出率比较,差异有统计学意义(χ2= 4.495,P= 0.034),见表2。

表2 3 种技术方法对不同突变类型检出对比Tab.2 Comparison of different mutation types detected by three technical methods 例
2.3 CMA 与改良同步化G 显带染色体检测结果比较CMA 技术共检出20 例染色体异常,其中除了数目异常外另检测到16 例CNVs(11 例致病性CNVs、5 例临床意义不明CNVs),染色体异常检出率为9.90%(20/202);改良同步化G 显带联合CMA检测到23 例染色体异常,异常检出率为11.39%(23/202);16 例CNVs 中,改良同步化G 显带技术仅检出2 例大于5 Mb 微缺失(图1- 2);此外,另有3 例染色体核型异常但CMA 检测为正常,见表3。
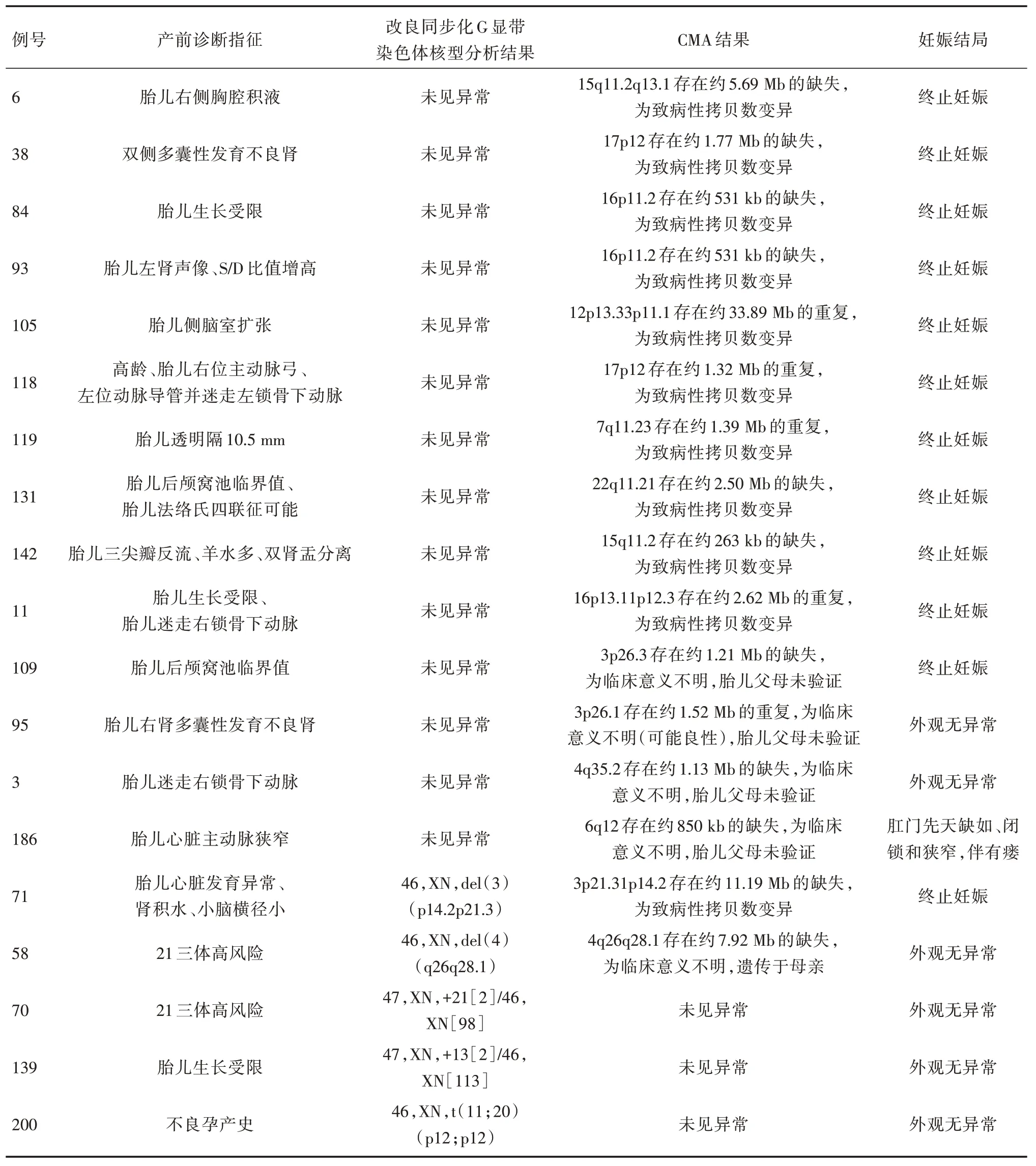
表3 两种技术检测结果比较Tab.3 Comparison of test results of two technologies
3 讨论
染色体核型分析是诊断染色体病的主要技术手段,染色体越长,条带越多,染色体异常检出率就会增高[9]。在本研究中,202 例胎儿脐血改良同步化G 显带染色体异常检出率为4.46%;常规培养法G 显带染色体异常检出率为3.47%,其中有2 例被漏诊,是由于改良同步化染色体培养技术明显提高了染色体带纹的分辨,达到500~550 条带。说明改良同步化G 显带技术比常规培养法更优,与王游声等[10]报道基本一致。根据文献[11-12]报道的脐血染色体核型异常检出率多在7.00%以上,均比本研究高,可能与本研究的病例选择及标本量少有关。
本研究中,CMA 技术共检出20 例染色体异常,异常检出率为9.90%(20/202),改良同步化G显带联合CMA 检测到23 例染色体异常,异常检出率为11.39%(23/202),其额外检出率为6.93%(14/202),与文献[13-15]报道基本一致。两种技术方法染色体异常检出率比较,差异有统计学意义(χ2=4.495,P=0.034)。由于染色体核型分析是通过细胞培养、制片及G 显带的基础上利用显微镜观察分析得出结论。显微镜观察的过程中存在分辨率不足的情况,另外细胞培养过程中可能引起染色体的改变;而CMA 是分子学方法,是利用脐血标本提取DNA 后进行CNV 检测,受影响的因素相对染色体核型分析少。因此,CMA 技术较染色体核型分析的异常检出率高,两者联合应用可提高染色体异常检出率[16-17]。本研究中,CMA 检出11例为致病性CNVs,由于胎儿临床证据不足及外显率等多方因素有5例为临床意义不明CNVs,且5例临床意义不明因CMA 检测费用贵均不同意验证,只做了父母染色体核型分析,结果改良同步化G显带检出1 例遗传于母亲,其余4 例均未见异常。根据新指南与共识[18]对于临床意义不明需继续寻找证据及与父母进行验证,协助判读胎儿样本检测结果的。但在很多情况下,基于目前对人类基因组的认识和数据库的积累程度,仍然无法对某些检测结果进行判读和解释。是否继续妊娠应由孕妇及其家属自主知情选择。尽管对于胎儿产前诊断中CMA 比染色体核型分析有额外的检出率,本研究仍有3 例染色体核型异常但CMA 检测结果正常,由于CMA 方法局限性不能检出染色体倒位、插入、平衡易位及低比例嵌合体[19-20]。平衡易位由相互易位和复杂易位形成的原发性易位,由于基本上无遗传物质的丢失,故对个体的发育一般无严重的影响。但在其形成配子时,理论上可产生1 种正常,1 种相互易位和16 种遗传物质不平衡配子。不平衡配子与正常配子结合受精后多发生流产、死胎或畸形儿[21]。表明染色体核型分析技术并不能完全被CMA 取代[22-23]。
本研究中,有1 例罕见病例染色体核型分析未见异常,而CMA 检出约33.89 Mb12p13.33p11.1 的重复(称为Pallister⁃Killian 综合征)。REESER 等[24]认为,i(12p)细胞对植物血凝素的刺激不应答,导致脐血或外周血淋巴细胞培养丢失。文献[25]认为诊断该病主要通过羊水细胞或皮肤活检的成纤维细胞进行染色体分析。因此,对于此种病例应结合CMA 检测,可有效提高PKS 的检出率。
综上所述,采用改良同步化G 显带染色体核型分辨率可提高至500~550 条带,有利于发现更多的染色体结构异常,联合CMA 技术在脐血产前染色体病诊断实现优势互补,提高染色体异常检出率和准确率,减少缺陷患儿出生。

