miR⁃30b在低氧环境中调控兔骨髓间充质干细胞成软骨分化
汪仡骁 吴恒鹏 万雪 陈方 石超 瓦庆德
1遵义医科大学第二附属医院骨科(贵州遵义563000);2遵义医科大学附属医院贵州省细胞工程重点实验室(贵州遵义563003);3遵义医科大学附属医院骨科(贵州遵义563003);4贵黔国际总医院骨科(贵阳550018)
关节软骨损伤后难以自行修复,其可导致患者关节功能进行性退变而影响患肢功能,严重者可影响生存质量,是临床亟待解决的一大难题。目前关节软骨缺损的治疗方法主要包括软骨细胞移植和自体骨软骨移植、微骨折手术等,虽有一定疗效,但尚存在植入细胞肥大化、供体部位继发病变及修复组织机械强度较低等相关并发症[1-5]。
近年来,随着表观遗传学及软骨组织工程的发展,为软骨缺损修复提供了一种新的策略[6]。细胞是构建软骨组织工程的关键成分,研究表明骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有良好的成软骨分化能力,是软骨组织工程中广泛应用的种子细胞[7-8]。BMSCs 成软骨分化受多种因素调控,其中表观遗传学中的微小RNA 对调控BMSCs 成软骨分化至关重要[9]。此外,关节内特有的低氧环境亦能通过调控缺氧诱导因子HIF⁃1α 及转录因子SOX 基因的表达促进BMSCs 成软骨分化[10]。笔者在前期测序结果中发现miR⁃30b 在软骨分化过程中表达具有明显差异,且能作用于其靶基因SOX9 参与调控C3H10T1/2分化,但其在低氧环境中是否能调控BMSCs 成软骨分化及其潜在机制尚未明确[11]。目前,miR⁃30b在低氧条件下对BMSCs 成软骨分化的调控鲜有研究涉及。因此,本实验拟通过探究miR⁃30b 在低氧环境中调控BMSCs 成软骨分化的作用及潜在机制,为微小RNA 调控BMSCs 成软骨分化修复软骨缺损提供参考。
1 材料与方法
1.1 实验动物及主要试剂实验动物:新西兰大白兔3 只,购自广东省医学动物实验中心,普通级,10 ~ 12 周龄,体质量1.8 ~ 2.2 kg,合格证号:SCXK(粤)2019⁃0035。主要试剂:DMEM 培养基、胎牛血清、0.25%胰酶(Gibco,美国),CCK⁃8 试剂盒、甲苯胺蓝染色液(上海碧云天生物技术有限公司),Percoll 淋巴细胞分离液(GE Healthcare,瑞士),NaCl、CoCl2(Sigma,德国),地塞米松、β⁃甘油磷酸钠(上海麦克林生化科技有限公司),TGF⁃β3(Peprotech,美国),ITS 细胞培养添加物(赛业生物科技有限公司,美国),茜素红染色液、维生素C(北京索莱宝科技有限公司),0.22 μm PVDF 膜(Millipore,美国),CollagenⅡ、SOX9(Proteintech,美国),α⁃tublin(Cell Signaling Technology,美国),CD29、CD34、CD44、CD45 抗体(Biolegend,美国)。
1.2 兔BMSCs分离与培养10%戊巴比妥(3 mL/kg)沿耳缘静脉麻醉新西兰大白兔,在无菌条件下用穿刺针穿刺骨髓腔,抽取骨髓液后转入含肝素钠溶液的15 mL离心管中保存。用含1%双抗的基础培养基稀释骨髓原液,1 000 rpm/min 离心5 min后去除上层少量脂肪细胞。将淋巴细胞分离液(1.073 g/mL)加入15 mL离心管下层,然后将骨髓液沿管壁缓慢加入上层。2 000 rpm/min 离心20 min后缓慢吸取中间层细胞沉淀并洗涤两次,用含10%胎牛血清和1%双抗的低糖DMEM 培养基重悬细胞沉淀,以3× 105个/mL 密度接种于75 cm2培养瓶中,置于5%CO2、37 ℃培养箱中培养。第3 天首次换液,以后每3 d 更换一次培养基,倒置显微镜观察细胞状态。
1.3 甲苯胺蓝染色及茜素红染色甲苯胺蓝染色:将第3 代兔BMSCs 以2 × 105个/孔接种至6 孔板中培养至90%汇合度,然后加入成软骨分化培养基(500 mL DMEM 培养基中添加10 % FBS、1% ITS、37.5 μg/mL 维生素C、1 ng/mL 地塞米松和10 ng/mL TGF⁃β3)进行诱导。每3 d更换一次诱导培养基,诱导3周后去除培养基。4%多聚甲醛固定10 min,用甲苯胺蓝染液进行染色。茜素红染色:6 孔板细胞培养同上,然后加入成骨培养基(500 mL 高糖DMEM 培养基中添加10%FBS、100 nmol/L 地塞米松、10 mmol/L β⁃甘油磷酸钠、50 μg/mL 维生素C 及1%双抗)进行诱导。每3 d 更换一次诱导培养基,诱导3 周后去除培养基,4 %多聚甲醛固定10 min后用茜素红染液进行染色。
1.4 流式分析细胞表面标记物用PBS 缓冲液调整第3 代兔BMSCs 密度至1 × 105个/mL,将100 μL细胞样品与1 μL FITC⁃PE 偶联的抗体(CD29、CD34、CD44、CD45)在4 ℃环境中避光孵育30 min,洗涤后用流式细胞仪进行检测。
1.5 稳定细胞株构建根据miR⁃30b 前体序列(UGUAAACAUCCUACACUCAGCUGUAAUACAU⁃GAAUUGGCUGGGAGGUGGAUGUUUACGUC)合成miR⁃30b 片段,将其克隆到带有GFP 荧光基团的质粒中构建高表达miR⁃30b 的慢病毒载体,然后转染293T 细胞,48 h 后收集细胞条件培养基,过滤后感染兔BMSCs。加入抗生素2 周后,获得稳定表达miR⁃30b 的细胞株,用荧光显微镜观察细胞荧光表达强度。
1.6 CCK⁃8检测细胞活力将细胞以1×103个/孔接种在96 孔板中,每组设置5 个复孔。培养24 h后弃去旧培养基,然后分别加入0、50、100、150、200 μmol/L 的CoCl2溶液。继续培养24 h 后加入10 μL CCK⁃8 试剂,在37 ℃环境中孵育4 h 后使用酶标仪检测450 nm 处的OD值。
1.7 免疫组化染色用0.25%胰蛋白酶消化兔BMSCs 离心后吸出旧培养基,随后用预热的成软骨分化诱导培养基重悬细胞沉淀并以5×105个/mL的浓度移入15 mL 离心管中,软骨分化诱导培养基配置方法同上。室温下1 000 rpm/min 离心5 min后拧松离心管盖,移入5% CO2、37 ℃培养箱中继续培养,每隔3 d 置换1 次软骨诱导培养基。培养21 d 后软骨微球用4%多聚甲醛固定24 h,然后包埋在石蜡中后连续切片并用CollagenⅡ单克隆抗体进行染色鉴定软骨分化效果。使用Image Pro Plus 图像分析软件测定Collagen Ⅱ阳性表达的累积光密度值。
1.8 Western blot检测将细胞或微球用预冷PBS溶液洗涤2 次,用含RIPA 和磷酸酶抑制剂的裂解缓冲液进行匀浆裂解30 min,BCA法进行定量,然后在4 ℃下以14 000 rpm/min 离心15 min 后收集上清蛋白质样品置于100 ℃水浴锅中变性10 min。在标准条件下于凝胶转移系统中进行电泳和电转,然后将聚偏二氟乙烯膜室温下放于5 %脱脂牛奶中封闭1 h。接着用TBST 洗涤3 次,将裁剪的膜放置于相应的一抗中4 ℃孵育过夜,随后洗涤3 次后放入二抗室温孵育,1 h 后再次洗涤3 次,在避光条件下对蛋白质条带进行曝光。
1.9 统计学方法使用SPSS 18.0进行统计分析,数据以均数±标准差表示。使用单因素方差分析和t检验进行统计分析。P<0.05 为差异有统计学意义,每组数据为至少3 个独立实验的平均值。
2 结果
2.1 细胞形态观察通过密度梯度离心法分离的原代细胞在培养72 h 首次换液,镜下细胞呈梭形分布、贴壁生长。继续培养至90%汇合度时,镜下细胞呈梭形生长、形态均一,符合间充质干细胞生长特征(图1)。
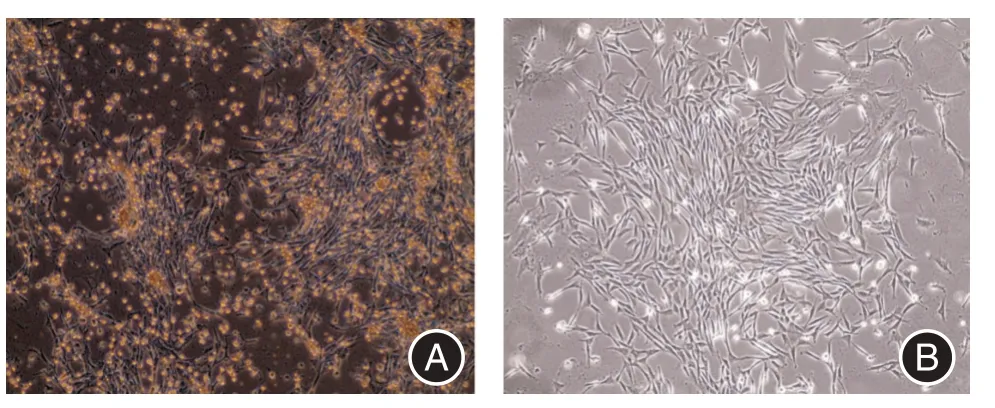
图1 显微镜观察原代细胞形态(×40)Fig.1 Primary cell morphology was observed by microscopy(×40)
2.2 兔BMSCs 表面标记物流式鉴定及诱导分化检测通过流式细胞术检测第3 代兔BMSCs 细胞的表面标记物,结果显示原代兔BMSCs 细胞高表达CD29、CD34(阳性率>95%),低表达CD44、CD45(阳性率<1%),见图2A⁃D。此外,细胞成软骨和成骨分化诱导21 d 后,甲苯胺蓝染色和茜素红染色结果表明兔BMSCs 具有良好的成软骨和成骨分化能力,见图2E⁃H。
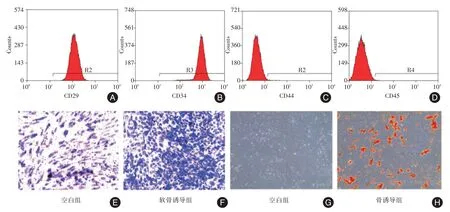
图2 流式分析兔BMSCs 表面标记物及双向诱导分化染色Fig.2 Flow cytometricanalysis of cell surface markers on isolated rabbit BMSCs and Histochemical staining ofrabbit BMSCs subjected to chondrogenic andosteogenic induction
2.3 低氧促进兔BMSCs增殖通过CCK⁃8检测不同浓度CoCl2溶液对细胞增殖能力的影响,结果显示兔BMSCs在CoCl2作用下增殖能力明显高于对照组,以150 μmol/L作用最强(P<0.01),200 μmol/L 促进作用降低(图3A)。Western blot结果表明CoCl2溶液能促进兔BMSCs 表达HIF⁃1α,在150 μmol/L 时作用最显著(图3B)。
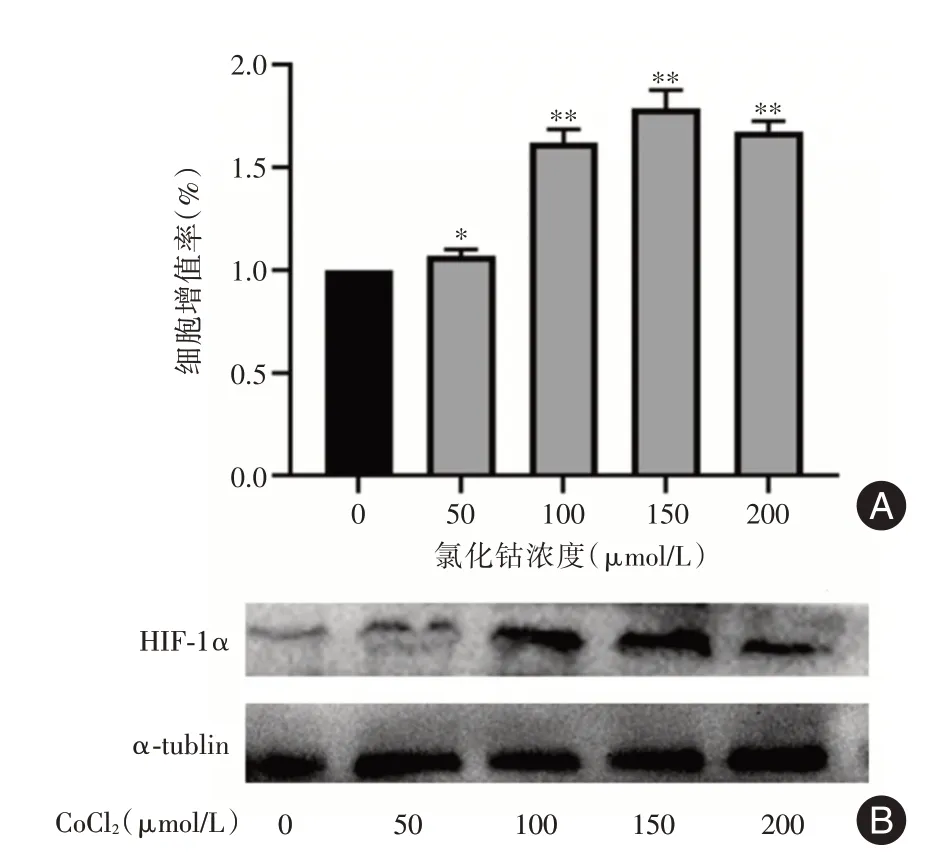
图3 低氧促进兔BMSCs 增殖和HIF⁃1α 表达Fig.3 Hypoxia promoted cells proliferation and HIF⁃1α expression inrabbit BMSCs
2.4 miR⁃30b 抑制Wnt/β⁃catnein 信号通路蛋白表达将兔BMSCs 分为3 组(对照组、空载组和miR⁃30b 转染组)进行转染和筛选,扩增培养后通过荧光显微镜观察细胞转染效率,结果显示空载组与miR⁃30b 转染组细胞荧光强度均高于对照组,转染效率大于90%(图4A⁃C)。细胞转染后,West⁃ern blot 结果显示miR⁃30b 能抑制其靶基因SOX9的表达,此外miR⁃30b 还能抑制Wnt/β⁃catnein 信号通路中Wnt 1 及β⁃catnein 蛋白的表达(图4D)。
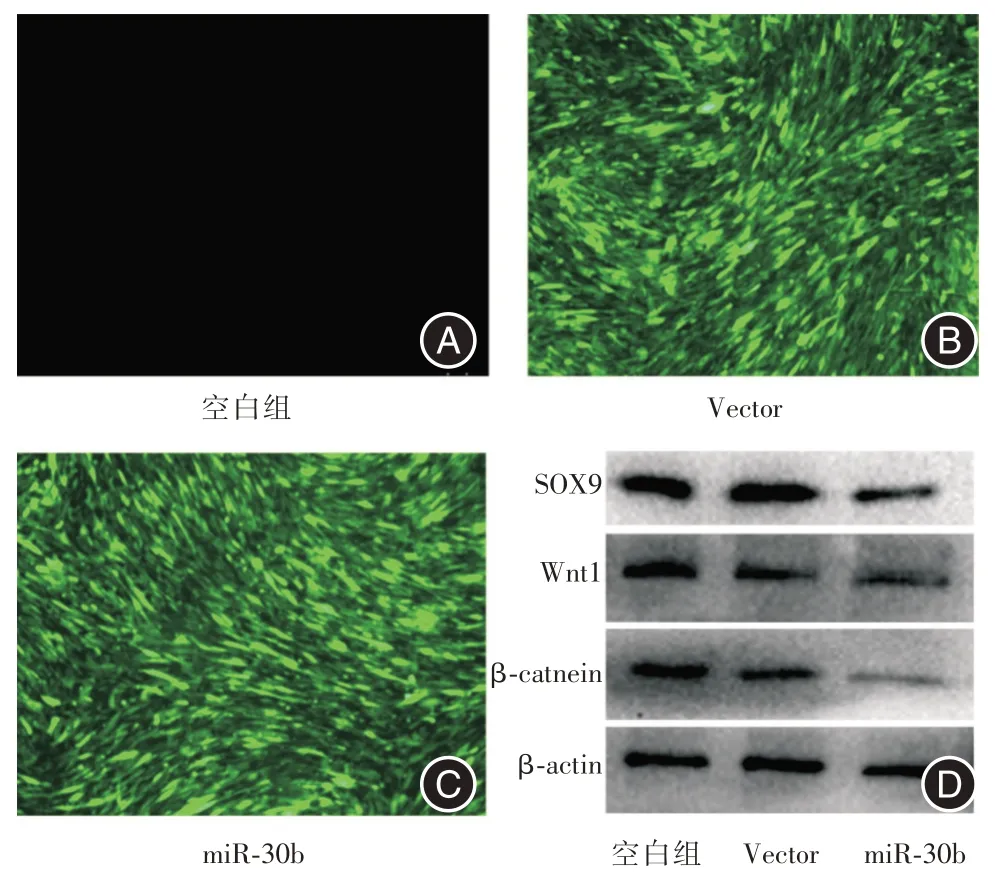
图4 miR⁃30b 抑制Wnt/β⁃catnein 信号通路表达Fig.4 MiR⁃30b inhibited the Wnt/β⁃catenin signaling pathway
2.5 miR⁃30b抑制兔BMSCs成软骨分化过表达miR⁃30b 的兔BMSCs 经成软骨诱导培养21 d 后,CollagenⅡ染色结果显示低氧可促进兔BMSCs 成软骨分化,而miR⁃30b转染组的CollagenⅡ染色阳性率较低氧组明显减少,且微球组织松散(图5A⁃B)。Western blot 结果显示miR⁃30b 转染组的CollagenⅡ、SOX9 表达水平明显低于对照组、诱导组和低氧组(图5C)。
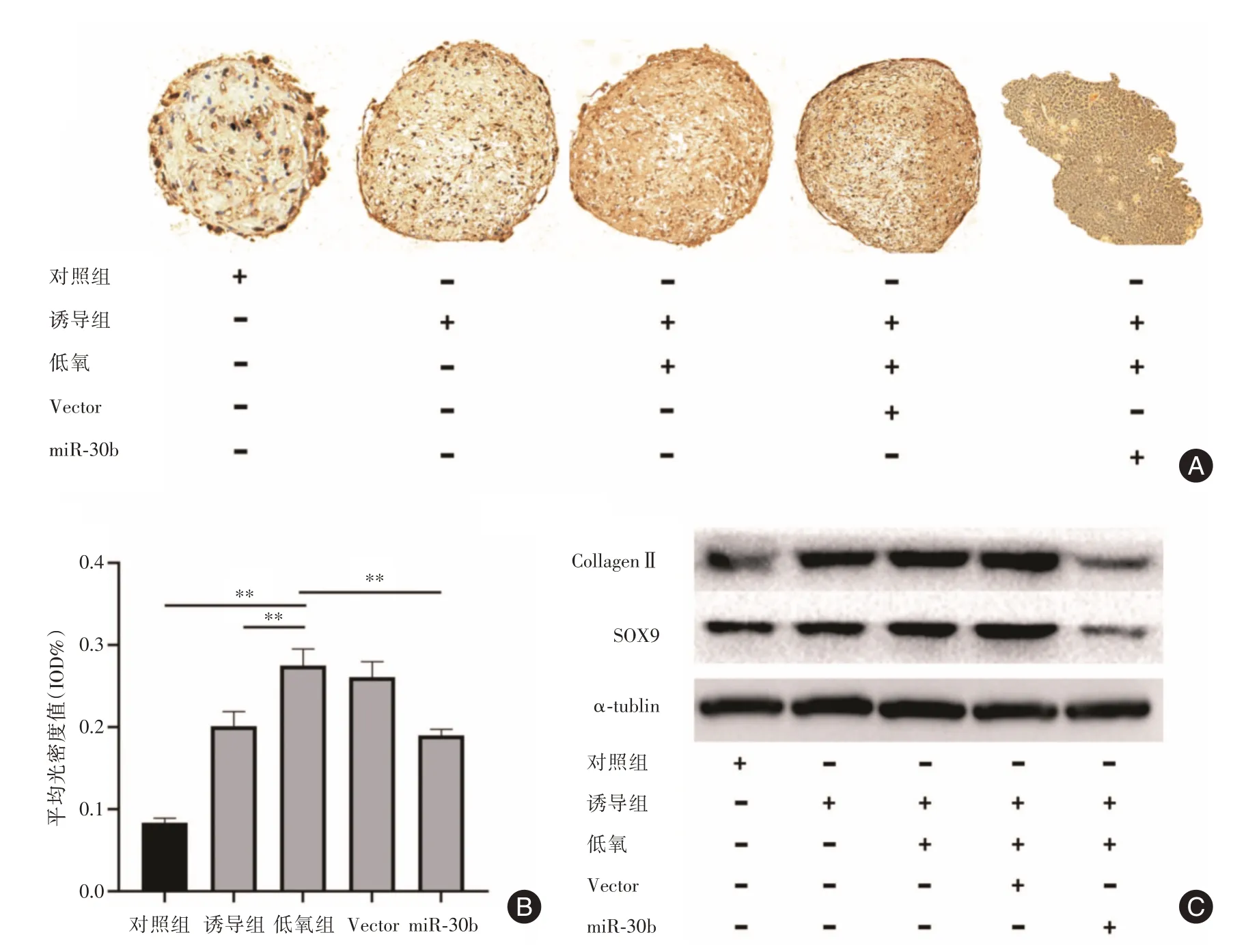
图5 miR⁃30b 抑制兔BMSCs 成软骨分化Fig.5 MiR⁃30b inhibitedchondrogenic differentiation of rabbit BMSCs
3 讨论
软骨缺损难以自我修复,表观遗传学调控的干细胞成软骨分化为缺损修复提供了新思路。此外,干细胞成软骨分化需要特殊的诱导环境,如何有效调控干细胞成软骨分化是多因素调控的复杂病理生理过程[12]。本研究就miR⁃30b 在低氧条件下如何有效调控干细胞成软骨分化的相关结果讨论如下。
BMSCs是一类具有多向分化潜能的干细胞[13-15]。BMSCs 常见的供体是家兔,本研究选兔作为种子细胞供体,目的是避免不同种属之间的免疫反应。本研究通过密度梯度离心法分离兔骨髓中的BMSCs,并通过形态学观察、流式细胞术和诱导分化实验对细胞进行鉴定。研究结果提示兔BMSCs分离成功且具有良好的干性和成软骨分化能力,能为后续实验提供标准的骨髓间充质干细胞。
关节软骨缺乏血液供应,氧气浓度从软骨表面到软骨下骨存在明显差异,最深层的氧气浓度约1%[16-17]。研究表明低氧是间充质干细胞成软骨分化的重要调节因素之一。KIM 等[18]发现低氧能增加趋化因子CXCR7 表达以维持人BMSCs 表型。LEE、HERRERA 等[19-20]研究表明低氧可增加HIF⁃1α、SOX9 等的表达,从而促进脂肪MSCs 增殖和软骨分化。低氧化学诱导剂CoCl2广泛用于模拟体外低氧环境。在本实验中,用不同浓度CoCl2溶液诱导低氧环境,CCK8 和Western blot 分析该低氧环境对细胞增殖和缺氧诱导因子HIF⁃1α 表达的影响。结果表明CoCl2溶液诱导的低氧环境能促进兔BMSCs 增殖和表达HIF⁃1α。上述结果提示CoCl2诱导的低氧环境能促进兔BMSCs 增殖。
BMSCs 成软骨分化受表观遗传学、信号通路和环境等因素共同调控,表观遗传学中的miRNAs是一类短链非编码RNAs,与BMSCs 成软骨分化密切相关,目前已发现多个miRNAs 参与调控BMSCs成软骨分化[21-22]。课题组前期测序结果提示miR⁃30b 在C3H10T1/2 细胞成软骨分化过程中表达具有明显差异,但其在低氧环境中能否调控兔BMSCs成软骨分化的作用及机制尚未明确[11]。因此,本实验制备了过表达miR⁃30b 的慢病毒载体转染兔BMSCs,并通过观察细胞荧光强度评估转染效果,结果显示过表达miR⁃30b 组与空载组荧光强度均明显高于对照组,转染效率大于90%。细胞转染后,Western blot 结果显示miR⁃30b 能抑制其靶基因SOX9 的表达,上述结果表明miR⁃30b 细胞株构建成功。此外,还分析了miR⁃30b 对Wnt/β⁃catnein 信号通路的影响,结果表明miR⁃30b 还能抑制该信号通路中Wnt 1 及β⁃catnein 蛋白的表达。因此,推测miR⁃30b 可能通过影响Wnt/β⁃catnein 信号通路参与调控兔BMSCs 成软骨分化。同一个靶基因也可能由多个miRNA 共同调控,miRNA 在行使功能时也会受到较广泛的调控,有待在将来的研究中,增加更多有效的检测指标,并深入探讨miRNA 的功能及具体调控机制。
为进一步探索miR⁃30b 在低氧环境中调控兔BMSCs 成软骨分化的作用,本研究重点检测成软骨分化的标志性基因SOX9 和CollagenⅡ。将该细胞制备成微球后,置于低氧环境中进行成软骨分化诱导。21 d 后行CollagenⅡ染色,结果显示,与对照组相比低氧明显促进兔BMSCs 成软骨分化;而过表达miR⁃30b 的细胞成软骨分化作用明显减弱,Collagen Ⅱ表达量较低氧组及空载组明显减少。此外,Western blot 结果表明过表达miR⁃30b 的细胞微球成软骨诱导21 d 后,SOX9、CollagenⅡ的表达较对照组、低氧组及空载组明显下调。另外,过表达miR⁃30b 的细胞在培养14 d 后,微球开始松动,培养至21 d 时微球出现松散,推测可能是miR⁃30b影响了细胞分化状态从而导致微球松散。上述结果提示miR⁃30b 参与调控兔BMSCs 成软骨分化。本实验中仅利用甲苯胺蓝染色、免疫组化来评估微球模型,在将来的研究中可以补充Alcian blue染色等多种评价标准。此外,本研究检测了SOX9和CollagenⅡ两种成软骨分化的标志性基因,未来可增加成软骨分化相关标志基因的检测以增加实验结果说服力。
综上所述,本研究成功分离和鉴定了兔BMSCs,并构建了过表达miR⁃30b 的细胞株,同时在体外观察到miR⁃30b 可抑制兔BMSCs 在低氧环境中成软骨分化,其机制可能与调控Wnt/β⁃catnein 信号通路有关。因此,miR⁃30b 可能是兔BMSCs 成软骨分化的关键调控基因之一,但还需进一步体内验证其成软骨分化调控作用。

