二氢杨梅素通过ERK和p38途径抑制人胃癌AGS细胞的增殖并诱导其凋亡
陆 岽, 王承党
胃癌是最常见的消化道恶性肿瘤之一,我国的发病人数约占全球的40%。近年来,胃癌的治疗效果有所提高,但进展期患者的生存率仍不理想,多数患者就诊时已是中晚期,导致干预滞后,预后不佳。因此,在胃癌发展前期,寻找有效的癌症靶点和抗癌物质,对于降低胃癌的发病率至关重要。据报道,食源性植物类化合物可诱导细胞凋亡进而干扰癌细胞生长[1]。最新的流行病学研究表明,富含天然植物类化合物的饮食可诱导癌细胞的凋亡[2],采用植物源天然产物作为抗肿瘤药物可能是一种有效的抗癌疗法。
多酚类物质是一类有效的抗癌化学物质[2-3],其对胃癌的抑制作用已得到验证,且未出现类似传统癌症治疗中发生的相关副作用[4]。二氢杨梅素也称蛇葡萄素,是从藤茶茎叶中提取出来的多酚类化合物的主要活性成分[5],具有消炎、抗氧化、抗菌、降血糖、降血脂和抗肿瘤等多种生理药理功效[6],在多种癌症中可通过上调抗凋亡蛋白/凋亡前体蛋白(Bcl-2/Bax)的相对含量、激活胱天蛋白酶(caspase)和内质网应激途径,从而诱导癌细胞凋亡[7],且对正常细胞影响较小[8]。而二氢杨梅素诱导人胃癌AGS细胞发生凋亡是否也是由类似通路介导,目前尚不清楚。本研究拟通过利用胃癌AGS细胞株,探讨二氢杨梅素对细胞活力的干预效果和作用机制,探究其对细胞凋亡的影响以及可能的相关信号转导通路。
1 材料与方法
1.1 试剂和仪器 二氢杨梅素(纯度95%,美国Sigma公司);抗体Bax、Bcl-2、caspase-3、caspase-9、细胞外调节激酶(extracellular regulated protein kinases,ERK)1/2、p-ERK1/2、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)1/2、p-JNK1/2、p38、p-p38和β-肌动蛋白(上海圣克鲁斯生物技术公司)。干电印迹系统及Chemi Doc XRS成像系统(Bio-Rad,美国伯乐公司);Annexin V-FITC细胞凋亡检测试剂盒及BD Accuri C6流式细胞仪(美国BD公司)。其他化学药品均购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养 AGS细胞株来自中国医学科学院北京协和医学院细胞中心。采用含10%胎牛血清(foetal bovine serum,FBS)及1%青霉素/链霉素的改良RPMI-1640培养基,于室温37 ℃、体积分数为0.05的CO2中培养细胞。
1.2.2 细胞活力测定 采用MTT法,在96孔板中以每孔5×104个细胞的密度确定细胞活力。参照文献[7]的方法,细胞经孵育过夜后,将培养基更换为含磷酸盐缓冲液(pH值为7.4)和二甲基亚砜(dimethyl sulfoxide,DMSO)或不同浓度二氢杨梅素的新鲜培养基,孵育24 h后,每孔添加25 μL MTT溶液(5 mg/mL,pH值为7.4),37 ℃下进一步孵育4 h。孵育结束后,吸出上清液,每孔再加入150 μL DMSO,置于回转振荡器上震荡30 min,并用分光光度计测定570 nm波长处的光密度(optical density, OD)。
1.2.3 流式细胞术磷脂结合蛋白V/PI染色检测各组细胞凋亡情况 采用Annexin V-FITC细胞凋亡检测试剂盒检测二氢杨梅素诱导的AGS细胞凋亡率。先将1×106mL-1的AGS细胞接种于含完全培养基的6孔板中,附着24 h。第2天,弃去培养基,加入含不同浓度(10~80 μmol/L)二氢杨梅素的新培养基,空白对照组仅添加0.1%的DMSO(0 μmol/L二氢杨梅素)。将细胞在37 ℃、体积分数为0.05的CO2中孵育72 h,用胰蛋白酶消化并以磷酸盐缓冲液洗涤,按照试剂盒说明书进行染色。采用流式细胞仪分析染色的细胞,并以配套软件处理数据。
1.2.4 蛋白质提取和蛋白质印迹分析 AGS细胞在细胞裂解液的作用下提取蛋白,用磷酸盐缓冲液洗涤细胞,用含1%苯基甲基磺酰氟和20 mmol/L氟化钠的缓冲液进行裂解。收集细胞裂解液,于4 ℃下15 000 r/min离心10 min。分离细胞质和线粒体,测定蛋白浓度。将样品与缓冲液混合煮沸10 min,进行聚丙烯酰胺凝胶电泳,使用半干电印迹系统转移到0.45 μm聚偏二氟乙烯膜上。室温下用5%脱脂奶粉在TBST缓冲液(20 mmol/L Tris,166 mmol/L NaCl和0.05%吐温-20,pH值为7.5)中封闭2 h后,用TBST缓冲液洗涤3次。4 ℃下加一抗抗体(1∶1 000)孵育过夜后,用TBST缓冲液洗涤3次,与辣根过氧化物结合的β-actin抗体(1∶2 000)在25 ℃下再孵育2 h,于在Chemi Doc XRS成像系统上检测蛋白条带。
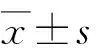
2 结 果
2.1 二氢杨梅素对AGS细胞增殖的影响 二氢杨梅素为20、40和80 μmol/L时,细胞增殖率分别为61.7%、58.9%和40.7%,可见AGS细胞的增殖率随二氢杨梅素浓度的升高而降低(图1)。
与空白对照组比较,☆:P<0.05。图1 二氢杨梅素对AGS细胞活性的影响Fig.1 Effects of dihydromyricetin on proliferation of AGS cells
2.2 诱导细胞凋亡 凋亡细胞的数量与二氢杨梅素的浓度呈剂量依赖方式递增,二氢杨梅素的浓度为80 μmol/L时,细胞的早期凋亡率为(8.22±1.22)%(右下象限),显著高于空白对照组(1.89±0.31)%;细胞的晚期凋亡率为(42.78±2.51)%(右上象限),显著高于空白对照组(4.92±0.77)%,具体见图2。
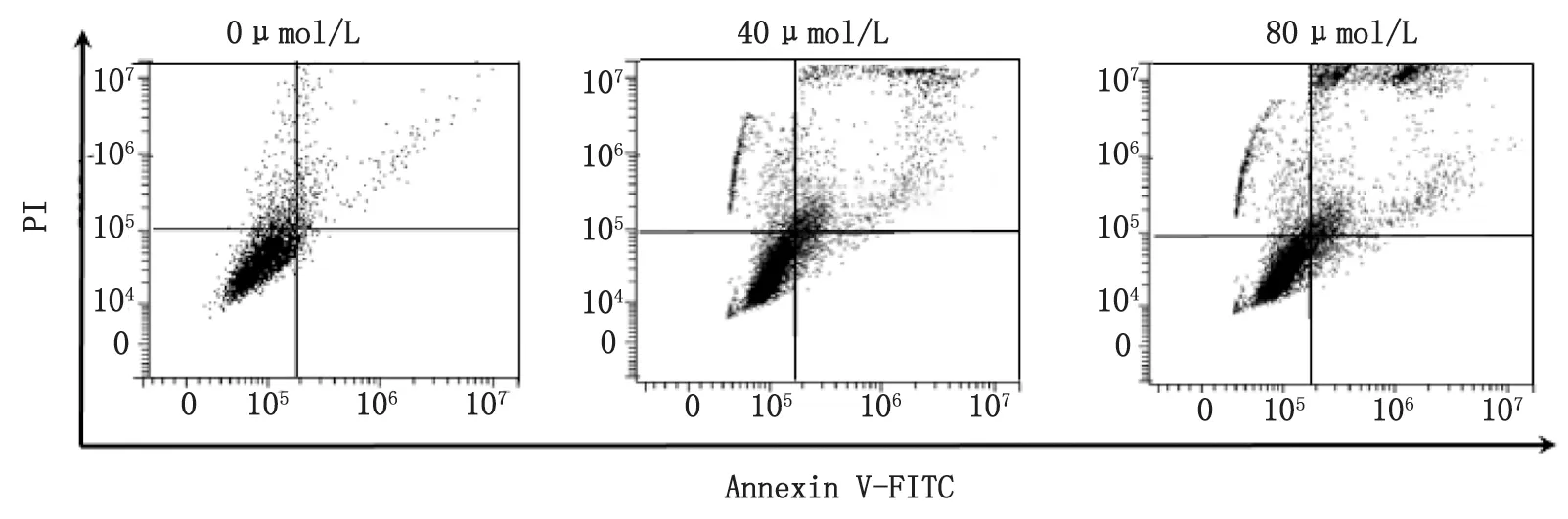
图2 二氢杨梅素对AGS细胞凋亡周期的影响Fig.2 Effects of dihydromyricetin on apoptosis cycle of AGS cells
2.3 二氢杨梅素对凋亡相关蛋白表达的影响 在二氢杨梅素处理的AGS细胞中,抗凋亡蛋白Bcl-2的表达明显降低,Bcl-2/Bax的表达显著降低(图3A)。与空白对照组比较,经40和80 μmol/L的二氢杨梅素处理后,AGS细胞Bcl-2/Bax比值分别降低了16.5%和67.5%(图3B)。
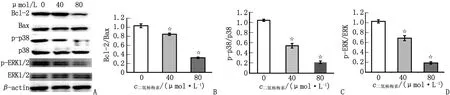
A:Western-blot实验各蛋白的表达;B:Bcl-2/Bax;C:p-p38/p38;D:p-ERK/ERK。与空白对照组比较,☆:P<0.05。图3 二氢杨梅素对Bcl-2、Bax、p38和ERK蛋白水平的影响Fig.3 Effects of dihydromyricetin on Bcl-2, Bax, p38 and ERK protein levels
2.4 二氢杨梅素通过p38丝裂原活化蛋白激酶途径影响细胞增殖和凋亡 将AGS细胞暴露于80 μmol/L二氢杨梅素中,与空白对照组比较,p-p38/p38蛋白的水平降低了78.6%(图3C),p-ERK/ERK蛋白的水平降低了81.5%(图3D)。
2.5 诱导caspase介导的凋亡 在受试浓度的处理下,活化的caspase-3和caspase-9蛋白的表达均上调(图4A)。在80 μmol/L的二氢杨梅素处理下,与空白对照组比较,cleaved caspase-3/caspase-3的表达从0.11提升到2.35,而cleaved caspase-9/caspase-9的表达从0.20提升到3.01(图4B)。
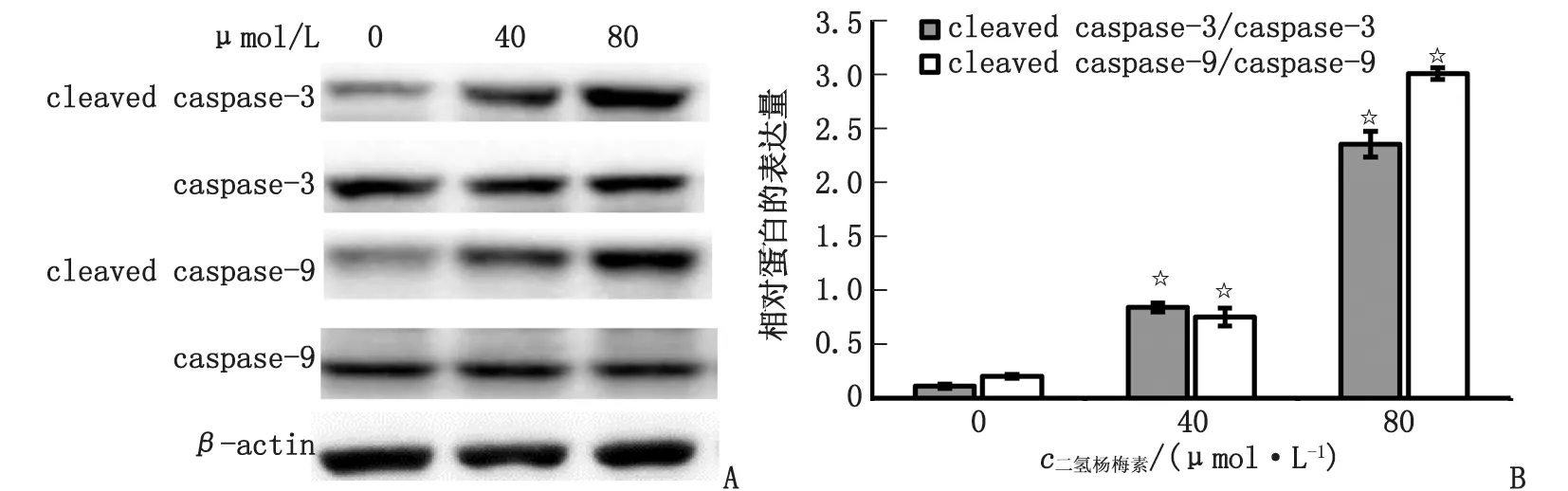
A:Western-blot实验各蛋白的表达;B:不同浓度二氢杨梅素处理AGS细胞后cleaved caspase-3/caspase-3和cleaved caspase-9/caspase-9的蛋白表达。与空白对照组比较,☆:P<0.05。图4 二氢杨梅素对活化的caspase-3和caspase-9表达水平的影响Fig.4 Effects of dihydromyricetin on cleaved caspase-3 and caspase-9 protein expressions
3 讨 论
细胞凋亡是一种由基因介导的可自我调控的细胞死亡形式,与癌细胞的生长密切相关,也是治疗癌症的有效靶点之一[9-10]。细胞凋亡可通过内在或外在途径触发,导致癌细胞DNA片段化,抗癌药物可通过激活外在或内在凋亡途径杀伤癌细胞,大量的抗凋亡和促凋亡效应因子可对细胞凋亡起调节作用[11]。
胃癌的治疗临床上常采用多种方式进行联合干预处理,如手术联合放疗或化疗等。因化疗具有较大的副作用,寻找高效低毒的化疗药物对胃癌的治疗具有重要的意义。食源性多酚、黄酮类化合物因可通过诱导细胞凋亡发挥抗肿瘤作用,已成为癌症治疗研究的新热点。Liu等[12]的研究报道,食源性多酚类化合物的珍珠梅黄酮可能通过ERK途径诱导肝癌移植瘤细胞凋亡;Yang等[13]也报道,芹菜素能诱导肝癌细胞的自噬及凋亡。研究表明,二氢杨梅素可通过抑制相关癌基因和通路诱导癌细胞凋亡,如上调抑癌基因p53、激活信号传导及转录激活蛋白3信号、下调蛋白激酶B(Akt)/Bad通路、抑制哺乳动物雷帕霉素靶蛋白表达、调节核转录因子通路等[14-15]。亦有报道二氢杨梅素可通过p53通路诱导卵巢癌细胞凋亡和逆转多药耐药[14]。可见二氢杨梅素的作用靶点多样化,作用机制复杂,对胃癌细胞的增殖抑制作用是否也由凋亡途径介导,目前尚不清楚。
本实验在研究二氢杨梅素抑制胃癌细胞增殖作用的基础上,探讨其对细胞凋亡周期的影响和作用机制。研究结果显示,在二氢杨梅素的处理浓度为10~80 μmol/L时,AGS细胞的增殖抑制效果及其凋亡数量与二氢杨梅素的浓度呈剂量依赖关系。同时,二氢杨梅素诱导的AGS细胞凋亡不仅与p38蛋白表达的改变有关,还伴随Bax的过表达(细胞死亡的启动子)。在细胞凋亡早期,Bax插入线粒体膜中并增加膜通透性,引导细胞色素C的释放、多种caspase的激活以及下游死亡效应蛋白的裂解,进而诱发细胞凋亡程序的开启。另外,经二氢杨梅素处理后的AGS细胞,在蛋白质水平观察到Bax表达升高的同时伴随Bcl-2表达的降低,这与早期报道[16]的抗癌类胡萝卜素(多酚类化合物)的数据相似。近年来,通过诱导凋亡靶向清除AGS细胞已成为干预和预防胃癌的重要手段[7,9,12]。本研究还显示,二氢杨梅素上调了活化的caspase-9和caspase-3蛋白表达,且差异性激活某些丝裂原活化蛋白激酶,包括p38、JNK和ERK的表达。众所周知,ERK通路主要参与细胞增殖和分化,JNK和p38通路主要参与细胞应激反应和凋亡[10]。如Xu等[14]的研究显示,75 μmol/L的二氢杨梅素对非小细胞肺癌的细胞增殖抑制效果显著,机制是通过调控活性氧介导ERK/JNK的表达诱导癌细胞的凋亡,且二氢杨梅素对正常肺成纤维细胞无毒副作用。本研究结果表明,二氢杨梅素浓度为80 μmol/L时,可通过ERK和p38途径抑制AGS细胞的增殖,其机制是通过上调活化的caspase-9和caspase-3蛋白表达,进而诱导AGS细胞凋亡。
综上所述,二氢杨梅素作为一种结构简单的小分子多酚类化合物,临床和动物实验均显示其毒性低,且无交叉耐药性[17]。二氢杨梅素抗癌作用多向,尤其在拮抗肿瘤细胞的耐药性方面,起效浓度较低且抗耐药作用显著。另外,二氢杨梅素联用抗肿瘤药物具有良好的抗癌活性,具有一定的临床应用价值。但作为小分子抗癌药物,目前对二氢杨梅素的研究大多集中于体外药效基础,对体内药效和药物作用机制的研究较少,需进一步深入探讨,以推动二氢杨梅素由基础研究向临床用药转化。

