壳聚糖/马铃薯蛋白/山茶籽油微胶囊的研制
张天奇,陈彦廷,崔延如,汪陈洁,2
(1. 山东理工大学 农业工程与食品科学学院, 山东 淄博 255049;2.山东省高校农产品功能化技术重点实验室, 山东 淄博 255049)
马铃薯(SolanumtuberosumL.)是世界四大粮食作物之一。中国是世界上最大的马铃薯生产国,随着产业结构的调整,马铃薯已逐渐成为我国部分地区的优势作物,是经济发展、农民增收的重要途径之一[1]。马铃薯蛋白(potato protein, PP)是马铃薯淀粉加工时的副产物,往往随废水丢弃,然而马铃薯蛋白具有合理的氨基酸组成结构,营养价值高,具有很大的开发潜力[2]。
山茶籽油(camellia oil, CO)又名茶油、山茶油,是从山茶科山茶属的普通油茶成熟种子中提取的纯天然高级食用植物油,色泽金黄、清香怡人。山茶籽油与橄榄油、椰子油、棕榈油并称为世界四大木本植物油,是国际粮农组织重点推广的健康食用油之一。山茶籽油富含不饱和脂肪酸(UFAs),是高油酸含量的植物油,因其脂肪酸组成、理化性质与橄榄油相似,被誉为“东方橄榄油”。山茶籽油有营养保健作用以及药用价值[3],但其却具有较高的化学不稳定性,容易变质,主要是在加工、储存和运输过程中发生氧化或在氧、温度、光、湿度的作用下发生化学反应所致。此外,山茶籽油水溶性差,气味特殊,极大地限制了其在食品中的应用[4]。因此,合理保护山茶籽油对保证其营养价值和食用安全具有重要意义。
微胶囊化(microencapsulation)能有效防止不饱和脂肪酸的氧化变质,减少或掩盖令人不快的风味,同时能改善油的口感,方便运输和保存,克服传统油的应用局限性[5]。在微胶囊化过程中,油被包裹在合适的基质中,这对微胶囊的微胶囊化效率和收率以及其他理化特性起着关键作用[6]。壳聚糖(chitosan)和蛋白质是常用的微胶囊壁材,因为蛋白质-多糖复合物在特定的物理化学条件下(如pH和离子强度)可导致液-液分离(凝聚)或沉淀样产物,通过发生复合凝聚反应形成稳定的微胶囊壁材[7]。
本研究运用马铃薯蛋白作为包裹疏水性天然山茶籽油的载体,利用马铃薯蛋白与壳聚糖进行复合凝聚反应制备壳聚糖/马铃薯蛋白/山茶籽油微胶囊,通过性质测定,获得制备微胶囊的最佳条件,并对其结构特性进行考察,以期为马铃薯蛋白及包含山茶籽油在内的功能性油的高值化利用提供理论依据。
1 材料与方法
1.1 主要材料与试剂
马铃薯采购于山东淄博奥朗特超市,所挑选的个体圆润、成熟度一致,质量良好,且不存在虫害等损伤。试验所需山茶籽油来自深圳恒生生物科技有限公司,无水乙醇(分析纯)来自天津市致远化学试剂有限公司,壳聚糖(脱乙酰度80%~95%)、氢氧化钠、亚硫酸钠、盐酸、冰醋酸等均为分析纯,购于国药集团公司。
1.2 主要仪器
电冰箱(BCD-206TS):青岛海尔股份有限公司;紫外分光光度计:尤尼柯(上海)仪器有限公司;冷冻干燥机(FD-1):北京博医康实验仪器有限公司;低速大容量离心机(DL-5-B):上海安亭科学仪器厂;高速分散均质机(AD500S-H):上海君曦科学仪器有限公司。
1.3 试验方法
1.3.1 马铃薯蛋白的提取
马铃薯蛋白(PP)的提取采用等电点沉淀法,具体步骤参考相关文献[8-9]。
1.3.2 微胶囊的制备
壳聚糖/马铃薯蛋白/山茶籽油(CS/PP/CO)微胶囊的制备工艺流程如图1所示。
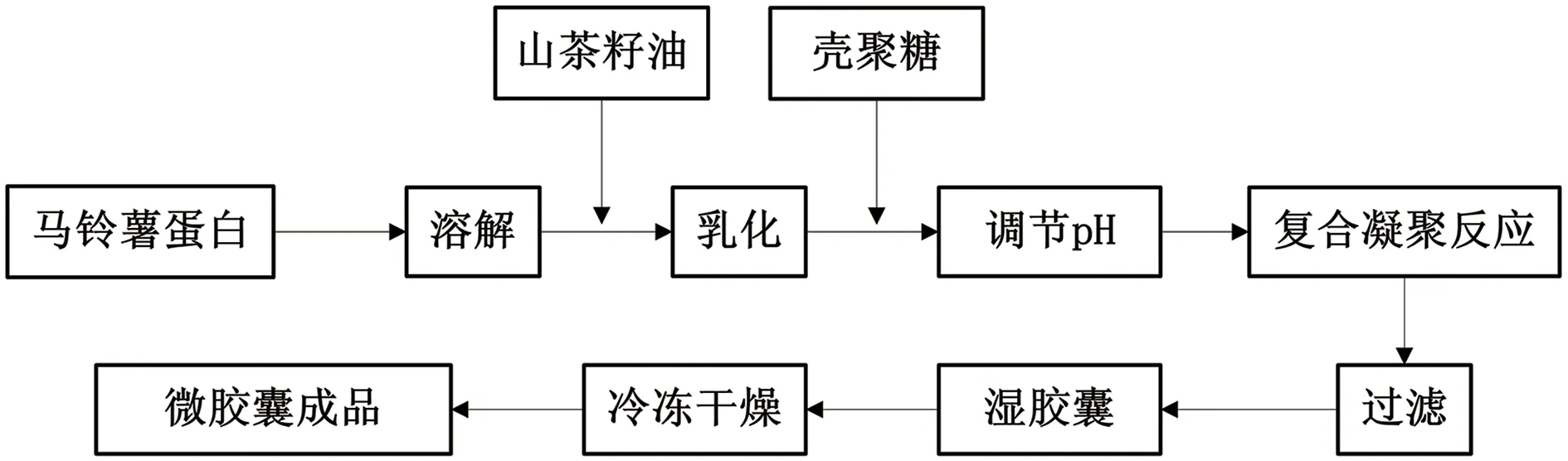
图1 山茶籽油微胶囊制备流程图
取一定量的马铃薯蛋白,充分溶解,加入山茶籽油,利用高速均质机进行分散乳化,得到均一的水包油型(O/W)山茶籽油/马铃薯蛋白乳状液。
利用2%的冰醋酸使壳聚糖充分溶解,配制成1.2%的壳聚糖溶液。向上述O/W乳液中加入不同体积的壳聚糖溶液,使马铃薯蛋白与壳聚糖的质量比分别为 1∶1、2∶1、4∶1、6∶1和8∶1。混合均匀后,用NaOH 溶液调节反应体系的pH值,接着置于不同温度的恒温震荡器中反应3 h,过滤后得到湿的壳聚糖/马铃薯蛋白/山茶籽油微胶囊。将湿胶囊置于-25 ℃条件下冻结24 h后,通过真空冷冻干燥机进行干燥获得成品壳聚糖/马铃薯蛋白/山茶籽油微胶囊。
1.3.3 显微镜观察
采用德国Leica DM750光学显微镜观察乳液的微观形貌。在载玻片上滴一滴乳液,然后盖上盖玻片,确保没有气泡,进行显微镜观察,放大400倍拍照,作进一步分析。
1.3.4 浊度分析
采用分光光度计(600 nm)测定马铃薯蛋白/壳聚糖反应体系在不同pH值条件下的浊度值。
1.3.5 膨胀比测定
将精确量的0.1 g冻干微胶囊(md)在小纱布袋中密封,然后浸入20 mL蒸馏水中,在37 ℃条件下孵育不同时间(1、2、3、4、5、6 h)。随着每个时间点的孵育完成,取出袋子并取出内容物,用滤纸吸干,并称重(ms)。根据方程(1)计算溶胀比,即
溶胀比=(ms-md)/md× 100%。
(1)
1.3.6 傅立叶红外光谱分析(FTIR)
采用Thermo Nicolet 5700红外光谱仪在400~4 000 cm-1频率范围内对制备好的微胶囊进行红外光谱分析。光谱采集分辨率为4 cm-1,每个样品扫描64次。以分析级KBr为背景调整基线。
1.3.7 数据处理与分析
利用SPSS 19进行数据统计分析(P<0.05),使用Origin 9.0作图。
2 结果与分析
2.1 不同乳化条件下乳液显微镜观察结果
图2为不同乳化转速(a: 6 000 r/min; b: 8 000 r/min; c:10 000 r/min)与不同山茶籽油/马铃薯蛋白(CO/PP)比例(d:1/1; e:1/2; f:1/3)条件下乳液的光学显微镜图片。由图2可知,随着转速的增加,乳液滴的数量以及形态都发生了明显的变化;视野中清晰可见乳液数量先增多后减少,在8 000 r/min条件下维持20 min时乳液形态和数量都最佳(图2(b))。这可能是由于较低转速不足以形成充分的乳液,而转速过高又会导致许多已成型的乳液被打散[6]。
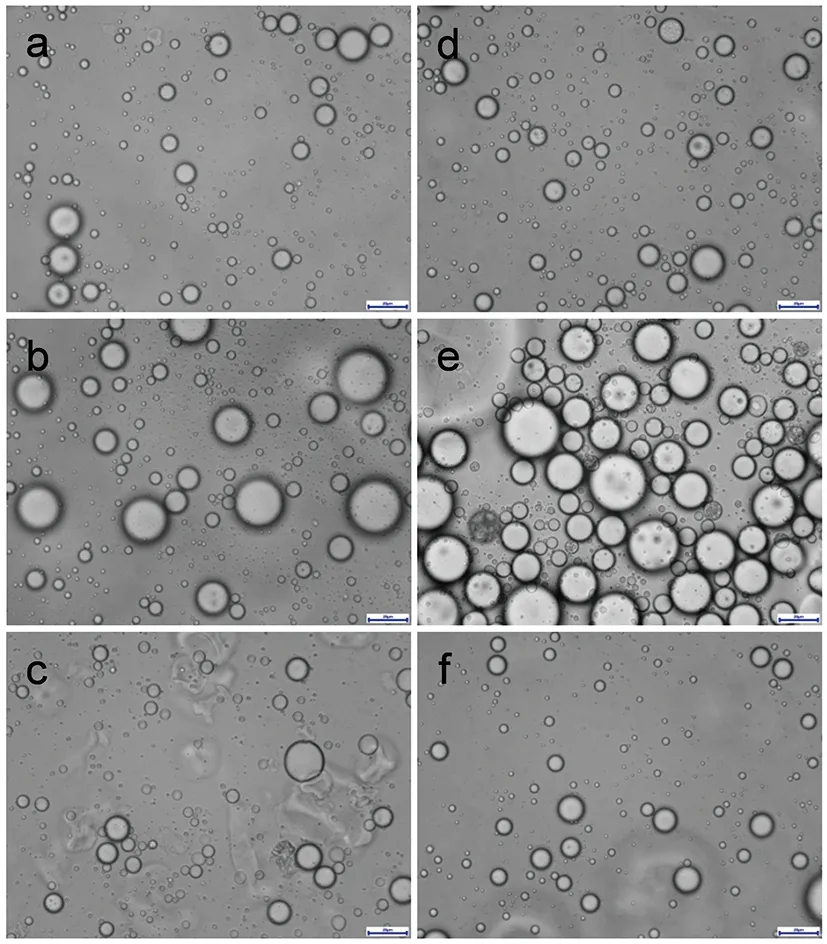
图2 不同乳化转速和不同山茶籽油/马铃薯蛋白比例乳液形态观察
不同CO/PP比例亦显示出相同的趋势,比例为1∶1(图2(d))和1∶3(图2(f))均不能形成充分、稳定、有效的乳液,当CO/PP比例为1∶2时,形成的乳液中的油滴能够有效地被包裹起来,其形状和尺寸分布趋于均匀(图2(e))。微胶囊的大小、形状和分散性是影响包封山茶籽油氧化性和贮存稳定性的重要因素[5],因此形成有效的乳剂以获得高质量的微胶囊至关重要。
由不同乳化条件下乳液显微镜观察结果可知,当CO/PP为1∶2,在8 000 r/min条件下维持20 min进行乳化时,形成的山茶籽油/马铃薯蛋白乳液对山茶籽油的包裹效果最好。
2.2 不同壳聚糖/马铃薯蛋白比例对复合凝聚效果的影响
马铃薯蛋白与壳聚糖发生复凝聚反应的效果可以直观地反映在浊度上,不同PP/CS比例对复合凝聚体系的影响如图3所示。当pH值低于4时,壳聚糖与质子化马铃薯蛋白之间的正电荷相互排斥,抑制了复合反应,使浊度极低[10]。马铃薯蛋白的等电点在pH 4.2左右,随着pH值从4增加到8,带负电荷的马铃薯蛋白与带正电荷的壳聚糖之间产生了充分的复合反应[6];因此,随着pH值的增加,浊度逐渐增大,直至电荷平衡。当pH值超过8时浊度下降,这可能是由于马铃薯蛋白质变性和复合体系表面电子层的变化,使团聚体分散,不能形成良好的复合体系。当PP/CS比为2∶1时,浊度在整个pH范围内始终最高,且在pH为8时出现峰值浊度,这归因于马铃薯蛋白与壳聚糖通过静电相互作用进行的复合反应最完全[6]。最佳复合反应的蛋白质与多糖复合物比例通常随蛋白质和多糖种类的不同而变化。在本研究中,当PP/CS比为2∶1时,获得了最佳的复合凝聚体系。
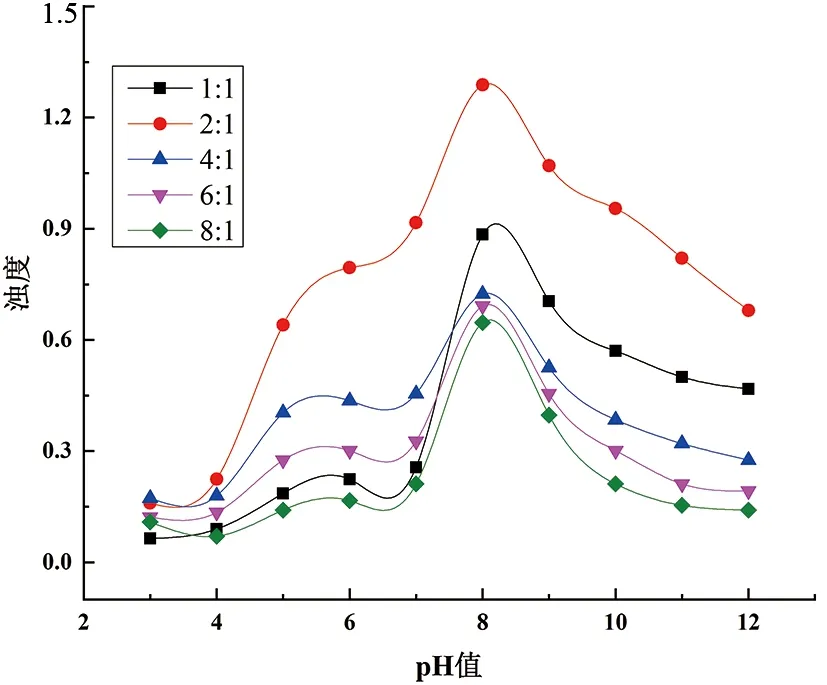
图3 CS/PP比例对复凝聚效果影响
2.3 温度对微胶囊膨胀能力的影响
由于静电反应的发生,导致基于复合凝聚反应制备的微胶囊易受环境条件变化的影响。不同温度条件下制备的壳聚糖/马铃薯蛋白/山茶籽油微胶囊的溶胀能力见图4。如图4所示,5组不同温度条件下(5、25、45、65、85 ℃)制备的微胶囊在孵育的第一个小时内迅速吸收水,并且溶胀比急剧增加。随着孵育时间的延长,各组样品的溶胀比略有变化,但1 h后溶胀比的总体趋势变化不大。在45 ℃下制备的微胶囊具有最高的溶胀比,随着孵育进行到2 h或更长,该值略微降低,表明发生山茶籽油泄漏或部分壁崩解。而其它组(5、25、65、85 ℃)微胶囊的溶胀比始终维持在较低的水平,说明发生泄漏或壁材崩解的情况更为严重。结果表明,45 ℃条件下制备的壳聚糖/马铃薯蛋白/山茶籽油微胶囊的稳定性最好,这可能与马铃薯和壳聚糖之间的美拉德反应形成更紧凑和更厚的壁、增强了微胶囊的稳定性有关[11]。
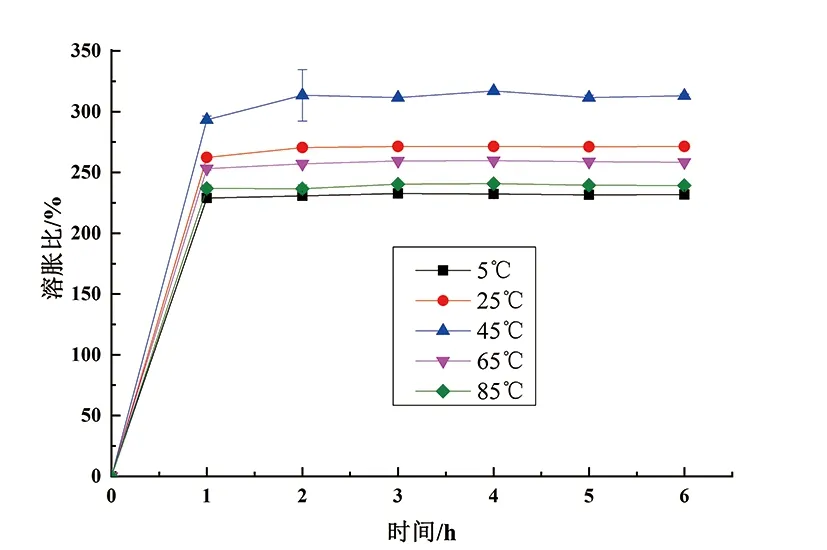
图4 不同温度下制备的山茶籽油微胶囊的溶胀比
2.4 傅里叶红外光谱分析
通过FTIR分析进一步研究温度对PP/CS复合体系的影响,主要是3种生物聚合物的结构变化和相互作用(图5)。在CS光谱中,可以看出壳聚糖的主要特征峰为1 078 cm-1(C-O伸缩振动)和1 156 cm-1(C-O-C非对称伸缩振动和糖苷键),PP/CS不同温度条件下的样品中都可以观察到这些特征峰的存在。其它具有显著吸收峰的地方包括:在2 874 cm-1处的C-H伸缩振动, 1 654 cm-1处的C=O伸缩振动以及1 421 cm-1处的-CH2OH中的C-O-H伸缩振动。同时,1 599 cm-1和1 379 cm-1的波段是由于-NH2的弯曲振动和C-N的伸缩振动造成的,而3 400 cm-1的宽频带归因于O-H和N-H的伸缩振动吸收[9]。在1 654(酰胺I带)、1 540 、1 402(酰胺II带)、1 261 cm-1(酰胺III带)处出现了特征吸收带[6]。不同温度条件下制备的壳聚糖/马铃薯蛋白/山茶籽油微胶囊样品的红外光谱图类似,均出现壳聚糖与马铃薯蛋白的特征峰,但在3 400 cm-1范围内的氢键振动增强,蛋白质二级结构区域有轻微的红移或蓝移(45 ℃样品尤为明显),说明氢键在微胶囊形成过程中起到重要作用,同时蛋白质的二级结构也产生了一定影响。此外,不同温度组样品中均能找到山茶籽油的特征吸收峰,例如:3 005 (=C-H)、2 925 、2 854(-CH2)、1 746 cm-1处的酯羰基[12]。说明山茶籽油与壁材之间只是发生了简单的物理结合,主要是疏水相互作用,而不是化学反应。
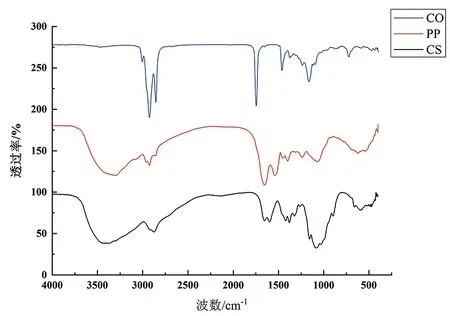
(a)CS、PP、CO
总之,FTIR光谱表明,本试验所制备的壳聚糖/马铃薯蛋白/山茶籽油微胶囊主要通过壁材(壳聚糖和马铃薯蛋白)之间的氢键作用,以及芯材与壁材之间的疏水相互作用形成,起到有效保护山茶籽油的作用。
3 结论
1)通过显微镜观察,得出马铃薯蛋白/山茶籽油乳液的最佳制备条件为:匀浆转速为 8 000 r/min,时间为20 min,山茶籽油/马铃薯蛋白比例为1∶2。
2)通过浊度和膨胀力分析,得出制备壳聚糖/马铃薯蛋白/山茶籽油微胶囊在复凝聚阶段的条件为:壳聚糖/马铃薯蛋白为2∶1,复凝聚温度为45 ℃。
3)红外光谱分析结果表明,壳聚糖/马铃薯蛋白/山茶籽油微胶囊主要通过壳聚糖和马铃薯蛋白之间的氢键作用以及山茶籽油与壁材之间的物理相互作用形成,是一种保护山茶籽油的有效方法,该方法在封装富含UFAs和多种有益成分的功能性油方面具有广阔的应用前景。

