血管性血友病致反复失血性休克1例并文献复习
温贤浩,唐雪,刘海燕,宪莹,于洁 (重庆医科大学附属儿童医院,儿童发育疾病研究教育部重点实验室,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆 400014)
血管性血友病(von Willebrand disease,VWD)是常见的遗传性出血性疾病,临床表现多样化,其诊断及治疗仍面临挑战。本文报道VWD致反复失血性休克 1例,并进行相关文献复习,为加强其血管性血友病的认识,及时诊断及治疗提供参考。
1 病例资料
患儿,男,5岁2个月,2岁左右开始发病,主要表现为反复鼻出血,不易止血,反复皮肤瘀斑。病初因“反复鼻出血”到我院门诊就诊,凝血因子检查正常,血小板聚集功能异常,诊断为血小板功能异常。后因鼻出血、失血性休克3次入我院治疗。无大小便出血、无咯血。生产史无特殊,生长发育同正常儿童。患儿姑母有血小板减少病史,偶有鼻出血。否认血友病家族史。最近一次入院时查体:体温36.3 ℃,呼吸28次/分,心率166次/分,血压76/39 mm Hg,血氧饱和度95%(面罩吸氧下),体质量16 kg。发育正常,营养中等,面色苍白,重度贫血貌,嗜睡状。皮肤无黄疸、皮疹、瘀斑瘀点。皮肤弹性差,浅表淋巴结无肿大。咽后壁可见血凝块及少许活动性出血。肝脾无肿大,毛细血管充盈时间延长,约4 s。四肢端凉,甲床无发绀,四肢肌力及肌张力正常。血常规:白细胞12×109/L,红细胞1.39×1012/L,血红蛋白40 g/L,血小板248×109/L,中性粒细胞0.74,淋巴细胞0.2。血凝五项:凝血酶原时间(PT)20.2 s(9~14 s),活化部分凝血活酶时间(APTT)40.3 s(20.6~39.6 s),血浆纤维蛋白(Fib)0.72 (1.07~3.37) g/L,凝血酶时间(TT)21.5 s(15~22.2 s),D-二聚体 0.1(<0.86)。血型 O型,RH(D)阳性。肝肾功能:总蛋白(TP)29.9 g/L,白蛋白(ALB)16.2 g/L,球蛋白13.7 g/L,丙氨酸氨基转移酶(ALT)正常,尿素氮15.36(2.42~6.72)μmol/L,尿酸477.4(140~390)mmol/L,肌酐正常。凝血因子Ⅷ 43.1%(对照100.5%)。血小板聚集功能异常,PAG(M)36.3%(35%~70%),PAG(1)34.1%,I% 57.8%,T(M)73 s。诊断血小板功能异常、鼻出血、重度失血性贫血、失血性休克。给予多次输入血小板及新鲜冰冻血浆、红细胞悬液、冷沉淀治疗,出血停止,患儿好转出院。出院1个月后行血友病因子(von Willebrand factor,VWF)活性检测,提示VWF活性抗原17.2%(O型血42.0%~140.8%),基因检测出VWF自发突变(exon28∶c.4517C>T∶p.S1506L,错义突变),最终诊断为VWD。
2 讨论及文献复习
VWD是常见的遗传性出血性疾病,由VWF缺陷引起。VWD患病率达1%[1],大部分患者临床表现轻微或无临床表现,仅在家系调查时才诊断该病,因此易漏诊。VWD有常染色体显性及隐性遗传方式,其中大多数为常染色体显性遗传,男女患病概率相同[2]。VWF基因位于12号染色体短臂,包含约178个碱基序列(kilobases,kb),由52个外显子组成;VWF mRNA包含约9 kb[3-4]。
2.1 VWF的功能及特点
VWF是一种大分子量多聚糖蛋白(glycoprotein,GP),在止血过程中起两个关键作用:一是在血管损伤部位为正常的血小板黏附充当桥接分子,二是在高剪切力状态下促进血小板聚集。同时,VWF还是凝血因子Ⅷ在循环中的一种载体,通过将凝血因子Ⅷ的半衰期增加 5倍维持其正常水平[5-6]。本例患儿凝血因子Ⅷ水平较正常水平降低,考虑与VWF因子水平降低,导致凝血因子Ⅷ水平降低有关。
循环中的VWF是由基本二聚体亚单位形成的一系列多聚体。高分子量VWF多聚体是活性最强的VWF,可提供多个与血小板受体和损伤部位内皮下结构相互作用的结合位点。血浆VWF由巨核细胞和内皮细胞合成,并经大量合成后加工。当VWF从这些细胞中急性释放时,VWF所含多聚体甚至大于循环中通常观察到的多聚体。这些异常大的VWF有促血栓形成作用[7]。血浆中VWF的正常浓度为500~1 000 μg/dL。VWF的血浆浓度在正常人群中差异较大。导致这种差异的因素目前尚不明确,但VWF基因的多态性似乎比较重要[8]。VWF的血浆浓度受个体血型的影响。O型成人血浆中的VWF水平较A、B或AB型血个体低25%~30%,是由于VWF的部分碳水化合物结构与ABO血型系统的相同,从而影响了VWF的清除[9-10]。
2.2 VWD临床表现及分型
虽然VWF水平降低常见,但仅部分患者因出血症状就医并被诊断为VWD。出血发生率低的原因为多数患者病情较轻,部分患者没有出血诱发事件和/或没有意识到轻度的过量出血(如月经期出血量大)。当血浆中VWF减少得足够多或当VWF质量缺陷损害出凝血功能时,就会出现出血症状。以上异常主要影响初级止血过程中血小板栓子的形成。因此,VWD的许多常见临床表现与血小板疾病的表现相似,如易发瘀斑、皮肤出血、黏膜表面(口咽、胃肠道和子宫黏膜)长时间出血[11]。本例患儿主要表现为反复鼻腔黏膜出血及皮肤瘀斑,最初行凝血因子检测正常,血小板聚集功能检测异常,被诊断为血小板功能异常。VWD可分为3型,见表1。

表1 VWD临床表现及分型
2.3 VWD的诊断思路
有上述出血表现,尤其是多部位出血表现者,需警惕VWD,并进一步检测明确。对于有VWD家族史的患者,出血史阴性并不能排除VWD。通常VWD患者的血小板计数正常,PT正常,APTT可能正常或延长,具体取决于因子Ⅷ水平降低程度。APTT延长但凝血因子Ⅷ水平正常或降低不明显,轻型血友病A的诊断标准为凝血因子Ⅷ活性>5%~40%,范围较宽。对于VWD,并没有一个确定值低于某个数值才考虑VWD,需结合临床表现及其他检查进一步判断,血友病主要以关节软组织出血多见,而VWD以皮肤黏膜出血多见,不能以血友病A解释时,需考虑VWD。怀疑VWD患者可行初筛试验:血浆VWF抗原(VWF∶Ag)、血浆VWF活性[瑞斯托菌素辅因子活性(VW∶Rco)、VWF胶原结合能力(VWF∶CB)]、凝血因子Ⅷ活性。若异常则进一步采用凝胶电泳检查VWF多聚体分布、瑞斯托菌素诱导的血小板聚集(RIPA)[18-19]。
基因检测有助于VWD的诊断,但VWD基因突变存在较大差异。在严重的1型和3型中观察到VWF的定量缺陷主要由等位基因缺失或突变(大基因缺失、终止密码子、移码突变或剪接位点突变)引起,但也可能是由VWF基因的启动子区突变引起。对于这些缺陷,3型主要是纯合子或复合杂合子,1型主要由杂合错义突变引起。然而,约30%的1型患者未能检测出VWF基因突变。2型VWD的特征是错义突变,其位于受影响的功能域。亚型2A、2B和2M的遗传是常染色体显性遗传。亚型2N具有隐性遗传模式[20-22]。
本例患儿血小板计数正常,PT及APTT均正常,血小板聚集功能异常,但输注血小板后仍反复出血,结合其凝血因子Ⅷ水平低于正常对照组,行VWF活性检测发现异常,进一步基因检测显示VWF自发突变(错义突变),最终诊断为VWD。VWD诊断流程见图1。
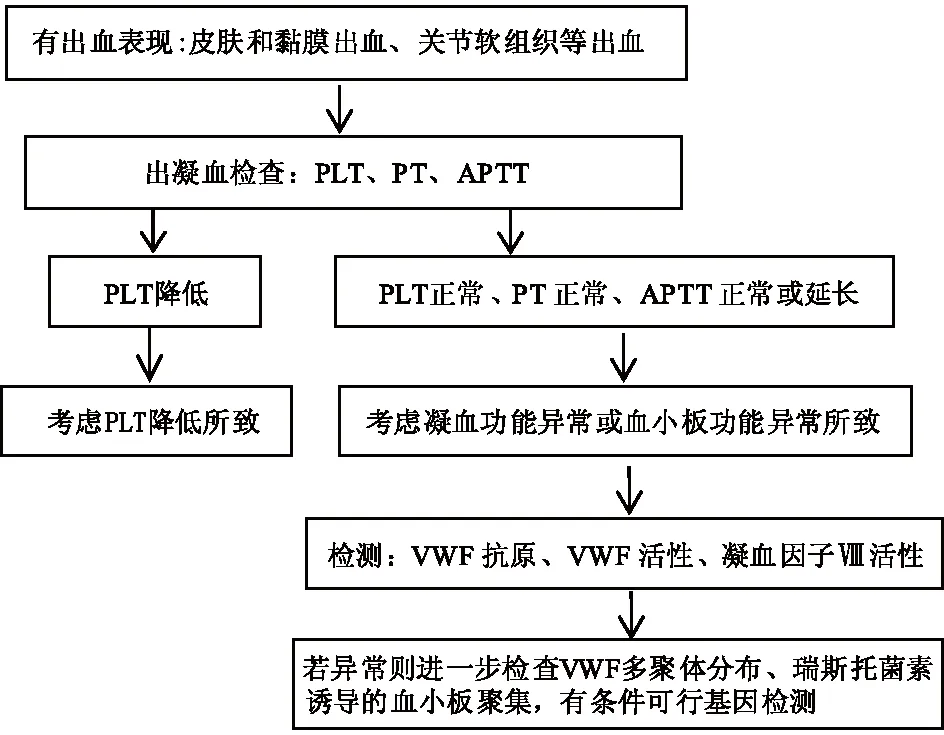
图1 VWD诊断流程图
2.4 VWD的治疗
目前,VWD的治疗主要基于症状和出血严重程度。多数患者属于较轻亚型,如1型VWD,因此仅需间断治疗。治疗目标是增加循环VWF活性和减少出血。
2.4.1 去氨加压素 去氨加压素(1-desamino-8-D-arginine-vasopressin,DDAVP)是一种血管加压素类似物,与血管内皮细胞表面的血管加压素受体结合,从而增加细胞内钙,触发VWF、凝血因子Ⅷ和其他凝血蛋白释放。最终导致循环中VWF和凝血因子Ⅷ的增加及系统性止血的改善。同时DDAVP也促进释放组织纤溶酶原激活剂(TPA)。因此,抗纤溶治疗常与DDAVP联合应用,可改善止血效果。此方法已成功地应用于治疗多种先天性出血疾病[23-24]。
1型、多数2型VWD患者可能对DDAVP有反应,而3型患者可能对DDAVP无反应。某些2B型患者应用DDAVP后可出现症状恶化,而其他患者可获得良好治疗效果。因此,只有对尝试性输注有充分反应且血小板减少无持续恶化的2B型患者才可考虑使用DDAVP。DDAVP可通过静脉给药、皮下注射给药或鼻内喷雾剂给药。但DDAVP较少用于<2岁儿童。
2.4.2 VWF替代疗法 3型、较严重的1型及2A、2B和2M型VWD患者常需要含VWF产品的替代疗法,尤其是在较严重出血而其他措施无效,或需长期治疗的情况(术后)。现有多种含高浓度VWF的制剂,包括“中等纯度”的血浆源性因子Ⅷ浓缩剂(含VWF)、更高纯度的VWF浓缩剂和一种重组VWF制剂。在多数严重病例中,VWF和凝血因子Ⅷ水平降低,往往需要替代治疗。不同可用产品含不同比例的VWF和凝血因子Ⅷ,具有不同的比活性。因此,在用VWF/凝血因子Ⅷ浓缩物治疗患者之前,应考虑比活度和VWF∶Rco/VWF∶Ag和VWF∶Rco/凝血因子Ⅷ比值[25-26]。重组人血管性血友病因子(recombinant human von Willebrand factor,rVWF)含有全部范围的VWF多聚体(包括超高分子量多聚体)及充足的VWF活性[27]。
2.4.3 对症治疗 抗纤溶剂:止血剂如氨甲环酸和氨基磺酸能抑制纤维蛋白溶酶原与纤维蛋白的相互作用,从而防止纤维蛋白凝块降解。因存在于这些组织中的高纤溶活性,其在黏膜中的治疗较有效。因此,在皮肤黏膜出血的情况下,由于成本低、副作用少,建议采用抗纤溶药物支持治疗[28]。
局部用药物:局部用药最常用于鼻腔或口腔出血,局部压迫止血、明胶海绵填塞等[29]。此外,为了防止手术或牙科手术后出血,安全缝合对于实现局部止血也十分重要[30]。
2.4.4 白细胞介素-11(IL-11) 对野生型小鼠和VWD小鼠模型的早期研究表明,IL-11可显著增加血浆VWF。Ragni M V等[31]报道了9例轻度VWD患者使用不同剂量的IL-11皮下注射7天的Ⅱ期前瞻性试验,结果VWF水平增加了1.5~3倍。此外,有临床研究显示,轻度VWD和难治性月经过多的患者,IL-11可降低月经出血的严重程度[32]。
2.4.5 基因治疗 近年来,基因治疗在先天性出血性疾病中的应用取得了一些进展。但VWD的基因治疗具有挑战性,因VWF基因较大,导致在大多数病毒基因转移载体中插入VWF cDNA的难度也较大。Wang L等[33]在小鼠模型中发现慢病毒载体可将完整的小鼠VWF cDNA在体内直接转移到VWF基因敲除小鼠的新生肝脏,结果发现VWF多聚体的产生和VWF水平恢复到33%。尽管结果看起来很有希望,但在临床应用前,仍需进一步研究。
3 小结
VWD是常见的遗传性出血性疾病,但临床出血程度轻重不一,轻者易漏诊;因可影响血小板聚集功能及凝血因子Ⅷ水平,易与血小板功能障碍及血友病A混淆。对于有反复出血表现,以血小板疾病及血友病不能解释,特别是有阳性家族史者,应及时完善相关检查进行诊断、治疗。

