番茄幼苗避荫反应的特征及栽培时底部补光作用的初探
许译天,刘 畅,李 琳
(1. 复旦大学 遗传工程国家重点实验室,上海 200438; 2. 复旦大学 生命科学学院,上海 200438)
光是地球生命活动的能量来源,同时也是一种不可或缺的环境信号,植物的萌发、生长发育、开花结果、衰老死亡等一系列活动都与光有关.植物叶片中的叶绿素可以吸收波长630 nm左右的红光和470 nm左右的蓝紫光进行光合作用[1].自然条件下,在充足光照环境中,红光与远红光的比例(R/FR)通常在1.2左右,但是当植物高密度种植时,位于上层的植物叶片会吸收红光和蓝紫光进行光合作用并反射远红光,这使下层植物接收到的R/FR降低[2-3],从而感受到邻近竞争者的存在,我们将这种环境称为荫影(Shade, SH).此外,太阳与地面的倾角以及周围环境因素的变化也会影响R/FR的值,比如黎明和黄昏时分,由于大气对光的吸收和散射作用,R/FR会有所下降[2].荫影不耐受植物在荫影下会产生避荫反应(Shade Avoidance Response, SAR),发生一系列形态学变化,如下胚轴、节间的伸长、叶柄的延伸[4];持续的荫影会导致早花、分枝减少、对食草昆虫更敏感以及种子减少等表型[5].
在农业生产实践中,过高种植密度导致的避荫反应往往对于需要收获果实的农作物具有较为严重的负面影响,比如高密度种植会降低玉米叶片的叶绿素含量和净光合速率,使穗粒数和千粒重减少,导致单株产量下降[6];荫影也会抑制小麦的光合效率,导致其成穗数下降[7];同样,水稻的产量及质量也会受到荫影的影响[8];油菜在种植密度过高时单位面积有效角果数和总产量均被抑制[9].因此,了解避荫反应产生的分子机制,尝试改善植物在避荫反应下的不利表型,探究提高高密度种植下作物产量的方法,是现代农业生产突破的重要环节.
番茄(Solanumlycopersicum)作为一种重要的经济作物,其栽培面积大、经济效益高,特别在中国北方,番茄已经成为主要作物之一.光照条件对于番茄的生长发育十分重要,研究发现,红光处理能使金棚朝冠番茄果实具有更高的可溶性固形物含量和糖酸比[10];远红光处理能导致番茄“Komeett”的叶面积变大且叶柄伸长[11];改变红光蓝光比例也会影响北京樱桃番茄的光合效率以及干重积累等表型[12].在荫影下生长的番茄其表型和产量也会受到明显的影响,比如,通过降低红光与远红光比例(R/FR=0.5)来模拟荫影处理能够增加栽培品种Moneymaker(MM)的节间长度[13],从而使自身能够与临近植物竞争更多阳光.同时,持续的荫影处理会使野生型番茄真叶面积增大[14],并导致番茄栽培品种M82的叶形改变及花青素降解[15].针对大棚中真实的密植环境研究发现,过高的种植密度会导致番茄植株的节间长度及株高增加、茎干变细、叶面积增大[16];同时,高密度种植会延长番茄的生长周期,并使单果重量降低,且容易引发病虫害[17].由此可见,过高的种植密度会影响番茄的产量,对农业生产造成不利的影响.
目前对番茄中避荫反应分子机制的研究还很少.已知番茄中含有5种光敏色素(Phytochrome),分别为phyA、phyB1、phyB2、phyC和phyE,其中phyB1、phyB2和phyE同属于phyB亚家族,它们主要感受红光与远红光[13,18].光敏色素phyB的突变体幼苗在红光照射下具有相较野生型更长的下胚轴,它对红光照射不敏感.研究发现,当对番茄进行35 d的长时间荫影(R/FR=0.5)处理后,tri/phyB1单突变体具有与对照MM相比更长的节间,而其他光敏色素单突变体如phyB2、friop则与对照组表型类似[13].但是对于光敏色素调控番茄避荫反应的具体机制却还没有研究.同时,荫影会对番茄的色素含量产生影响[15,19],但是在色素相关突变体中番茄的避荫反应也没有研究.光敏色素相互作用因子(Phytochrome Interacting Factors, PIFs)是一类bHLH转录因子,在拟南芥中已经证明它可以在光敏色素的下游发挥功能,调节植物的避荫反应[20].番茄中共有8个PIFs(PIF1a, PIF1b, PIF3, PIF4, PIF7a, PIF7b, PIF8a, PIF8b)[21],PIF4对于番茄叶片衰老、果实中类胡萝卜素的合成以及番茄耐高温能力的发挥有着重要的调控作用[22].最近的研究发现,荫影下番茄Ailsa Craig(AC)中的PIF4也可以通过调控生长素合成和信号传递相关基因的表达促进下胚轴伸长[23].但是目前对于番茄中避荫反应的表型及分子机制的研究都还处于起步阶段.
在农业生产中,提高高密度种植状态下作物产量的方法主要有两种: 一是对农作物品种的改良,比如杂交水稻[24]、转基因玉米[25]等,而这需要对该物种避荫反应产生的分子机制有一定的了解;二是种植培养方式的改良,通过对光条件、土壤资源、生长空间的综合利用从而实现产量的提高.比如,对于大田中种植的作物,通过使用宽窄行种植代替等行距种植[26-27],可以提高玉米、高粱等作物在高密度种植下的群体光能利用率,增加光合作用面积,从而提高作物的生产潜力.对空心菜、番茄等蔬菜,也可以利用日光温室或塑料大棚来改变温度、光照时间、光强光质等关键环境条件[28-30],从而改善作物生长状态及产量.
之前的研究发现,调整光照强度和方式可以影响植物的生长发育[29,31],补充额外的光源也可以改善果实的品质[32],但是这些研究都集中在对顶部光条件的改变上.传统的顶部补光对那些被上部叶片遮蔽的底部叶片来说收效甚微,底部补光可以让那些被遮蔽的叶片感受到光,但是否能帮助缓解避荫反应的表型还不清楚.在本研究中,我们使用LED三色光屏模拟荫影,测量了番茄幼苗第一节间长度、第一对真叶叶绿素、花青素含量,以此表征番茄在荫影下的生长情况,并检测了相关基因的表达水平.通过检测光受体突变体的表型,发现phyB1可能作为一种重要的元件调控番茄在荫影下的节间伸长和花青素的积累.在番茄幼苗底部进行红光和蓝光的补充照射,可以部分恢复番茄花青素含量和节间长度的表型,这表明可以通过底部补光的方法来减弱番茄的避荫反应,为农业生产提供可行的方法.
1 材料与方法
1.1 材料
表1显示了实验中所涉及到的番茄品种信息.MM、AC为番茄栽培品种;friop、friself、tri/phyB1、phyB2为光敏色素突变体;cry1为蓝光受体突变体.其中,friop、friself为对远红光不敏感的突变体,在远红光下表现出更长的下胚轴;tri/phyB1为对红光不敏感的突变体,phyB2本身表型正常,与tri/phyB1共同缺失会表现出更长的节间;cry1为隐花色素突变体,具有伸长的下胚轴和茎干,且花青素减少.a、al、aw、ag为花青素突变体,hp-1为色素相关突变体.其中,a的茎干和叶片中不含有花青素;al只在幼苗阶段出现中等水平的花青素累积,随后消失;aw完全不含有花青素;ag除了叶片下部外均不含有花青素,hp-1在果实中具有高水平的类胡萝卜素等色素.番茄品种信息来源于https:∥tgrc.ucdavis.edu,全部番茄种子购买于C.M. Rick Tomato Genetics Resource Center.
1.2 培养种植方法
将番茄种子在75%乙醇中旋转清洗10 min,晾干.将种子放于吸饱水的滤纸上,置于持续白光下(80 μmol·m-2·s-1)发芽,7 d后转移到蛭石土壤中进行培养,使用LED三色光屏提供持续光源(红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光5 μmol·m-2·s-1),温度22 ℃,湿度60%.
1.3 光条件处理
将21 d大的番茄幼苗置于模拟荫影下生长,光条件为红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光60 μmol·m-2·s-1,生长6 d后取样检测.补光处理方式: 对于在荫影下生长的番茄,在盆下方增加一块LED光屏,额外补充单光(20~50 μmol·m-2·s-1)处理,6 d后取样进行检测.
1.4 检测指标及方法
1.4.1 第一节间长度
将在荫影下生长6 d后的番茄幼苗用惠普扫描仪(Scanjet 8270)进行扫描,使用Image J软件对第一节间(从子叶叶柄处起始至第一真叶叶柄处终止)长度进行测量.
1.4.2 叶绿素含量
使用手持式叶绿素测量仪器SPAD-502(Konica Minolta)测量第一对真叶中的叶绿素含量,以spad指数表征叶绿素含量.该仪器利用叶绿素只吸收红光和蓝紫光且不吸收远红光的特性,通过测量叶子在红光(650 nm)区域和远红光(940 nm)区域的吸收率计算出spad值,来表示目前叶片中叶绿素含量的相对参数.
1.4.3 花青素含量
取第一对真叶并称重(m鲜叶),放入液氮中迅速冷冻并研磨样品,每片叶子加入600 μL 1% HCl的甲醇溶液,置于黑暗下4 ℃过夜,随后12 000 r/min离心10 min,取上清(约500 μL)置于新的离心管中,加入500 μL水、1 mL氯仿并震荡混匀,于4 ℃下放置30 min,再次12 000 r/min离心10 min.取上清使用721S可见分光光度计(上海仪电分析仪器有限公司)分别测量530 nm处和657 nm处的吸光度(A),通过公式(A530-A657)/m鲜叶计算花青素含量.
1.5 基因表达水平检测
1.5.1 RNA提取
将在白光(WL)生长21 d大的幼苗一半样品转入荫影(SH)处理,一半继续在白光下生长,6 d后分别取第一节间和第一对真叶样品,迅速放入液氮中冷冻并研磨.加入500 μL TRIzol,震荡15 s,室温静置5 min.随后加入100 μL氯仿,震荡15 s,室温静置3 min,4 ℃ 12 000 r/min离心15 min.取300 μL上清液加入新的离心管内,并加入300 μL异丙醇,颠倒混匀,室温放置10 min.随后再次4 ℃ 12 000 r/min离心10 min,去掉上清,加入1 mL 75%乙醇吹洗几次,4 ℃ 10 000 r/min离心5 min,去除上清.室温晾2~3 min,加入50 μL RNase-Free H2O溶解RNA,进行浓度测定,于-80 ℃冰箱保存或直接反转录.
1.5.2 反转录
使用天根公司FastKing一步法除基因组-cDNA第一链合成预混试剂,配制20 μL反转录体系(5×FastKing-RT SuperMix 4 μL,RNA 0.05~2 μg,RNase-Free H2O补至20 μL),42 ℃ 15 min去除基因组并反转录,95 ℃ 3 min酶灭活,得到的cDNA于-80 ℃冰箱保存或直接进行qRT-PCR.
1.5.3 实时定量PCR
使用圣尔公司2×Qpcr SYBR Green Master Mix试剂,配制20 μL PCR体系(2×SYBR Green Mix 10 μL,引物F 1 μL,引物R 1 μL,cDNA 1 μL,RNase-Free H2O 8 μL).将配好的体系加入96孔板中并低速离心,随后放入荧光定量PCR仪(Bio-rad CFX Connect)中,设定程序(95 ℃ 5 min;95 ℃ 15 s;57 ℃ 10 s;72 ℃ 30 s;进行40个循环;95 ℃ 10 s;65~95 ℃读取溶解曲线).每个样品进行3个技术重复,引物详细信息见表2.PCR完成后,获取Cq值,并计算相关表达水平(=2Cq内参-Cq基因).
1.6 数据分析
使用Microsoft Excel(版本16.39)、Graphpad Prism7.0软件对实验数据进行整理、分析、作图,通过t-test检验分析显著性差异.Gene Ontology(GO)分析使用在线网站http:∥bioinfo.sibs.ac.cn/plant-regulomics/.
2 结果与分析
2.1 荫影诱导番茄幼苗节间伸长,并抑制叶片中叶绿素和花青素含量
多数喜阳植物在荫影来临时会快速促进茎干和节间伸长,从而与临近植物竞争更多阳光[33];同时,植物叶片中的叶绿素含量能够体现植物对光能的吸收,叶绿素含量降低会影响光合作用进而抑制生长发育[34];植物色素花青素作为一种类黄酮物质,具有较强的抗氧化活性[35],而高温或干旱等环境变化都会改变作物中的花青素含量[36-37].因此,在本研究中我们选择节间长度、叶片叶绿素含量、花青素含量这3个表型作为番茄响应荫影的检测指标.由于MM和AC的表型稳定,生长周期较短,且不具有抗虫抗病等特征,因此常被用作番茄表型研究中的对照品种,多数突变体都是在MM和AC背景下构建.我们对生长在模拟白光(R/FR=4)和荫影(R/FR=0.4)下的番茄MM和AC的表型进行检测,结果发现,相比于在白光下生长的幼苗,荫影下生长的幼苗展现出更长的第一节间(图1(a、b),见第744页).同时荫影可以显著降低第一对真叶中叶绿素(图1(c),见第744页)和花青素(图1(d),见第744页)的含量.这些结果表明,荫影对于MM和AC这两种栽培品种幼苗的节间长度和叶片叶绿素、花青素的含量有显著的影响.

图1 番茄栽培品种幼苗MM和AC在白光和荫影下的表型Fig.1 Phenotypes of tomato MM and AC under white light(WL) and shade(SH) (a) 白光或荫影下MM和AC番茄幼苗表型照片;(b) 第一节间长度;(c) 第一对真叶叶绿素含量;(d) 第一对真叶花青素含量;通过t-test检验分析显著性差异,*P<0.05,**P<0.01,***P<0.001;将白光(WL)下生长21 d的番茄幼苗转入荫影(SH)处理6 d或在白光下继续生长6 d后取样检测;光条件WL: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光5 μmol·m-2·s-1,SH: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光60 μmol·m-2·s-1.每种处理条件的n>16,进行3次生物学重复.叶绿素含量为spad值,花青素含量=(A530-A657)/m鲜叶.
2.2 番茄伸长相关基因及花青素合成基因的表达水平受荫影的调控
为了解释荫影下番茄出现一系列表型变化的原因,我们对在低R/FR比例(R/FR=0.05)下生长4 d的番茄幼苗的Microarray数据[19]进行了Gene Ontology(GO)分析,发现不论是在茎干还是叶片中均有大量基因响应荫影而发生表达水平的改变.其中,在茎中检测到1 583个基因在荫影处理后显著上调,并在GO分析中富集到与细胞壁合成有关的GO条目(图2(a)),符合茎在荫影下伸长的表型数据;在叶中检测到1 307个基因在荫影处理后显著下调,并在GO分析中富集到与光合作用及叶绿素有关的GO条目(图2(b)),这也符合荫影下叶片中叶绿素减少的变化.进一步地,我们根据GO分析的结果以及番茄在荫影下出现的表型,针对相关基因的表达水平进行了实时定量PCR分析.由于植物激素生长素在促进植物伸长生长中发挥重要的功能[5,38],而细胞壁松弛和伸展相关的木葡聚糖内转糖苷酶/水解酶XTH基因家族能通过调控细胞壁的形成来影响植物的伸长生长[39],因此我们对MM中生长素响应基因IAA4/IAA7/IAA17和伸长相关基因XTH9的表达水平进行分析.结果发现,荫影下这4个基因在番茄第一节间中的表达水平显著提升(图2(c)),但是它们在真叶中受到荫影调控的变化不显著(图2(d)),说明荫影下生长素响应和细胞壁合成相关基因主要影响了节间的伸长情况.同时我们也对花青素合成基因DFR/ANS的表达水平进行检测,结果表明,不论在叶片和还是节间中,这2个基因的表达水平都被荫影大幅度抑制(图2(c~d)),从而导致荫影下花青素含量减少的表型.这6个基因的表达变化趋势与Microarray数据相符.通过上述结果可知,在荫影下番茄促进伸长的基因大量表达,而叶绿素相关基因和调控花青素合成的基因表达被抑制,从而导致其表现出荫影下节间快速伸长而叶绿素、花青素含量降低的表型.

图2 荫影处理下番茄转录组数据分析及节间和真叶中相关基因的表达水平Fig.2 GO analysis of transcriptome data and expression levels of related genes in tomato internode and leaf after shade treatment白光下(R/FR=4.6)生长24 d的番茄转到荫影下(R/FR=0.05)处理4 d后(a)茎中显著上调基因和(b)叶中显著下调基因的生物学过程GO分析.白光和荫影下MM中生长素响应基因IAA4/IAA7/IAA17、促进伸长基因XTH9及花青素合成基因DFR/ANS在(c)节间和(d)真叶中的相对表达水平.将白光(WL)下生长21 d的番茄幼苗转入荫影(SH)处理6 d或在白光下继续生长6 d后取样检测(通过t-test检验分析显著性差异,*P<0.05,**P<0.01,***P<0.001);光条件WL: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光5 μmol·m-2·s-1,SH: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光60 μmol·m-2·s-1.
2.3 光受体参与调控番茄幼苗的避荫反应
由于光受体是接收光照、感知光条件变化的重要感受器,因此在确认了荫影下番茄幼苗的节间长度以及叶绿素和花青素含量的相关表型后,我们对番茄红光、远红光、蓝光光受体的突变体进行了表型检测(图3(a),见第746页).结果发现,当进行6 d的荫影处理后,friop、friself、phyB2、cry14个突变体均表现出了被荫影显著诱导的节间伸长的表型.tri/phyB1突变体在白光下具有更长的节间,丧失了荫影诱导的进一步伸长(图3(c),见第746页),这表明phyB1在调控荫影下番茄的节间伸长方面发挥着一定的作用.同时,相较于对照组MM,不论在白光还是荫影下光受体突变体中的真叶叶绿素含量均有所降低,
但依旧展现出对荫影的响应(图3(d)),说明荫影影响了叶片中叶绿素的合成等生理活动,并且phyA、phyB1、phyB2、cry1这几个光受体均参与调控这一过程.对花青素含量的检测发现,friop、friself、phyB2这3种突变体具有对荫影的响应,并且在荫影下含量进一步降低,而在tri/phyB1突变体中花青素含量在荫影下没有显著的改变,同样,在cry1中花青素含量也丧失了响应荫影的变化(图3(e)),这些结果说明phyB1和cry1也可能参与调控了荫影下花青素的含量变化.
此外,由于花青素的含量受到了荫影的调控,我们也对花青素及色素相关突变体在荫影下的表型进行了检测(图3(b)).结果发现: 它们的第一节间长度在荫影下的变化趋势和对照组AC类似,各类色素相关突变体均表现出了响应荫影处理的节间伸长,且除a外,其他4个突变体的节间长度均被荫影显著诱导(图3(f)).叶绿素的含量在a、al、aw、ag中的水平与对照组AC类似,而在hp-1突变体中明显减少,但它们仍然具有响应荫影降低的表型(图3(g)).在花青素突变体中花青素的水平极低,且除了hp-1突变体外均丧失了对荫影的响应(图3(h)).由于花青素突变体的节间长度和叶绿素含量依旧有响应荫影的显著改变,说明调控花青素和叶绿素的途径并不互相影响.以上的结果表明,光受体在番茄幼苗对荫影的响应中发挥一定的功能,并且phyB1可能起主要作用.
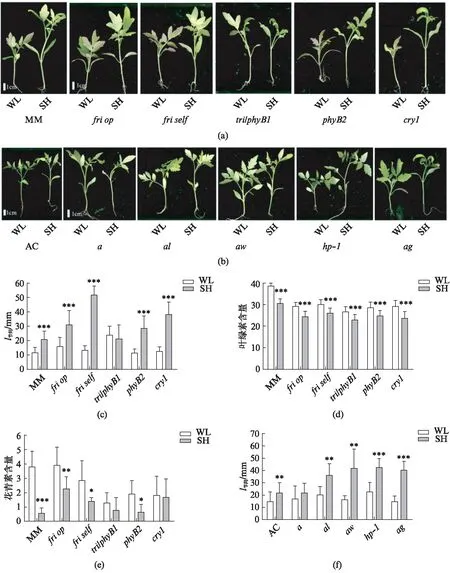
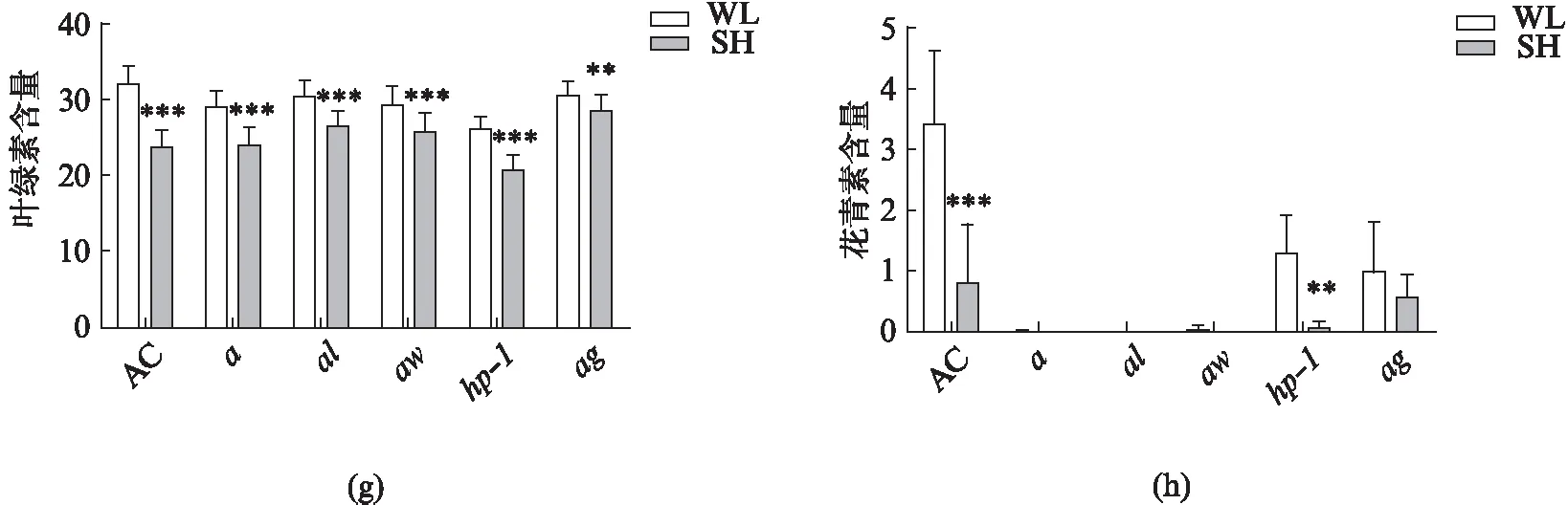
图3 光敏色素突变体和花青素突变体在荫影下的表型Fig.3 Phenotypes of phytochrome mutants and anthocyanin mutantsunder white light(WL) and shade(SH)(a) 光敏色素突变体在白光或荫影下的表型图;(b) 花青素突变体在白光或荫影下的表型图;(c) 光敏色素突变体第一节间长度、(d) 第一对真叶中的叶绿素含量、(e) 花青素含量;(f) 花青素突变体第一节间长度、(g) 第一对真叶中的叶绿素含量、(h) 花青素含量;数据通过t-test检验分析显著性差异,*P<0.05,**P<0.01,***P<0.001;将白光(WL)下生长21 d的番茄幼苗转入荫影(SH)处理6 d或在白光下继续生长6 d后取样检测;光条件WL: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光5 μmol·m-2·s-1,SH: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光60 μmol·m-2·s-1.每种处理条件的n>16,进行3次生物学重复.叶绿素含量为spad值,花青素含量=(A530-A657)/m鲜叶).
2.4 底部补光可以减弱番茄幼苗的避荫反应
为了探寻减弱番茄避荫反应的方法,我们对处于荫影环境下的番茄在底部补充额外的LED光源,检测该方法是否可以恢复番茄幼苗在荫影下表现出的过度伸长的节间和降低的叶绿素、花青素含量的表型.由于红光对于番茄的生长十分重要,并且phyB1作为一种红光光受体可能参与了番茄幼苗对于荫影的响应,因此我们首先选择红光作为底部补光的光源,在对白光下生长21 d的番茄进行荫影处理的同时进行底部补光,并通过梯度改变光强来寻找最佳的补光条件.对第一节间长度、叶绿素和花青素含量的检测(图4(a~c))发现,对荫影下的番茄使用20~50 μmol·m-2·s-1的红光进行底部补光后,MM和AC两种品种的番茄避荫反应均被一定程度地减弱.其中叶绿素含量的恢复最为明显,当补充的红光强度在40 μmol·m-2·s-1及以上时,可以将荫影下生长的番茄幼苗真叶中的叶绿素含量恢复到白光下的水平(图4(b)).其次,第一节间长度(图4(a))和花青素含量(图4(c))在底部补光后的表型也得到了部分恢复,虽然在光强提高到


图4 底部补光后荫影下的番茄表型Fig.4 Phenotypes under the shade with the supplemental light at the bottom 底部补充额外红光下番茄(a) 第一节间长度、(b) 真叶叶绿素含量、(c) 花青素含量;(d) 底部补充额外蓝光时MM第一节间长度、真叶叶绿素、花青素含量,通过t-test检验分析各组间的显著性差异;将白光(WL)下生长21 d的番茄幼苗转入荫影(SH)处理6 d同时底部补充红光或蓝光(SH-R/SH-B),或在白光下继续生长6 d后取样检测;光条件WL: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光5 μmol·m-2·s-1,SH: 红光20 μmol·m-2·s-1,蓝光20 μmol·m-2·s-1,远红光60 μmol·m-2·s-1.每种处理条件的n>10,进行3次生物学重复.叶绿素含量为spad值,花青素含量=(A530-A657)/m鲜叶.
50 μmol·m-2·s-1时也不能完全达到白光下的生长水平,但是相较于生长在荫影下的番茄,表型已有了明显的改善.此外,由于植物也可以吸收蓝光进行光合作用为自身生长提供能量,因此我们也选用了30~40 μmol·m-2·s-1强度的蓝光作为底部补光光源,结果发现,对MM补充蓝光同样可以减弱番茄对荫影的响应(图4(d)),但是同等强度下红光的作用更为明显.因此,使用一定强度的红光进行底部补光可以作为改善高密度种植下番茄生长情况的一种方法.
3 讨 论
随着世界人口的增长和农耕土地面积的减少,提高单位面积作物的产量成为当前亟待解决的难题,而高密度种植导致的避荫反应则是限制农业单位产量的重要因素之一,例如玉米[6]、小麦[7]、水稻[8]等粮食作物,当种植密度过高时它们的单位产量都明显降低.番茄是一种重要的农作物,它的农业生产环境对于其作物产量和果实品质等方面都有着重要的影响,过高的种植密度会影响它的生长和产量[16].和模式植物拟南芥类似,番茄也会通过光敏色素感知荫影,并产生显著的表型变化,但与拟南芥不同的是,番茄的叶片形态为羽状复叶,在感受到荫影来临时,番茄的叶面积会增大.此外番茄具有果实,在成熟阶段番茄果实中的色素含量也会受到光条件的影响.同时,由于番茄植株具有节间,当R/FR发生变化时,节间的快速伸长可以很好地表征番茄的避荫反应情况.针对番茄在荫影下的蛋白质组学分析发现,与日光生长相比,有47个蛋白的表达水平在荫影下显著下调,其中包括决定光合作用中碳同化速率的关键酶Rubisco、一些ATP酶及与代谢及呼吸相关的蛋白,这说明当植物感受到荫影后会将所有可利用的能量投入到节间和茎干的伸长中[40].
在本研究中,我们发现在荫影下生长的番茄幼苗表现出了明显的节间伸长以及叶片花青素、叶绿素减少的表型,并且转录表达水平的检测结果表明,促进伸长的相关基因在节间中的表达水平显著上调,尤其是一些生长素响应基因;而不论在节间中还是叶片中,调控花青素合成的基因表达都在荫影下被显著抑制,这些基因表达水平的变化与表型变化相吻合.不同突变体在荫影下的表型显示光受体在番茄幼苗对荫影的响应中发挥重要的功能,phyB1可能起主要作用.同时,对处于荫影下的番茄进行底部补光处理,结果表明,在底部提供额外的光源可以使番茄的避荫表型减缓,叶绿素含量能够恢复到白光下的水平,节间长度和花青素含量也得到了部分的恢复.因此该方法可以为农业生产中高密度种植的番茄改善光照条件.通过梯度实验对比,我们认为补充红光的效果比蓝光更好,且最适宜的底部补光光强为40 μmol·m-2·s-1.
相较于底部补光,顶部补光的方法在种植密度高时收效甚微,由于上层叶片的遮挡,下层叶片依旧处于荫影中,其接收到光强增长并不明显,而底部补光则可以保证位于下方的叶片接收到充足的光照,叶片背部具有少量的叶绿素,能够对整体的光合作用作出贡献.同时我们观察到,生长于荫影加底部补光条件下的番茄与生长于白光下的番茄相比,虽然节间更长,但同时它的茎干也更粗壮、叶面积更大,整体生长状态优于仅有上方光源的番茄.这可能是由于底部补光导致植物接收到的总光强变高,植物对光能的吸收和光合效率有所提高导致的,该表型也和之前的研究结果[32]一致.同时,已有报道称番茄的叶形与叶面积同样会影响其光合作用及果实产量与品质[15],更宽大的叶子不仅可以提高产量,还可以促进营养物质和糖分的积累,从而提高口感[41],因此,底部补光的方法不仅能够优化番茄生长状态,还可能提高果实的品质.此外,顶部补光的方法仅能应用于大棚种植培养,而不适用于大田作物,底部补光的操作则更为简便易行.对于在大棚温室中生长的作物,可以在底部铺上不同颜色的反光膜,并在温室两侧予以光照,利用反光膜将光源照射到作物底部,从而达到补光效果;在大田中种植时可以将LED光源直接架设于作物下方进行补光,或者在田间铺设反光膜,对阳光进行反射,从而达到底部补光的目的.
The Characteristics of Tomato Seedlings in Shade and thePreliminary Study of the Effect on Seedlings withSupplemental Light at the Bottom

