上海某水库水源水中微生物多样性表征初探
朱宜平, 安 东
(1. 上海城投原水有限公司,上海 200125; 2. 复旦大学 环境科学与工程系,上海 200433)
微生物指标可以量化微生物种群属性之间差异,微生物群落状况与水质状况有着密切的联系,当水环境改变时,微生物种类和多样性也随之改变.生物多样性、优势种群和群落结构等变化可以反映水质受损的程度,与污染物浓度和毒性作用等评价相结合,可以预测无法监测到的水质问题.由于微生物指标在水质评估中有积极作用,研究水源水的微生物种群以及有机物的影响是十分必要的[1-3].研究发现,有机物不仅影响微生物活性,而且在微生物降解过程中还可能转化为潜在的有毒副产物[4].López-Glvez等[5]研究了农产品洗涤水中低氧嗜中性细菌与高游离氯浓度的关系,表明洗涤水中高游离氯(FC)和氧化还原电位(ORP)的升高与洗涤产品中微生物负荷的降低有关.此外,许多研究探讨了水源水中微污染物对微生物群落[6]及对废水和饮用水分配系统中微生物的聚集能力和生物膜生长的影响[7].Wang等[8]研究了饮用水分配系统中的微生物对抗生素磺胺嘧啶和环丙沙星的反应,在磺胺嘧啶和环丙沙星的作用下,水中生丝微菌属(Hyphomicrobium)中16S rRNA的增加与给水管网中抗生素耐药基因的上升有关.Tong等[9]探究了氧氟沙星对人工湿地中微生物群落结构的影响,在种植系统中,氧氟沙星增加了节杆菌属(Arthrobacter)、假单胞菌属(Pseudomonas)和肠球菌(Enterococcus)的相对丰度,这些微生物已被证明可产生耐药性.
本研究选取上海市某水源水库进水(UO)和出水(WDE)为研究对象,通过微生物多样性表征方法,初步研究了该水库进出水中微生物之间的差异和相似之处,为进一步研究同类型水源水库微生物多样性特征及其与水质的关系提供数据支持.
1 材料与方法
1.1 实验水样采集
采集上海市某水库的进水和出水样品,采集水样量为4 L.取1~3 L左右水样,经0.22 μm滤膜过滤,以滤膜上有可见覆盖物为准,后置于冻存管中,液氮速冻,置于-80 ℃冰箱冷藏待测.
1.2 微生物测定方法
1.2.1 DNA的抽提与质检
采用环境样本DNA提取试剂盒(OMEGA Bio-tek,美国)完成基因组DNA抽提,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA完整性,Qubit Picogreen荧光定量系统定量DNA浓度.
1.2.2 目标区域扩增及产物纯化
采用低循环数扩增,使用TaKaRa EX Taq高保真DNA聚合酶,利用Applied Biosystems 2720 Thermal Cycler进行PCR扩增.扩增产物使用2%琼脂糖凝胶电泳检测,检测后使用AxyPrep Mag PCR Clean-Up Kit(Axygen公司)磁珠回收纯化,检验合格后定量建库.
1.2.3 荧光定量
纯化后的PCR产物采用Qubit Picogreen荧光定量系统定量浓度,按照每个样本的测序量要求进行相应比例的混合,备用于测序文库构建.运用高通量测序技术,基于Illumina HiSeq 2500平台对宏基因组进行测序分析.
基于Miseq测序平台获得的数据进行拼接及质控过滤,获得优化序列;区分样本后进行操作分类单元(Operational Taxonomic Units, OTU)聚类,得到样品与OTU丰度矩阵;选取每个OTU中丰度最高的序列作为OTU的代表序列,与物种分类数据库进行比对注释,获得样品与物种丰度的矩阵.基于上述两个矩阵的信息,开展多样性指数分析,并在各个分类水平上进行群落结构的统计.包括Alpha多样性分析[10]、Beta多样性分析[11]、物种组成分析等.
2 结果与讨论
2.1 Alpha多样性分析
对目标水样进行了Alpha多样性指数分析,单个样品的物种多样性结果如表1所示.物种丰富度指数(Richness、Chao、ACE)[12]和多样性指数(Shannon、Simpson)是反映微生物群落变化的综合量.此外Good’s Coverage(覆盖度指数)验证了痕量测序量合理性,即被检测到的物种的比例.

表1 不同样品Alpha多样性指数Tab.1 Alpha diversity index for different water samples
通过高通量测序分析了6个样品的微生物群落多样性和系统发育结构.稀释曲线(图1(a))说明该样本的测序数据量的合理性,同时也可以比较不同样本的物种丰富度.在该测序条件下,每个样品可测的物种数在400~500左右,见表1.将序列进行随机抽样,用所抽到的序列数表示的OTU的数量用于构建稀释性曲线.如图1(a)所示,样本的稀释性曲线趋于平缓,表明测序数据趋于饱和,测序深度足以反映样本中的所有OTU信息.物种累积曲线用于判断样本量是否充分以及物种丰富度的估计,如图1(d)所示,在一定范围内,随着样本量的加大,曲线趋于平缓,表明抽样充分,可以进行数据分析.Rank abundance(相对丰度)曲线反映物种丰度和物种均匀度,如图1(c)所示.对得到的数据进行整理绘制出的稀释曲线、相对丰度曲线和物种累积曲线表明样品中物种的丰富度和多样性可以满足进一步研究要求.此外,所有样本的覆盖度指数(Good’s Coverage)平均为99.7%±1.5%,说明测序深度足以进行群落分析.结果表明:不同取样点的物种总数有所差异,进水口所检测到的OTU总数分别为433、421和431,而出水口OTU总数分别为423、409和417.

图1 样本稀释曲线、Shannon曲线、相对丰度曲线和物种累积曲线Fig.1 Curves of sample rarefaction, Shannon, rank abundance and species accumulation
结果表明,进出口的物种丰富度较高,出水口物种丰富度较低.Chao指数和ACE指数是估计群落中含OTU数目的指数,表示物种的丰富度,值越大代表物种总数越多.由表1可知,ACE指数的变化范围为432.6~457.2,Chao指数的变化范围为439.5~464.2,最小值为出水口WDE2,该样本点出现的种类数为409种,也为各采样点最小,最大值样本点为进水口UO1,种类数为433.Shannon和Simpson多样性指数综合考虑了物种的丰富度和分布均匀度,Shannon和Simpson指数值越大,说明群落多样性越高.进水口Shannon多样性指数的变化范围是4.43~4.73,Simpson指数的变化范围是0.96~0.98,出水口Shannon多样性指数的变化范围是4.20~4.42,Simpson指数的变化范围是0.96~0.97.结果表明各样品间的OTU数目分布差异不大,进出水的种类和数目有差异,进水口物种多样性均大于出水口且多样性的均匀度(Evenness)也稍高于出水口样品.
2.2 物种组成分析
为了表征水源水样品中的微生物群落结构,使用朴素贝叶斯分类器(Ribosomal Database Project,RDP)进行分类学分析.物种丰度比例图分别根据物种分类单元的界、门、纲、目、科、属、种层次对每个样本进行计数,计算相对比例并作图.各样本门级、属级物种组成如图2和图3(见第808页)所示.结果表明,在门水平上的优势微生物组成种类基本相似,变形杆菌(Proteobacteria)、放线菌(Actinobacteria)、蓝藻/叶绿体(Cyanobacteria/Chloroplast)、拟杆菌(Bacteroidetes)等丰度较高.其中进水口的Proteobacteria丰度最高为40.6%,与进水口相比,出水口具有较低丰度(25.1%);出水口Actinobacteria的丰度占比高达了50.7%.从分类结果来看,Actinobacteria在出水样品中占主导地位,进水口仅为38.6%.
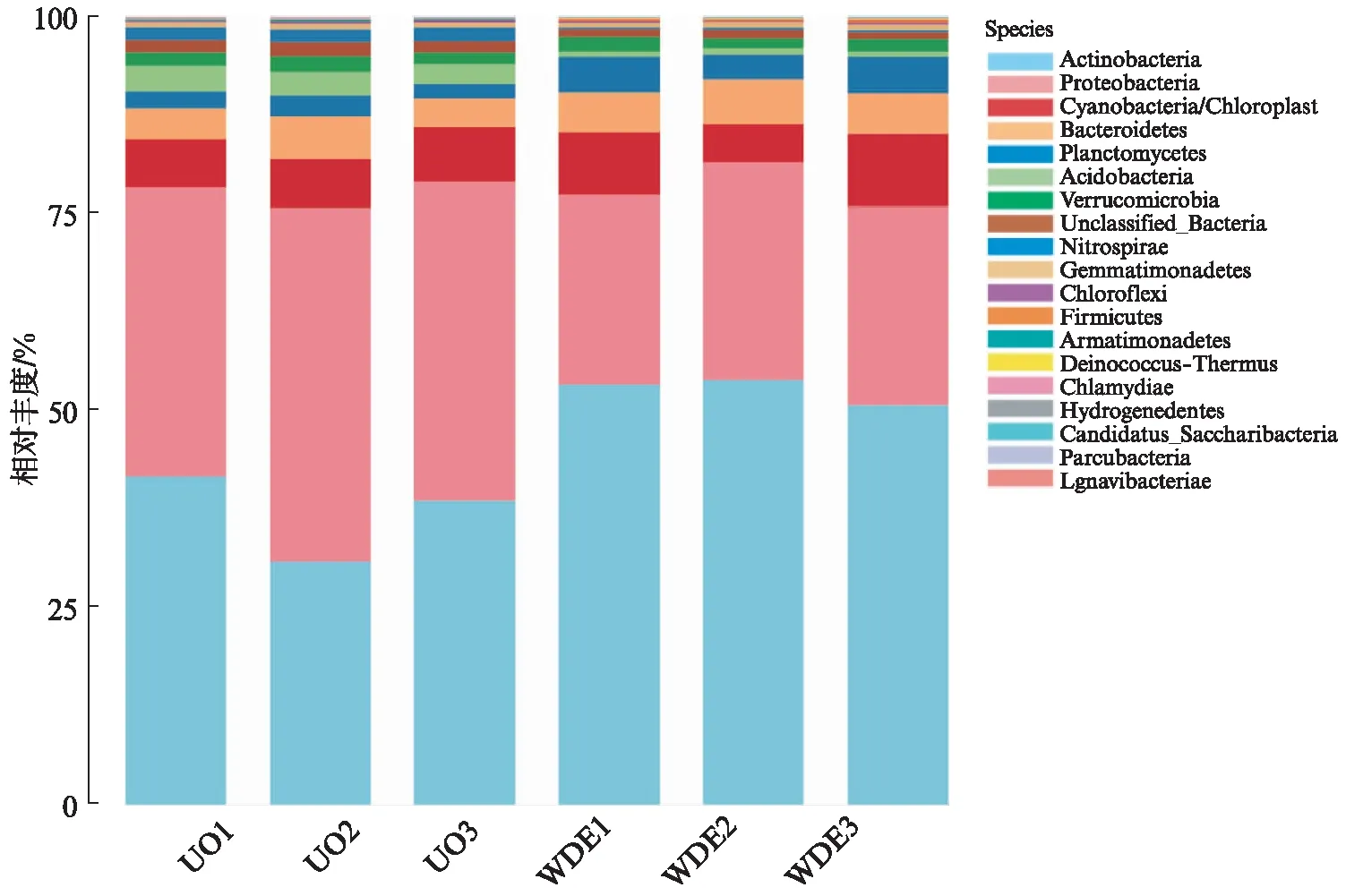
图2 样品的优势门相对丰度Fig.2 Relative abundance of source water samples on the dominant phylum level
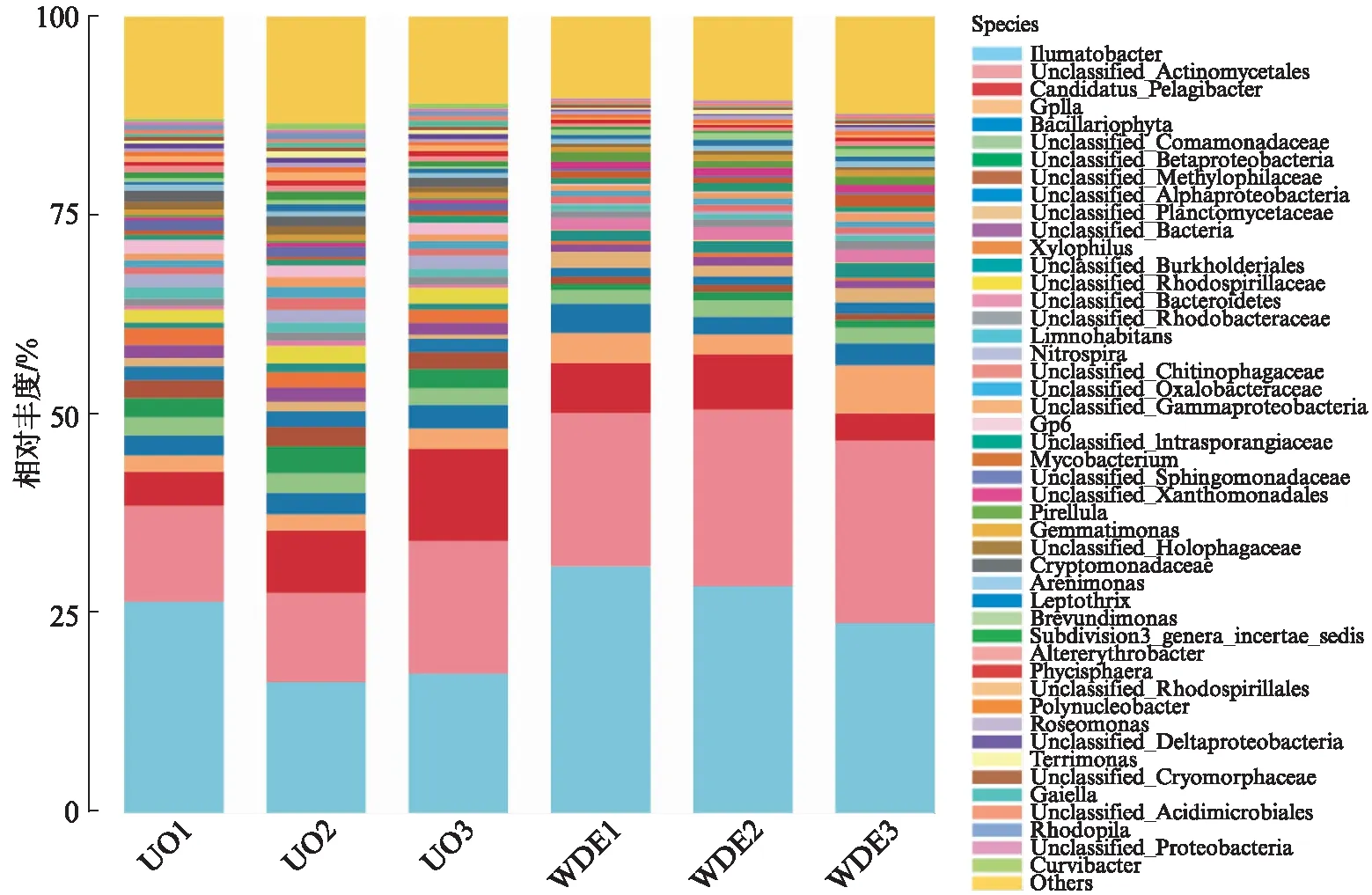
图3 样品的优势属相对丰度Fig.3 Relative abundance of source water samples on the dominant genus level
进出水样品在属水平上的优势微生物组成种类相似,Ilumatobacter、Gplla、Actinobacteria、洋杆菌(Pelagibacter)等丰度较高.其中Ilumatobacter在各样品上的丰度最高,进水口为20.2%,出水口为27.8%,其次是Actinobacteria,进水口和出水口分别为13.2%和22.9%.进水口Proteobacteria的丰度最高,Proteobacteria可与水中的蛋白质发生氨化反应,由于进水口受人类活动影响较大,生活污水和工业污水排入河流中,导致河流中蛋白类有机物的增加,使得水库进水口含有较多蛋白类有机物.进出水中的优势微生物有差异,这可能是因为水库出水口受人类活动影响较小,使Proteobacteria丰度低于进水口.与进水口相比,出水口的Actinobacteria丰度占比较高,在出水样品中占主导地位,Actinobacteria具有降解纤维素及各种有机物质(包括芳香族化合物)的能力,表明出水样品中含有的芳香族化合物高于进水口.
进一步通过热图分析该区段属水平的进出水样品中高丰度微生物,结果如图4所示.结果表明:Ilumatobacter、Actinobacteria、Pelagibacter在进出水样品中都显示出了较高的丰度,微生物群落结构略有差异,出水口样品的微生物丰度高于进水口样品.此外,通过维恩图(图5)可以看出进出水样本中共有的核心物种有429种,进水样本中独有的OTU有41中,而出水样本中则有30种.
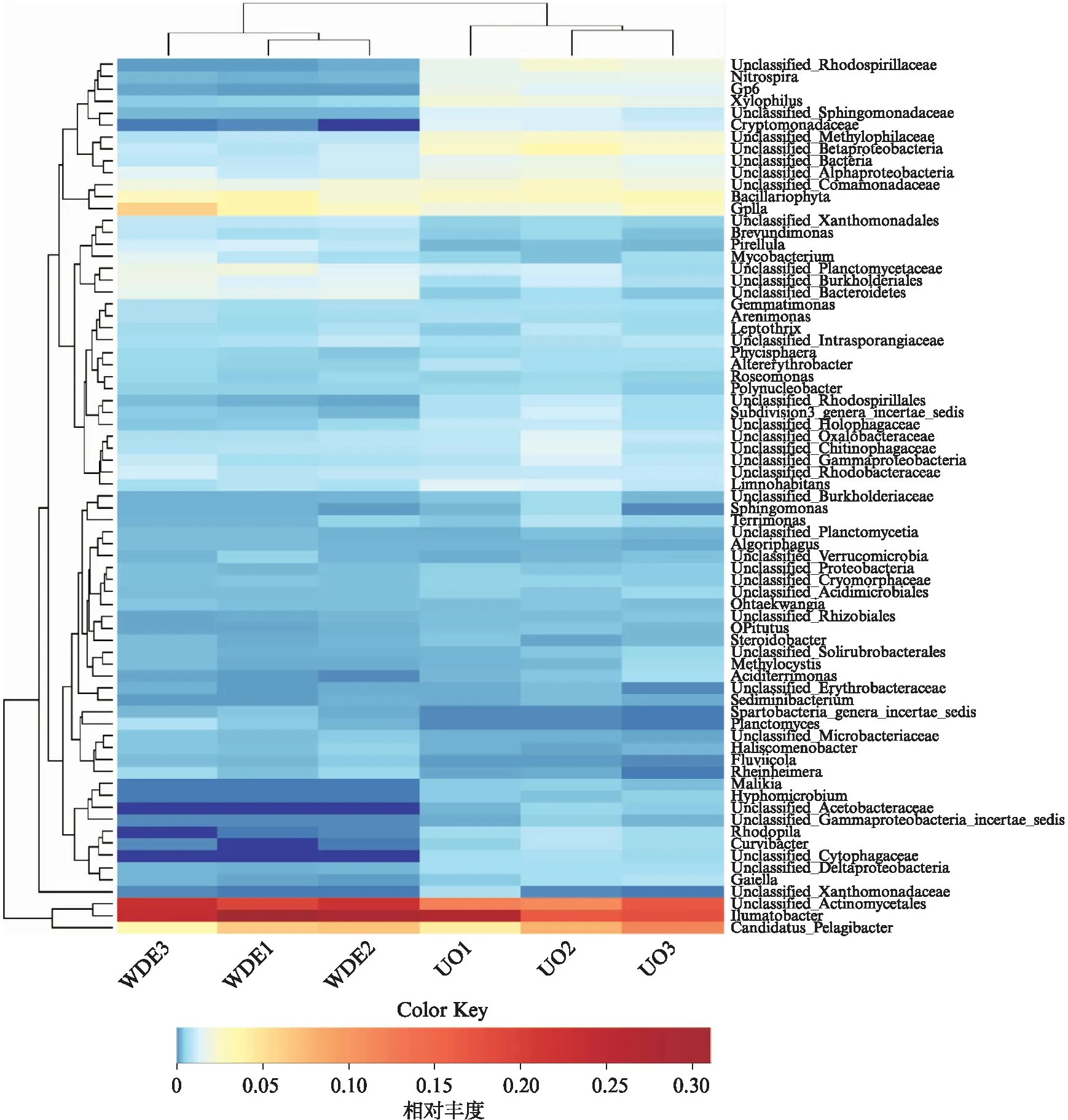
图4 样品中属水平微生物群落的热图分析Fig.4 Heatmap analysis for microbial commanities in source water samples on the dominant genus level

图5 进出水中微生物种数维恩图Fig.5 Venn picture of microbial species number in source water samples
2.3 Beta多样性分析
为了进一步研究水源水中不同样本中最主要的元素和结构,进行了主成分分析PCA(Principal Component Analysis)和主坐标分析PCoA(Principal Co-ordinates Analysis),观察6个样品的微生物群落整体变化情况,结果如图6所示.通常,两个样本点与点之间的距离越近,它们的组成就越相似,图中PC1、PC2通过降维处理后,所有OTU通过线性组合而成的对方差解释度最大的新变量.结果表明: 出水组3个点微生物组成相似,而进水组3个点的微生物群落略有不同.整体上看,进水组的微生物组成与其他出水有显著差异,说明PC1是导致进出水差异的主要因素,同时验证了这个因素有较高的可能性影响了样品的组成,说明微生物多样性在水库内发生了种群变化.
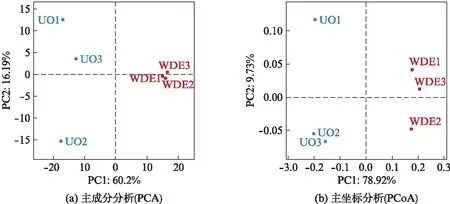
图6 样品主成分和主坐标分析Fig.6 Principal component and principal co-ordinates analysis of source water samples
3 结 论
水源水中进出水口的微生物群落及种类有明显差别,进水口中微生物多样性均大于出水,多样性的均匀度也高于出水样品的均匀度.在门水平上的优势微生物组成种类上,进水的Proteobacteria丰度最高,Proteobacteria易与水中蛋白质发生氨化反应,可以表明水库水进出水中含有较为丰富的蛋白类有机物,而受人类活动影响较小的出水口中Actinobacteria占主导地位,表明出水中含有的芳香族化合物可能高于进水口.微生物多样性的表征尚不能完全反应水源水质特征,但可以从微生物的角度分析水源水质的成分变化等,对于丰富水源水质研究和保护水源生态健康具有一定的意义.

