下调AQP-4 对脑缺血再灌注损伤模型大鼠的干预效果及作用机制研究
惠超杰李文辉曹立新慕莉蓉
(1.青海大学附属医院神经外科,西宁 810001; 2.青海大学附属医院干部保健科,西宁 810001)
大脑是人体对缺氧最为敏感的器官,脑组织缺血的情况下会导致大脑局部组织及其功能的损害,损害的程度大多数和缺血时间的长短以及残存血流量的多少有着一定的关联[1]。 短期的不完全缺血只会引起可逆性的损害,长时间的完全缺血或严重性缺血会引起梗死,组织学病变下最明显的组织学变化是脑水肿以及细胞的坏死[2]。 脑缺血在一定时间后恢复血供,其功能不但不会出现恢复,反而会出现更加严重的脑功能障碍,该症状被称之为脑缺血-再灌注损伤[3]。 脑缺血-再灌注损伤是一个包括花生四烯酸代谢障碍在内的一种多因素参与的较为复杂的病理过程,其中包括了缺血期的原发性损伤和再灌注期的继发性损伤[4]。 本研究中建立大鼠脑缺血再灌注损伤模型,靶向调控AQP-4,旨在探究下调AQP-4 对脑缺血再灌注损伤模型大鼠的干预效果及作用机制。
1 材料和方法
1.1 实验动物
选取40 只清洁级SD 健康雄性大鼠购自广州赛业百沐生物科技有限公司[SCXK(粤)2020-0055],大鼠饲养在青海省大学附属医院[SYXK(粤)2020-0242],体重210~243 g,平均(226.5±13.2)g。 在12 h 光照,湿度45%~55%,温度25℃环境下喂养大鼠一周。 本研究通过我院伦理委员会批准((2020)年伦审(45)号),且遵守3R 原则进行。
1.2 主要试剂与仪器
兔抗大鼠AQP-4 抗体(Hyclone 公司;货号:PAB28892);大鼠抗大鼠IL-1β、IL-6、TNF-α 抗体( Selleck 公司; 货号: ATA31401; FNab04283;ATA38860);大鼠抗兔BMP4、P-Smad 抗体(Gibco公司;货号:FNab00919;H00004091-B01P);Na+、Pdp 试剂盒(南京建成生物工程研究所;货号:CKE10708;FT-P91045 T)。
1.3 实验方法
1.3.1 造模及分组干预
随机选取10 只大鼠作为本文研究正常组,不做任何处理。 其余30 只大鼠建立脑缺血再灌注损伤模型:对大鼠进行麻醉干预后固定,颈中皮肤剪开,将颈内、外动脉、左侧颈总动脉暴露于手术视野之中并分离,结扎颈外动脉、翼腭窝。 使用线栓对颈总动脉远端切口至颈内动脉2 cm 处进行穿线,对脑组织中动脉近端血流进行阻塞,2 h 后去除线栓并再灌注1 d。 将30 只脑缺血再灌注损伤大鼠随机分为模型组、上调AQP-4 组、下调AQP-4 组各10 只,上调 AQP-4 组大鼠尾部静脉注射30 mg/kg agoAQP-4,下调AQP-4 组大鼠尾部静脉注射30 mg/kg antagoAQP-4,正常组、模型组大鼠尾部静脉注射等量生理盐水。
1.3.2 大鼠脑组织含水量测定
选取相同时间点各组各1 只大鼠,处死后提取完整脑部,分批处死,切除前端的嗅球以及后部的小脑和脑干,随后沿大脑的正中线切开,提取左侧的半脑组织,使用电子分析天平对半脑组织进行称量湿重,称重后记录,随后防止红外线干燥箱内进行烘干,直至恒重,干重后再次进行测量记录并进行计算,计算公式为:脑组织含水量=(湿重-干重)/湿重×100%。
1.3.3 大鼠学习记忆能力检测
提前准备高50 cm、直径150 cm 的圆形水池,在水池内标注4 个点位,标注好之后注入半池温水,水温为25℃。 随后在水池中央内放入高30 cm、直径10 cm 的平台。 分别于已标记的4 处点位在造模成功后1 周后将大鼠置于水中,统计各组大鼠自如水点游至预置平台时间,将120 s 内未游至平台的大鼠引至平台之上,将潜伏期记为120 s,大鼠在平台上停留30 s 之后,再将其放置其他不同入水点进行重新测试。 所有大鼠均连续测试4 d,在第5 天时将平台撤除,将大鼠从入水点放至水中,记录60 s 以内大鼠穿越平台的次数。
1.3.4 制作标本和HE 染色
标本制作:取各组大鼠尾部静脉血2 mL,离心处理15 min 后分离上清液,放置-80℃环境下保存待测。 各组大鼠麻醉处死,提取大鼠海马区组织,固定浸泡至4%甲醛中,于24 h 后行常规石蜡包埋以及连续切片。
HE 染色:将切片烤干后,进行包埋脱蜡处理,处理后顺序置入不同浓度的乙醇中个复水3 min。随后使用苏木精染色15 min 后进行清洗,清洗3 次后使用盐酸乙醇分化处理30 s,充分清洗后使用1%伊红进行染色,使用乙醇进行脱水处理后进行脱蜡处理,封片后使用显微镜进行观察。
1.3.5 各组大鼠TNF-α、IL-1β 水平检测
使用散射比浊法检测TNF-α、IL-1β 水平:根据待检验TNF-α、IL-1β 中提取的血清样品在凝固的过程中发生变化的散射光确定检测,在光探检测器为九十度直角的单色光源中向血清样本加凝血激活剂,在样品凝块的过程中,散射光的强度会慢慢增加,当血清样本完全凝固后,光探测器会发生变化,会送到检测器上处理并且描出凝固曲线后检测TNF-α、IL-1β 的变化。
1.3.6 Na+、P-dp 含量检测
大鼠处死后取脑组织,去掉嗅球、小脑和地位脑干,在冰上将大脑组织按照1 ∶9的生理盐水制成10%的组织均浆进行离心处理,离心后提取上清液随后使用试剂盒测定,测定时严格按照试剂盒说明书进行。
1.3.7 AQP-4、BMP4、P-Smad 表达检测
使用Western blot 法检测AQP-4、BMP4、P-Smad表达:首先使用PBS 缓冲液对标本进行冲洗,随后裂解30 min,裂解后测定其蛋白浓度。 取20 μg 蛋白质进行电泳,电泳的同时加入蛋白缓冲液,10 min后把电转膜放置到浓度为10%的牛奶中进行浸泡,常温环境下封闭2 h。 封闭后结合一抗孵育1 d,第2 天取出后使用TBST 液进行冲洗,随后结合二抗。1 h 后进行清洗、显色,对蛋白AQP-4、BMP4、PSmad 表达进行检测。
1.4 统计学方法
使用SPSS 20.0 软件分析。 计量资料使用平均数±标准差(±s)进行描述,两组间比较进行独立样本t检验;计数资料以%表示,两组间比较进行χ2检验,多组对比行联合假设检验(F检验)检验,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 大鼠学习记忆能力比较
如表1 所示,与正常组比较,其他三组大鼠各时间点逃避潜伏期较长、穿越平台次数较低(P<0.05);与模型组和上调AQP-4 组相比,下调AQP-4组大鼠各时间点逃避潜伏期较短、穿越平台次数高(P<0.05)。
表1 各组大鼠学习记忆能力比较(±s,n=10)Table 1 Comparison of learning and memory abilities of rats in each group
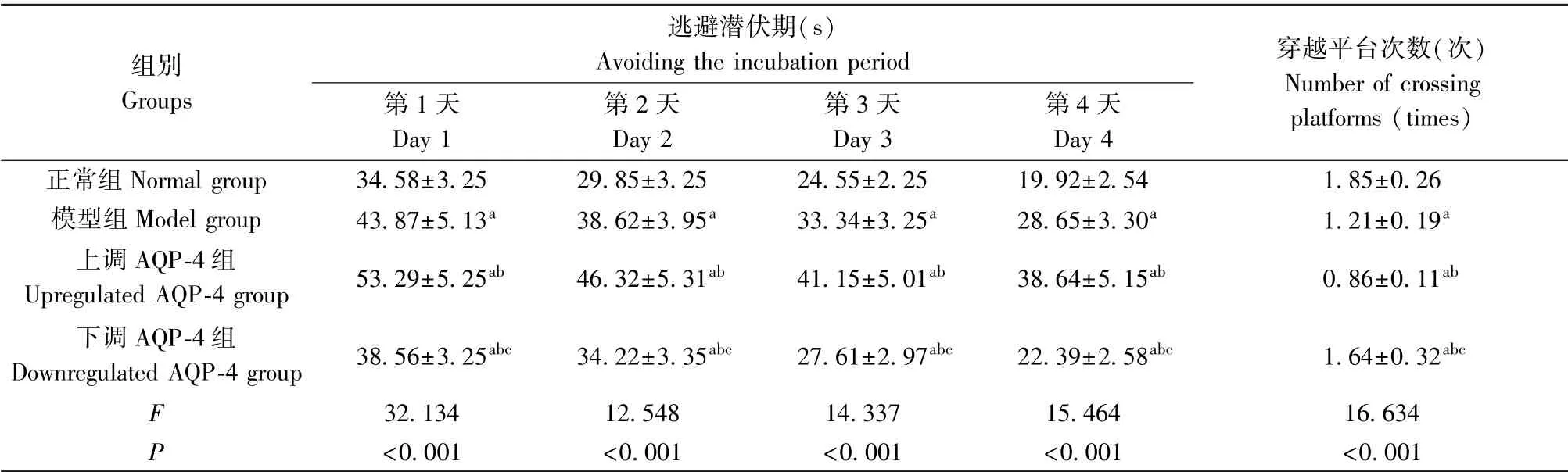
表1 各组大鼠学习记忆能力比较(±s,n=10)Table 1 Comparison of learning and memory abilities of rats in each group
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05;与上调AQP-4 组相比,cP<0.05。Note. Compared with normal group, aP<0.05. Compared with model group, bP<0.05. Compared with the upregulated AQP-4 group, cP<0.05.
组别Groups逃避潜伏期(s)Avoiding the incubation period第1 天Day 1第2 天Day 2第3 天Day 3第4 天Day 4穿越平台次数(次)Number of crossing platforms (times)正常组Normal group 34.58±3.25 29.85±3.25 24.55±2.25 19.92±2.54 1.85±0.26模型组Model group 43.87±5.13a 38.62±3.95a 33.34±3.25a 28.65±3.30a 1.21±0.19a上调AQP-4 组Upregulated AQP-4 group 53.29±5.25ab 46.32±5.31ab 41.15±5.01ab 38.64±5.15ab 0.86±0.11ab下调AQP-4 组Downregulated AQP-4 group 38.56±3.25abc 34.22±3.35abc 27.61±2.97abc 22.39±2.58abc 1.64±0.32abc F 32.134 12.548 14.337 15.464 16.634 P<0.001 <0.001 <0.001 <0.001 <0.001
2.2 各组大鼠脑组织病理HE 染色图
如图1 所示,正常组大鼠脑组织细胞排列规则,结构完好,细胞核较为清晰。 模型组与上调AQP-4组脑组织细胞排列顺序错乱,细胞核出现破裂情况,并且伴随着水肿的存在,炎症细胞入侵。 下调AQP-4 组大鼠脑子细胞排列较为规则,细胞核破裂情况、水肿、炎症入侵情况较轻。

图1 各组大鼠脑组织病理HE 染色图Figure 1 HE staining of the pathological brain tissue of rats in each group
2.3 各组大鼠神经功能和脑组织含水量对比
如表2 所示,与正常组相比,模型组、上调AQP-4 组、下调AQP-4 组神经功能评分上升,脑组织含水量增多(P<0.05);与模型组和上调AQP-4 组相比,下调AQP-4 组神经功能评分下降,脑组织含水量减少(P<0.05)。
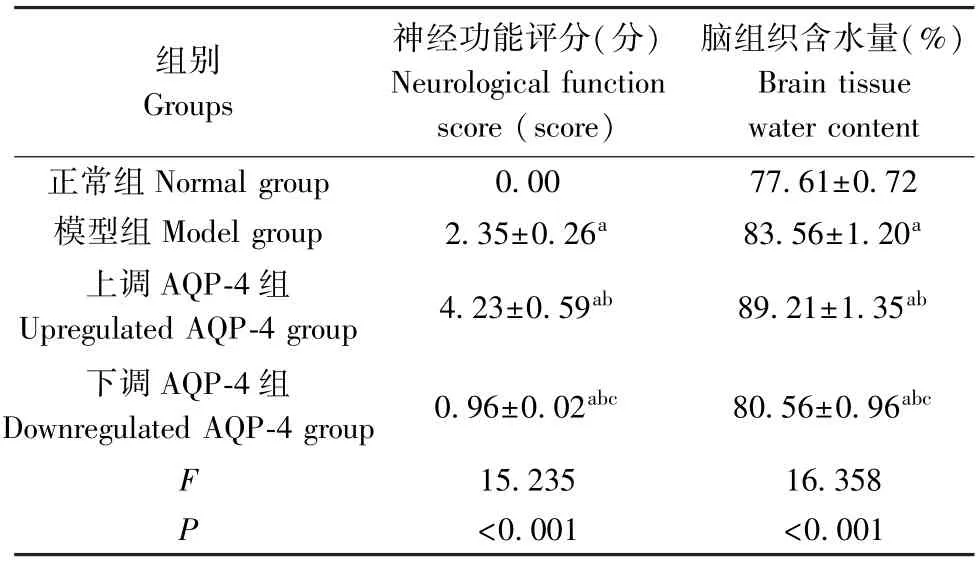
表2 各组大鼠神经功能评分和脑组织含水量对比( x-±s,n=10)Table 2 Comparison of nerve function score and brain tissue water content of rats in each group
2.4 各组大鼠TNF-α、IL-1β 水平比较
如表3 所示,与正常组比较,其他三组大鼠TNF-α、IL-1β 水平升高(P<0.05);与模型组和上调AQP-4 组相比,下调AQP-4 组大鼠TNF-α、IL-1β 水平下降(P<0.05)。
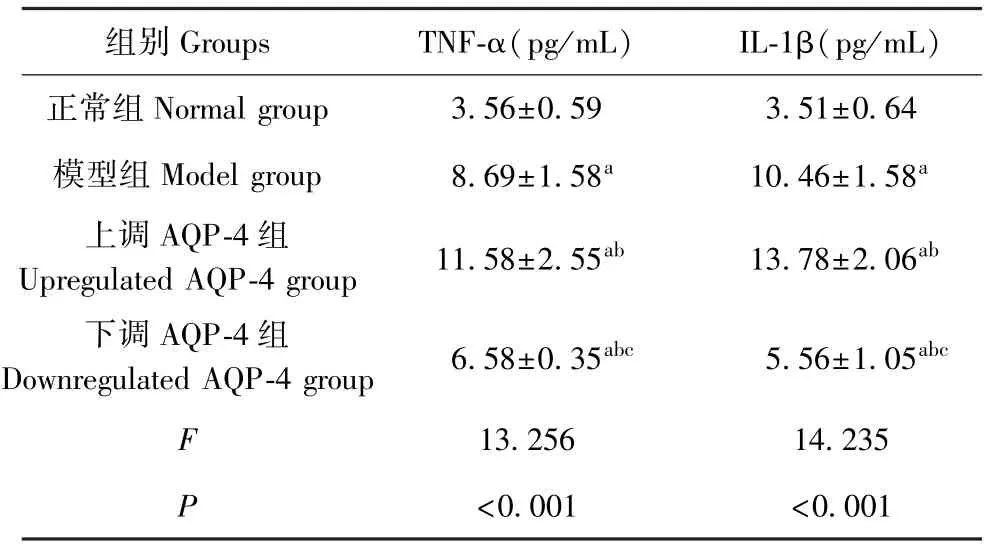
表3 各组大鼠TNF-α、IL-1β 水平比较( x-±s,n=10)Table 3 Comparison of TNF-α and IL-1β levels in each group
2.5 各组大鼠AQP-4、BMP4、P-Smad 表达比较
如表4、图2 所示,与正常组比较,其他三组大鼠AQP-4 表达上升、BMP4、P-Smad 表达下降(P<0.05);与模型组和上调AQP-4 组相比,下调AQP-4组大鼠AQP-4 表达下降、BMP4、P-Smad 表达上升(P<0.05)。

图2 AQP-4、BMP4、P-Smad 表达Western blot 蛋白图Note. A, Normal group. B, Model group. C, Upregulated AQP-4 group. D, Downregulated AQP-4 group.Figure 2 Western blot protein expression ofAQP-4, BMP4 and P-Smad
表4 各组大鼠AQP-4、BMP4、P-Smad 表达比较(±s,n=10)Table 4 Comparison of expressions of AQP-4, BMP4 and P-Smad in each group

表4 各组大鼠AQP-4、BMP4、P-Smad 表达比较(±s,n=10)Table 4 Comparison of expressions of AQP-4, BMP4 and P-Smad in each group
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05;与上调AQP-4组相比,cP<0.05。Note.Compared with normal group, aP<0.05. Compared with model group, bP < 0.05. Compared with the upregulated AQP-4 group,cP<0.05.
组别Groups AQP-4 BMP4 P-Smad正常组Normal group 0.35±0.05 1.58±0.79 1.53±0.69模型组Model group 1.03±0.12a 0.75±0.12a 0.57±0.10a上调AQP-4 组Upregulated AQP-4 group 1.24±0.15ab 0.61±0.09ab 0.49±0.09ab下调AQP-4 组Downregulated AQP-4 group 0.59±0.09abc 1.32±0.56abc 1.00±0.54abc F 15.235 13.582 13.215 P<0.001 <0.001 <0.001
2.6 各组大鼠Na+、P-dp 含量比较
如表5 所示,与正常组比较,其他三组大鼠Na+、P-dp 含量上升(P<0.05);与模型组和上调AQP-4 组相比,下调AQP-4 组大鼠Na+、P-dp 含量下降(P<0.05)。
表5 各组大鼠Na+、P-dp 含量比较(±s,,n=10)Table 5 Comparison of Na+ and P-dp contents in each group
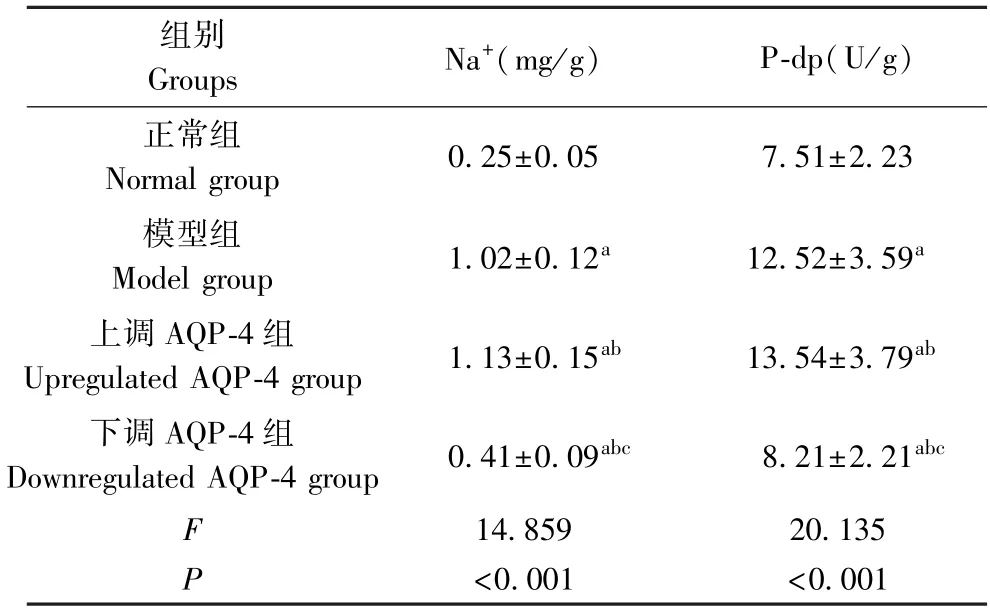
表5 各组大鼠Na+、P-dp 含量比较(±s,,n=10)Table 5 Comparison of Na+ and P-dp contents in each group
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05;与上调AQP-4组相比,cP<0.05。Note. Compared with normal group, aP<0.05. Compared with model group, bP < 0.05. Compared with the upregulated AQP-4 group, cP<0.05
组别Groups Na+(mg/g) P-dp(U/g)正常组Normal group 0.25±0.05 7.51±2.23模型组Model group 1.02±0.12a 12.52±3.59a上调AQP-4 组Upregulated AQP-4 group 1.13±0.15ab 13.54±3.79ab下调AQP-4 组ownregulated AQP-4 group 0.41±0.09abc 8.21±2.21abc F 14.859 20.135 P<0.001 <0.001 D
3 讨论
脑出血是目前人类死亡率较高的疾病之一,但该病的发病严重机制尚未明确[5]。 当脑缺血-再灌注发生时,不仅会造成脑水肿,还会对机体神经功能造成严重的损伤[6]。 截止到目前,临床众多学者仍并未将脑缺血再灌注损伤发病机制研究透彻,所以临床的治疗不太理想。 有学者指出,AQP-4 的分布于脑内水分子的运转有一定的关联,其对于维护大脑中的水平衡起到了一定的作用。 脑缺血再灌注损伤中AQP-4 呈现异常的表达[7]。 但是目前关于调控AQP-4 表达对脑缺血再灌注损伤干预效果的研究还鲜有报道。
AQP-4 作为一种水通道蛋白,广泛的存在于中枢神经系统中,其能够构成胶质细胞和脑脊液以及血管之间的水调节和运输的重要结构基础[8]。 临床研究显示,AQP-4 的表达与脑脊液的分泌、重吸收、电解质等生理过程密切相关[9]。 大量学者在研究中提到,水通道蛋白是一类存在于所有生命细胞屏障中膜转移通道的蛋白质,它们能够容许水分子在细胞和它的周围环境间运动,其主要分布在脑组织内面向毛细血管内皮细胞、软脑膜等细胞膜的足突上[10-11]。 本文研究中显示,脑缺血再灌注损伤大鼠AQP-4 表达异常升高,对其进行下调能够对大脑提供保护作用,改善脑缺血再灌注损伤大鼠认知功能、神经功能,使学习记忆能力得到提升,由此可见,对大鼠AQP-4 表达进行下调对大脑有着较好的保护作用。
大量临床研究显示,脑缺血再灌注损伤与炎症因子有着一定的关联,TNF-α、IL-1β 是临床最常用的检测因子,对其进行检测能够对较为直观的观测出脑缺血再灌注损伤的发生和发展[12]。 有临床研究显示,脑缺血再灌注损伤时炎症因子异常表达,对其进行有效的干预能够对其进行调控,说明炎症因子和脑缺血再灌注损伤有着密切的关联[13]。 本文研究中发现脑缺血再灌注损伤大鼠TNF-α、IL-1β水平较高,说明脑缺血再灌注损伤常常伴随着炎症反应的发生,与上述表达一致。 本文研究中还发现,下调AQP-4 表达的脑缺血再灌注损伤大鼠TNFα、IL-1β 水平下降,说明下调AQP-4 表达能够减轻脑缺血再灌注损伤大鼠脑组织的炎症反应程度,进而达到保护脑组织的作用。
大量研究表明,BMP4/Smad 通路在细胞凋亡、分化等过程中均有所参与,BMP4、Smad 为BMP4/Smad 通路的最主要配体[14]。 目前临床对BMP4/Smad 通路和AQP-4 表达的相关性尚未有报道。 本文研究中发现,脑缺血再灌注损伤大鼠BMP4、Smad表达较低,下调AQP-4 表达的脑缺血再灌注损伤大鼠BMP4、Smad 表达上调,说明脑缺血再灌注损伤伴随着脑组织神经细胞凋亡,对AQP-4 表达进行下调,能够通过BMP4/Smad 通路抑制脑缺血再灌注损伤大鼠脑组组织的自噬和凋亡,对脑组织进行保护。
综上所述,对脑缺血再灌注损伤模型大鼠进行下调AQP-4 表达,能够改善大鼠的学习记忆能力、神经功能,减轻脑缺血在灌注损伤大鼠的炎症反应,出现上述情况的原因可能与调控BMP4/Smad通路有关,为脑缺血再灌注损伤的临床治疗提供了新的研究方向和理论依据。

