新型大鼠严重失血性休克模型的建立
刘 琳,王砚明∗,赵惠民,贾东辉,刘 昱
(1.河北农业大学生命科学学院,河北 保定 071001;2.保定市第一医院胸外科,河北 保定 071066;3.保定市第二医院胸外科,河北 保定 071051)
失血性休克是一种外科常见的急危重症,是由于急性失血量超过机体总循环血量的20%(五分之一)而引起血液灌流减少,导致细胞功能所需的氧气和营养物质输送不足,它是创伤病例中最常见的死亡原因,也是全球总寿命损失的主要原因[1-3]。在过去的几十年中,人们已经做了大量的努力来阐明与严重出血相关的病理生理机制,已经建立了各种各样的实验条件,使研究人员能够研究低血容量性休克的影响,并评估各种治疗方案的潜在益处[4-8]。 然而,将这些实验结果转化为临床应用的治疗仍是一个挑战,部分原因可能是当前实验中使用的动物模型[9-16]。 目前失血性休克的研究主要采用三种基本模型:定容出血模型、定压出血模型和非控制性出血模型[17-20]。 这些模型至少有两个缺点。 首先,广泛的血压波动导致了人们对实验的标准化和重复性的考量;第二,短期严重低血压很难引起组织损伤。 为了引起可靠的组织损伤,平均动脉压(MAP)必须维持在一个较低的水平,并持续较长时间。 大量失血导致心脏供血迅速减少,引发高死亡率。 因此,在目前的模型中,出血发作时间通常太短(少于90 min),无法诱导组织损伤。 例如,Carrillo 等[21]、Capone 等[22]表明,在40 mm Hg 的MAP 下持续60 min 或30 mm Hg 的MAP 下持续45 min 的失血性休克不会对术后存活的大鼠造成细微的功能或组织学脑损伤,而将MAP 控制在30 mm Hg 的水平有可能导致心脏骤停。 此外,低血压发作时间较短的动物模型显然不能很好地模拟某些严重失血性休克患者持续出现的轻微神经行为缺陷的临床表现[23]。 因此,我们开发了一种新型的大鼠失血性休克模型,可以克服这些缺点。
1 材料和方法
1.1 实验动物
SPF 级雄性SD 大鼠30 只,体重250~300 g,8~10 周龄,均购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。 将所有大鼠饲养在温度22℃~25℃和湿度55%~65%的控制室内,光照和黑暗条件12 h 交替循环,适应环境一周,期间可自由饮水和进食。 大鼠无菌手术实验操作与组织取材均在河北医科大学新药安全评价研究中心设施内进行[SYXK(冀)2018-005]。 本研究方案已通过河北农业大学生命科学学院机构动物保护和使用委员会批准(批准号SM20171)。 并按实验动物使用的3R 原则给予人道的关怀。
1.2 主要试剂与仪器
异氟烷、小动物麻醉机(深圳瑞沃德公司);肝素钠注射液(江苏万邦公司);BL-420F 信号采集和分析系统(成都泰盟公司);血气分析仪(ABL80 Flex,丹麦RADIOMETER)。
1.3 实验方法
1.3.1 注射器储血库的连接方法
血液储存装置(注射器储血库)连接方法如图1所示。 10 mL 注射器用作血液储存器,将注射器固定在墙壁上,在外科手术板上方47.58 cm 处有0.0 mL 标记。 注射器血液储存器回路用肝素溶液(12 000 U/mL)冲洗,防止凝血。
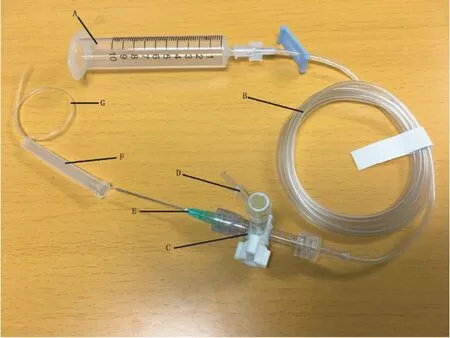
图1 注射器储血库的连接Note. A, Syringe(10 mL). B, Baxter non-DEHP high-flow rate extension set(or 1.5-meter-long PE-190 tubing). C, Three-way stopcock. D, Connector to blood pressure transducer. E, 20-gauge needle. F, 20-gauge needle cap protector. G, 20 cm PE-50 tubing.The total prime volume in the circuit was approximately 2 mL.Figure 1 Connection of the syringe blood reservoir
1.3.2 模型制备
将大鼠麻醉,根据动物失去脚蹬反射(捏脚趾)证实麻醉状态。 在整个休克期间,仔细监测动物,如果有任何醒来的迹象,则加大麻醉气体流量,重复麻醉。 监测大鼠的直肠温度,并在整个实验过程中用手术灯加热保持直肠温度在(37±1)℃。 在无菌条件下,通过局部切口剥离右侧股动脉,将PE-50管插入右侧股动脉。 每只大鼠通过股动脉注射500 U/kg 肝素。 将PE-50 管进一步推进腹主动脉(从腹股沟韧带到管尖端约1 cm 长),从腹主动脉导出血液到注射器血库中来诱导休克,当血压下降到所需水平时记录出血性休克开始时间。 在休克期间,目标MAP 为35 mm Hg。 在失血性休克期间,必须上下移动注射器,使其与目标MAP 对应高度处的血液水平相匹配。 从理论上讲,47.58 cm 高度处的血液水平在地球重力(1 mm Hg ≈1.3595 mm H2O)下产生35 mm Hg 压力。 注射器储血器内的血液作为反馈机制,有助于控制动脉血压恒定,即当大鼠血压升高时,它会自动放血到注射器储液器中,当大鼠血压下降时,它会自动回输血液,以此维持整个休克发作期间的血压稳定。
1.3.3 观察指标
在实验期间连续监测EKG。 将血压传感器连接到三通旋塞以测量血压。 使用BL-420F 信号采集和分析系统获得血压和心率。 记录最大失血量和最终失血量,即在3 h 休克期间注射器储血库中达到的最高血液水平和在失血性休克结束时的血液水平。 使用ABL80 Flex 血气分析仪检测出血前和休克结束后的酸碱度(pH 值)、乳酸(Lac)、氧分压(PaO2)、二氧化碳分压(PaCO2)、血红蛋白(Hct)。病理检测:大鼠处死后,所有大鼠灌流10%福尔马林缓冲液,在室温下收集并固定大脑一周,石蜡包埋切片(4 μm)用苏木精-伊红染色,研究人员用双盲法评估海马神经元的组织病理学变化。
1.3.4 实验分组
2 只大鼠进行假手术处理,仅测量股动脉血压和心率,未引起失血性休克。 将剩余28 只大鼠随机分为4 组(如表1),每组中的大鼠都经历3 h 的失血性休克。 选择这种失血性休克发作时长,是据报道提示短期和不太严重的失血性休克不会引起明显的组织损伤[21-23]。 实验结束时对所有大鼠实施安乐死,在正常体温下腹腔注射200 mg/kg 戊巴比妥钠。
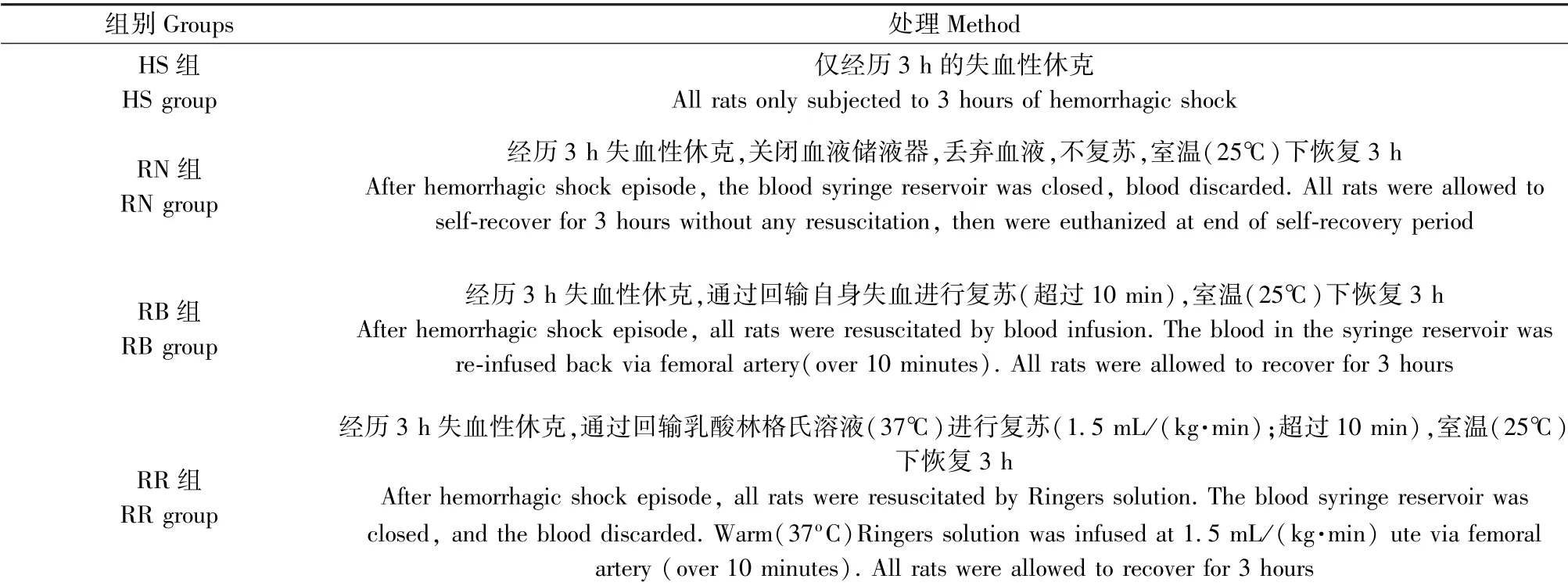
表1 实验分组(n=7)Table 1 Experimental grouping
1.4 统计学方法
采用SPSS 20.0 统计软件。 所有变量均以平均数±标准差(±s)表示。 统计学差异采用单因素方差分析,如若存在差异,则两两比较采用LSD-t检验。 在应用方差分析之前,使用Kolmogorov-Smirnov检验评估数据分布。 结果表明,所有参数数据均为正态分布。 采用Kaplan-Meier 生存分析和log-ran检验分析RN、RB、RR 组的大鼠生存时间。P<0.05被认为具有统计学意义(双尾)。 样本量根据Capone 等[23]的研究中的失血性休克模型和Charan等[24]的动物数量计算方法计算。
2 结果
2.1 存活率
使用注射器储血库建立的大鼠失血性休克动物模型,在3 h 休克结束后所有大鼠均能存活(各组存活率100%)。 复苏期断开注射器血库后,RB 组和RR 组复苏后大鼠均能存活3 h。 然而,在RN 组中,存活率显著降低(约14%,P<0.05),7 只大鼠中有6 只在失血性休克后25、28、45、50、60 和120 min死亡。 大鼠死亡定义为血压低于15 mm Hg、呼吸丧失或心脏骤停。
2.2 血压和心率
两只接受假手术的大鼠,在整个实验过程中,血液MAP 保持在110~125 mm Hg 之间,心率 保 持 在 260 ~ 276 bpm 之 间。 在 休 克 前(Baseline)或休克期间,实验组之间的MAP 和心率没有显著差异。
所有组测得的血压和心率值见表2 和表3。 在血液达到注射器的0.0 mL 标记后5 min 内,MAP 从基线下降到目标血压。 在手术台上方47.58 cm 处保持注射器储血库内的血液水平,HS、RN、RB、RR组的MAP 分别保持在(31.1±2.9)、(34.6±2.1)、(35.3±3.2)、(33.8±1.5)mm Hg(与休克前相比,P<0.05)。 失血性休克还导致各组心率显著降低(与休克前相比,P<0.05)。
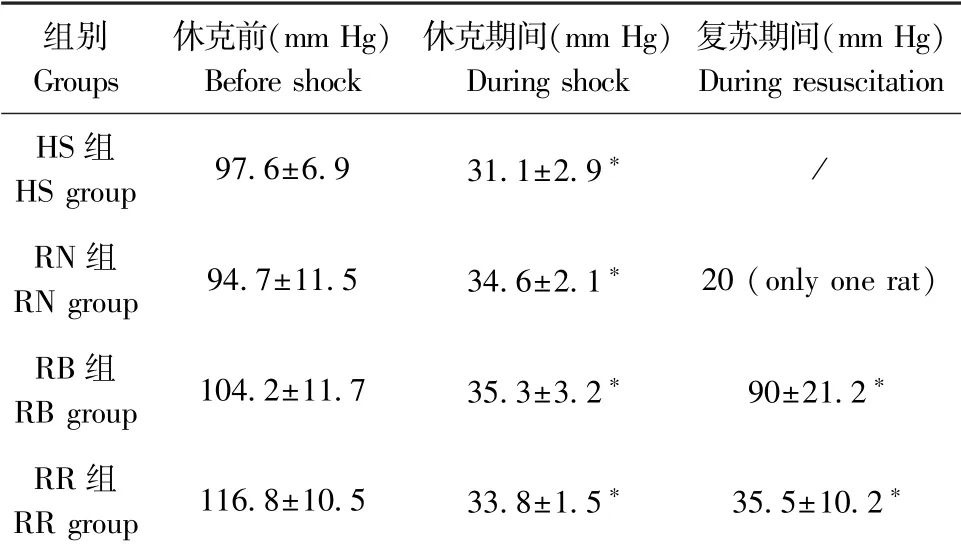
表2 平均动脉压Table 2 Mean arterial blood pressure
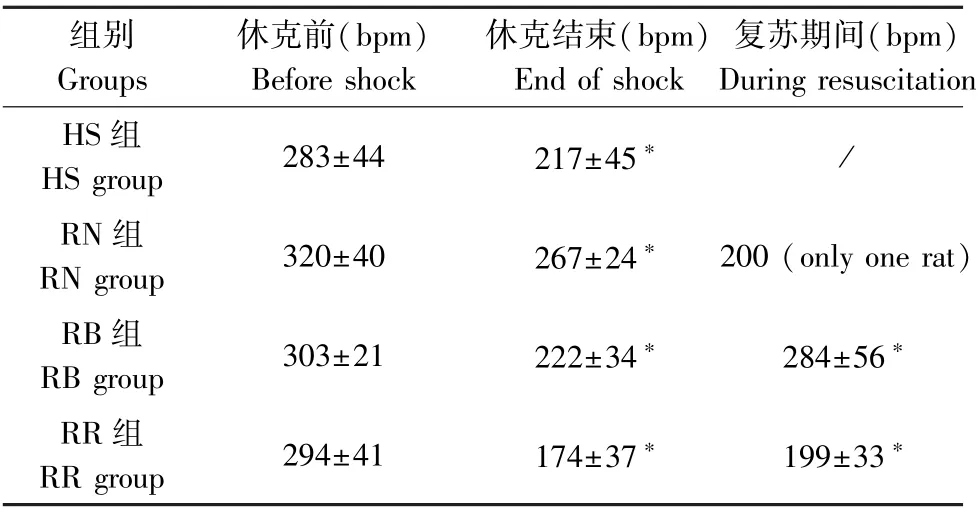
表3 心率值Table 3 Heart rate
在没有复苏的情况下,当注射器储血库的血液通道关闭时,MAP 逐渐下降到0.0 mm Hg,导致7只大鼠中有6 只死亡。 对于一只存活的大鼠,实验结束时MAP 非常低,约20 mm Hg(RN 组)。 在休克结束后,血液再输注复苏使得MAP 显著增加至(90±21.2)mm Hg(RB 组)。 乳酸林格氏液复苏后,实验结束时血压仅为(35.5±10.2)mm Hg。 复苏RB 组MAP 值和心率显著高于RR 组(P<0.05)。
2.3 血气、乳酸和血红蛋白浓度(Hct)
血气、乳酸和Hct 数据见表4。 失血性休克后各组血pH 值和Hct 值均较休克前(Baseline)显著降低(P<0.05),血乳酸值显著升高(P<0.05),而PO2和PCO2均保持在正常范围,与休克前相比无太大变化。
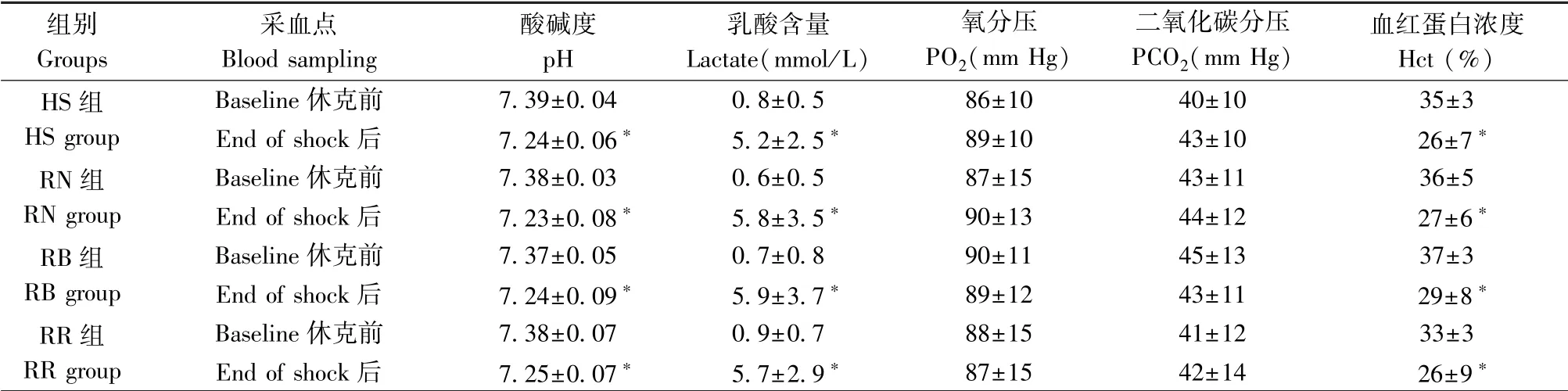
表4 血气和乳酸含量Table 4 Blood gas and lactate
2.4 失血量
体重和失血量数据见表5。 失血性休克后20~30 min 出现最大失血量。 失血性休克期间最大失血量和最终失血量非常相接近。 以注射器中的出血量加上血液回路中的血液量(2 mL)计算失血量。
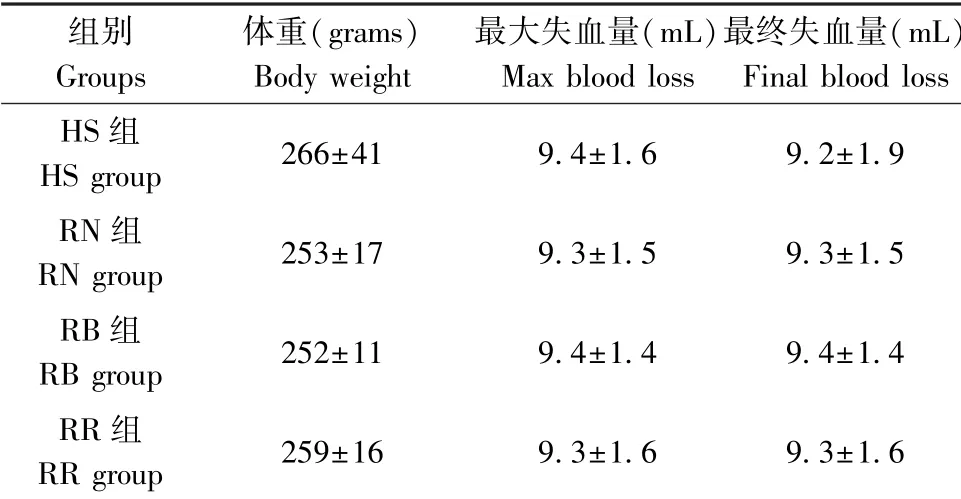
表5 体重和失血量Table 5 Body weight and blood loss
2.5 病理学评价
HE 染色后,光镜观察结果显示,假手术的大鼠海马CA1 区锥体细胞排列规则,结构清楚,细胞层次丰富,神经元膜完整,细胞核形态正常。 失血休克(HS)组海马CA1 区锥体细胞排列较规则,细胞层次减少,部分神经元胞膜破裂,细胞萎缩。 未灌注(RN)组海马CA1 区锥体细胞排列较规则,细胞层次减少,大量神经元胞膜破裂,细胞萎缩。 血液灌注(RB)组海马CA1 区锥体细胞排列较规则,细胞层次减少,全部神经元胞膜破裂,细胞严重萎缩。乳酸林格氏液灌注(RR)组海马CA1 区锥体细胞排列不规则,细胞层次严重减少,全部神经元胞膜破裂,细胞严重萎缩。 (如图2)。

图2 大鼠海马CA1 区苏木精-伊红染色Note. Twenty-eight rats were randomly divided into 4 groups. All groups were subjected to hemorrhagic shock for 3 hours (n=7 in each group). A, Rat that underwent the sham procedure with normal pyramidal cells. B, HS group. C, RN group. D, RB group.E, RR group. HS, Hemorrhagic shock for 3 hours. RN, Recovery by nothing. RB, Resuscitation by blood infusion. RR,Resuscitation by Ringer’s solution. Pyknotic hippocampal pyramidal neurons were shrunken with condensed and deeply stained nuclear chromatin (arrows).Figure 2 HE staining of rat hippocampus samples taken from the CA1 region
3 讨论
Lamson 等[25]和Vivaldi 等[26]在20 世纪40 年代建立了一种能精确控制血压的犬失血性休克模型。 然而,这种有价值的技术在很大程度上被忽视了。 值得注意的是,与使用大型动物相比,啮齿动物的使用具有许多伦理和经济上的优势。 本研究应用这种储血技术来克服模拟失血性休克的啮齿动物模型研究中的技术缺陷:血压波动范围大,并且难以维持长时间的严重失血性休克以诱发可靠的组织损伤。
在传统的休克模型中,给动物放血直到动脉压力达到预定水平,然后在必要时通过反复出血或输液来手动维持压力[27]。 然而,通常很难确定何时以及在多大程度上输注或抽出血液。 手动控制血压会导致显著的血压波动。 因此,传统的“定压”模型并没有真正表现出定压,因为缺乏有效的技术来控制广泛的血压波动。 在定容出血模型中,在不同的实验中,30%~60%的估计血容量被放出,并且低血压的程度没有被正确定义。 大鼠失血量随体重和每只大鼠的Hct 而变化[28]。 在计算休克时间之前,出血时间也因动物而异。 因此,目前的失血性休克模型总是遇到标准化和再现性的问题。 大量失血导致心脏供血迅速减少,导致高死亡率,从而显著地限制了休克的持续时间。 为了在实验中引起可靠的组织损伤,MAP 必须在一定时间内保持在较低的水平。 Stein 等[29]报告称,持续不到20 min 的25~30 mm Hg MAP 不会对大鼠造成危及生命的器官损伤。 Hoppen 等[30]报告,45 mm Hg 的MAP 持续60 min 不会对大鼠造成严重损害。 此外,研究表明,在40 mm Hg 的MAP 下持续60 min 或30 mm Hg 的MAP 下持续45 min 的失血性休克不会导致轻微的功能或组织学脑损伤[21-23]。
通过新设计的注射器储血库装置,能够准确地控制血压而无波动。 在3 h 失血性休克发作期间,MAP 准确地维持在31~35 mm Hg 左右(表2)。 休克发作时,只需监测注射器血库内的血液水平,并上下移动注射器,使血液水平高于大鼠身体(心脏位置)47.58 cm。 理论上,由于重力作用,大鼠身体上方47.58 cm 处的血液水平产生了35 mm Hg 的压力。 根据预先确定的血压自动调节输注或输出。因此,血压波动很小。 从技术上讲,可能会出现轻微的血压波动,但只有在延迟移动注射器以使储液器内的血液水平较长时间保持高于大鼠身体上方47.58 cm 时才会发生。 恒定的MAP 保证了基本的心脏供血,失血性休克期可轻松维持3 h,PO2和PCO2保持也在正常范围内(表4)。 鉴于血液再输注后MAP 恢复到(90±21.2)mm Hg(RB 组,表2),因此认为在该模型中心肺功能相对保持或有恢复的潜力。 很可能我们的注射器血库抵消了血压下降,从而阻止了冠状动脉血流的显著减少。 在整个3 h 的休克过程中,最大失血量和最终失血量非常接近,大约在9.2~9.4 mL 之间。 大鼠血流量约为50~70 mL/Kg[30]。 对于体重约250 g 的大鼠,该模型中的失血量至少相当于循环血流量的60%。 因此,该模型不仅是定压模型,而且是定容模型。 经过如此长时间的严重失血性休克后,能够在所有的实验组中发现明显的脑损伤。 海马组织对缺血缺氧比较敏感,其损伤时的特征是大量的神经元固缩,如图2 所示。 失血性休克3 h 导致该模型严重乳酸酸中毒(表4,显著降低血pH 值和乳酸升高)。7 只未复苏的大鼠中有6 只在3 h 失血性休克发作后120 min 内死亡(RN 组),但所有失血后经过液体复苏的大鼠在整个实验期间均可存活(RB 组和RR组)。 这意味着尽管有严重的出血,这个模型依然是可以救治的。
总之,利用注射器血库建立的高重复性失血性休克模型可以成为研究失血性休克的病理生理变化、器官、组织损伤和治疗效果的非常有用的工具。

