基于网络药理学策略分析青蒿应用于新型冠状病毒感染肺炎的可行性
杜伟,占敏霞,吴思澜,张莉
重庆市中药研究院,重庆 400065
新型冠状病毒感染肺炎(Corona Virus Disease 2019,COVID-19),以下简称新冠肺炎.新型冠状病毒(SARS-CoV-2)从首次被鉴别出至今已逾1年,因其具有较高的传染性,持续对我国及全世界人民的生活产生不利影响.新冠肺炎患者初期以发热、干咳、乏力为主要症状,部分患者可伴有纳差、腹泻等消化道症状或恶寒、肌痛,少数可能无发热症状;随病情进一步发展,中期及重症期可出现口咽舌干、胸闷、呼吸困难、多脏器功能衰竭等表现[1-2].从既往的病毒感染治疗策略来讲,直接的病毒抑制是有效的方法之一,遗憾的是目前尚无针对新型冠状病毒的特效抑制药[3].从抗击疫情的临床实践来讲,中药的应用发挥着重要积极的作用[3].
应用中药,关键在于以中医药理论为支撑.新型冠状病毒是新冠肺炎的致病因子,热是新冠肺炎的重要病机之一[4].针对病机的辨证施治是现阶段中医药治疗新冠肺炎的主要手段,即统筹兼顾清热的治法是一种重要的手段.青蒿(菊科植物黄花蒿的干燥地上部分ArtemisiaannuaL.),为常用寒性清热中药,具有清虚热、除骨蒸、解暑热、截疟、退黄的功效,临床应用无毒性发生.推测青蒿具有应用于新冠肺炎的可行性.通过文献分析,青蒿成分较多,存在多靶点的可能,故引入网络药理学方法进行快速分析[5],以便促进新冠肺炎的更好防控.
1 材料与方法
1.1 数据库与软件
中药系统药理学数据库与分析平台(TCMSP),人类基因组注释数据库(GeneCards),有机小分子生物活性数据库(Pubchem),蛋白相互作用数据库STRING 11.0,UniProt数据库,Cytoscape 3.6.1软件,Omicshare云平台.
1.2 青蒿的活性成分及靶点获取
采用TCMSP数据库,在“Herb name”项下,以“青蒿”为检索词,获取青蒿已知的化学成分,筛选出具有良好口服生物利用度(OB≥30%)和类药性(DL≥0.18)的化合物[5].根据筛选出的化合物,采用TCMSP数据库和Pubchem数据库进行靶点预测.将靶点预测结果导入UniProt数据库进行基因的标准化处理,并导入STRING 11.0映射为人的基因.
1.3 新冠肺炎相关靶点获取
以“Corona Virus Disease 2019”为检索词,在GeneCards数据库中获取新冠肺炎的相关靶点,筛选得分为10.00以上的靶点,得到目前治疗新冠肺炎的相关靶点.
1.4 青蒿—活性成分—疾病靶点网络的构建与分析
将1.2得到的青蒿活性成分及靶点与新冠肺炎相关靶点于Omicshare云平台取交集,所得交集靶点即为青蒿作用于新冠肺炎的预测靶点.构建“药物—活性成分—疾病—靶点”网络图,利用Cytoscape 3.6.1软件中的“Network Analyzer”功能对青蒿化学成分—作用靶点网络进行分析.节点(node)代表青蒿及其活性成分、疾病、靶点;边(edge)展现青蒿与活性成分、活性成分与疾病、疾病与靶点之间的联系.
1.5 PPI网络的构建及关键靶点筛选
为进一步研究青蒿干预新冠肺炎的作用机制,将1.4交集得到的靶点导入STRING 11.0进行蛋白质与蛋白质相互作用(PPI)分析,将种属设置为“Homo sapiens”,最低相互作用评分设置为0.400,网络边含义设置为“molecular action”,其余参数保持默认设置,得到青蒿作用于新冠肺炎的PPI网络.借助Cytoscape 3.6.1软件中的“Network Analyzer”功能对PPI网络进行拓扑分析,选取自由度(Degree)大于平均值的靶点为关键靶点[6].
1.6 GO功能分析和KEGG通路富集分析
将1.5筛选出的关键靶点运用STRING 11.0 “Analysis”功能,进行基因功能(gene ontology,GO)分析和基于京都基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析[7].
2 结 果
2.1 青蒿活性成分及靶点的筛选结果
在TCMSP中获得216个化合物,设定OB≥30%,DL≥0.18,得到化合物22个,逐一对应发现3个化合物无对应靶点,分别是青蒿烯(artemisitene)、维采宁-2(vicenin-2_qt)、双氢青蒿素(dihydroartemisinin).采用Pubchem数据库对TCMSP未预测出靶点的3个化合物进行预测,仍未获得靶点信息,故青蒿活性成分为19个(表1),对应182个靶点.

表1 青蒿活性成分信息表
2.2 新冠肺炎靶点获取结果
从GeneCards数据库中检索到新冠肺炎相关靶点60个,设定分值(S≥10.00)后,得到41个靶点.
2.3 青蒿—活性成分—疾病靶点网络的构建与分析
将182个化合物靶点与41个新冠肺炎靶点取交集,得到13个交集基因(图1),对应青蒿中14个化合物.利用Cytoscape 3.6.1软件构建青蒿—活性成分—疾病靶点相互作用网络,网络中有29个节点和114条边(图2).图2中绿色填充为青蒿,紫色填充为活性成分,红色填充为靶点,黄色填充为新冠肺炎.图中槲皮素、木犀草素、山奈酚等黄酮类化合物度值较高,靶点为NOS2的化合物有12个,分别为泽兰黄醇素、柽柳黄素、藤菊黄素、茵陈黄酮、艾黄素、蓟黄素、线蓟素、牡荆苷、甲氧基万寿菊素、芹菜素-6,8-C-二葡萄糖苷、异鼠李素和山奈酚.

图1 青蒿化合物靶点与新冠肺炎靶点取交集结果

图2 青蒿干预新冠肺炎“药物—活性成分—疾病靶点”网络图
2.4 PPI网络的构建及关键靶点筛选结果
将13个交集基因通过STRING 11.0进行PPI网络分析(图3),可知网络所有靶点均可以发生蛋白相互作用,128条边代表了蛋白之间的相互作用.网络中各节点的平均自由度为9.8,筛选后得到7个核心靶点(IL6,TNF,CCL2,IL1B,NOS2,TP53,CASP3),见表2.

表2 PPI网络中核心靶点一览表
2.5 GO功能分析结果
7个青蒿—新冠肺炎核心基因影响了266个生物学过程(p<0.01,FDR<0.01).选取FDR值排名前20的功能信息(图4),结果显示核心基因主要富集在细胞对生物刺激的反应、细胞因子介导的信号通路、对脂多糖的反应、对生物刺激的反应等生物过程中.
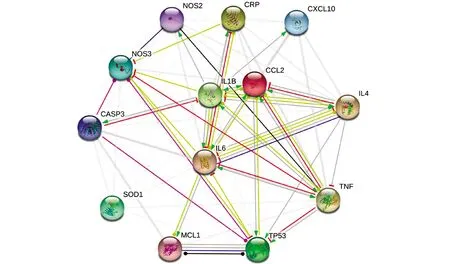
图3 药物—疾病PPI网络图
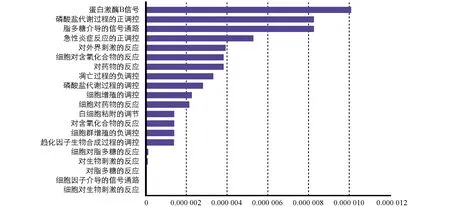
图4 青蒿干预新冠肺炎关键靶点GO富集分析柱状图
2.6 KEGG通路富集分析结果
7个青蒿—新冠肺炎核心基因富集在59条通路上(p<0.01,FDR<0.01),选取FDR值排名前20的通路(图5),其中与抗病毒密切相关的通路包括NOD样受体信号通路、肿瘤坏死因子(TNF)信号通路.
3 讨论与结论
新冠肺炎是新发的传染性疾病,对居民日常起居、睡眠和生活习惯均产生了不利影响[8],甚至危及生命.本文运用网络药理学的方法,系统分析青蒿干预新冠肺炎的机理.首先通过查询数据库获取青蒿中的活性成分以及靶点信息,将获取的靶点信息与疾病的靶点信息取交集后构建“药物—成分—疾病”靶点网络图,从而识别核心靶点干预的基本生物学功能和疾病信号转导通路,进而揭示青蒿对新冠肺炎作用的可能机制[9].

图5 青蒿干预新冠肺炎关键靶点参与通路富集信息图
通过对TCMSP数据库及Pubchem数据库的查询、分析得出,青蒿干预新冠肺炎的活性成分有14个,其中12个活性成分均可作用于NOS2.活性成分中度值较高的黄酮类化合物已有研究报道,槲皮素、山奈酚、木犀草素与新冠肺炎推荐药的亲和力相似[10-11].槲皮素、山奈酚、木犀草素均为常见的中药化学成分,对它们的研究较早、较多,具有抗炎、抗氧化应激等作用[12-13].对新冠肺炎逝者解剖结果显示,巨噬细胞渗出性炎症是重要的病理表现[14],表明槲皮素、山奈酚、木犀草素是干预新冠肺炎发病过程的有效成分,而靶点为NOS2的其他活性成分也是关注的重点.
NOS2是本研究的核心靶点之一,其在免疫、炎症、肿瘤、病毒感染等方面均能发挥作用[15].在流感病毒致死的基因组研究中,NOS2与存活率相关,其证据是患者死亡前24h内NOS2表达异常上调[16].针对巨病毒的研究亦认为,NOS2的缺乏是致死的重要原因[17].此外,缺氧可诱导NOS2高表达[18].新冠肺炎解剖提示肺通气—换气功能障碍[14],表明NOS2与新冠肺炎密切相关.
TNF/NOS2是巨噬细胞在感染后启动固有免疫防御的重要信号通路[19].感染可激活固有免疫细胞,固有免疫分子发挥固有免疫防御是免疫学的共识.新型冠状病毒感染激活的主要是巨噬细胞,巨噬细胞分泌TNF以抑制病毒复制,TNF的过表达促进TNF/NOS2信号通路启动,导致IL-6,IL1B等炎症因子过表达,IL过表达会加重炎症[20],新冠肺炎临床研究也证实了这一点[21].核心靶点的GO功能富集分析印证了青蒿通过信号转导等生物过程干预新冠肺炎.通过对KEGG通路分析,青蒿可作用于TNF/NOS2信号通路的多个靶点,认为青蒿可能通过TNF/NOS2信号通路减轻新冠肺炎的肺部炎性损伤.
综上所述,本文采用网络药理学的策略对青蒿中的活性成分、作用靶点及通路进行了快速分析,表明青蒿应用于新冠肺炎具有一定的可行性,揭示青蒿通过多成分、多靶点、多途径作用于新冠肺炎,主要的作用通路为TNF/NOS2信号通路.

