非变性牦牛骨胶原蛋白的提取与表征
么林妍,凌碧扬,刘晓乐,刘茵,肖建喜*
(1.兰州大学化学化工学院,甘肃 兰州 730000;2.甘肃省化工研究院有限责任公司,甘肃 兰州 730000;3.甘肃创翼检测科技有限公司,甘肃 兰州 730000)
引言
胶原蛋白是哺乳动物中含量最丰富的蛋白质,约占蛋白质总质量的30%[1-2]。作为主要的结构蛋白,胶原蛋白存在于所有的结缔组织中,可以为组织和器官提供机械强度[3-5]。胶原蛋白具有高度生物活性,参与大量细胞外基质的相互作用[6]。它具有合成高分子材料无可比拟的生物相容性、生物可降解性等优良性质,在医药、化妆品、食品等领域广泛应用[7-10]。
不同于球形蛋白,胶原蛋白具有特征性的三股螺旋结构,该特殊结构在胶原蛋白与其它生物大分子的相互作用中扮演关键角色,直接影响胶原蛋白的降解、细胞黏附等性质[2,11]。胶原蛋白在酸、碱、酶或高温作用下,其三股螺旋结构完全或部分解旋成无规则卷曲的多肽链,形成明胶[12]。胶原蛋白的三股螺旋结构被完全破坏,并降解成相对分子质量从几千到几万成分复杂的胶原肽混合物[13]。明胶和胶原肽因为缺乏天然胶原蛋白的三股螺旋结构,使它们不再具备生物学功能,如细胞粘附、细胞增殖等,极大地限制了它们在医用材料中的应用。
目前市场上的胶原蛋白主要来自动物组织提取,主要包括碱法、酸法和酶法等[14]。碱法利用氢氧化钙、氢氧化钠等碱性试剂在特定的外界环境条件下提取胶原蛋白,容易造成胶原肽键水解,破坏胶原蛋白的三股螺旋结构[15,16]。酸法利用酸性试剂(盐酸、乙酸等)破坏胶原蛋白分子间的盐键和席夫碱键以及不同蛋白质分子之间的氨键,使得胶原蛋白膨胀、溶解,该方法可能会破坏色氨酸、丝氨酸和酪氨酸[17,18]。酶法的条件一般更加温和,它利用蛋白酶(胃蛋白酶、胰蛋白酶等)对胶原蛋白进行酶解,破坏共价键,得到可溶的胶原蛋白[19,20]。虽然酶法已经被广泛用于提取胶原蛋白,但是过度的酶切仍然会部分破坏三股螺旋结构[21]。
三股螺旋结构作为胶原蛋白的重要质量指标,其检测主要依赖于圆二色谱(CD)[22]和超灵敏差示扫描量热仪(VP-DSC)[23]。这些方法可迅速评价胶原蛋白是否整体具有三股螺旋结构,然而,胶原蛋白存在部分位点三股螺旋结构被破坏、变性的情况却较难检测[24,25]。胶原蛋白的局部变性可能严重影响其生物功能[26],因此,亟需开发高特异性检测变性胶原蛋白的方法。最近的研究发现,具有重复Gly-Pro-Hyp序列等特殊序列的荧光多肽探针[27],可以高灵敏、特异性地识别癌症[28]、关节炎[29]和纤维化[30]等病理组织中的变性胶原蛋白。
牦牛是高寒地区特有的半野生牛种,也是世界上生活在海拔最高处的哺乳动物。全球90%以上的牦牛生活在青藏高原,是我国西部独有的珍贵资源[31,32]。我们开发了温和的生物工艺,从牦牛骨中提取制备了高品质的牦牛骨胶原蛋白(YO)。我们利用高特异性的荧光多肽探针和酶切方法,高灵敏地检测胶原蛋白是否变性。我们成功制备非变性的YO,它保持完整的三股螺旋结构。该YO表现出良好的生物功能,显著促进了成纤维细胞的黏附和增殖,可以满足医疗健康对高品质胶原蛋白的需求。
1 实验部分
1.1 主要材料与仪器
牦牛骨购自甘肃省天祝县;胃蛋白酶(1∶3000)购自上海阿拉丁生化科技股份有限公司;蛋白分子量Marker(10~245 kDa)购自南通飞宇生物科技有限公司;氨苄西林(Amp),异丙基-β-D-硫代半乳糖苷(IPTG),苯甲基磺酰氟(PMSF)购自索莱宝生物科技有限公司;四甲基乙二胺(TEMED)购自南京化学试剂股份有限公司;亚氨基二乙酸购自上海迈瑞尔化学技术有限公司;丙烯酰胺,过硫酸铵,甲叉双丙烯酰胺均购自上海国药集团化学试剂有限公司;十二烷基磺酸钠(SDS)购自Sigma;三羟甲基氨基甲烷(Tris),甘氨酸购自北京博奥拓达科技有限公司;琼脂糖凝胶4B(Sepharose 4B)购自北京博润莱特科技有限公司;其他试剂均为国产分析纯试剂。
电热鼓风干燥箱(上海一恒科学仪器有限公司,DHG-9030),电泳仪电源(北京市六一仪器厂,DYY-6C型),冷冻干燥(宁波新芝生物科技股份有限公司,SCIENTZ-12N),台式高速冷冻离心机(湘仪离心机仪器有限公司,H2050R),紫外分光光度计(日本岛津公司,μV-1750),圆二色谱仪(英国应用光物理公司,Chirascan),透射电子显微镜(JEOL公司,JEM-2100),酶标仪(瑞士TECAN公司,Infinite M200),电感耦合等离子体质谱仪(美国热电公司,iCAPQc)
1.2 实验方法
1.2.1 YO的提取
首先用刀将骨头上的肉割掉,去掉骨髓,洗净牦牛骨,然后置于25℃烘箱中干燥12 h,得到牦牛骨粉;用10%正丁醇将粉碎后的牦牛骨粉进行脱脂,脱脂结束,离心取沉淀,水洗至中性;将前步中得到的沉淀用0.5 M盐酸进行脱钙,脱钙结束,离心取沉淀,水洗至中性;将前步中得到的沉淀浸泡于0.1 mol/L的氢氧化钠进行除杂,除杂结束,离心取沉淀,水洗至中性;用含1 g/L胃蛋白酶的0.5 mol/L乙酸溶液提取胶原蛋白,得到粗的胶原蛋白提取液;调pH至中性,进行酶灭活;8~14 kDa透析袋透析;透析结束后,冷冻干燥,得到牦牛骨胶原蛋白。
1.2.2 YO的聚丙烯酰胺凝胶电泳表征
a.100 mL 30%丙烯酰胺储存液的制备:称取29.2 g丙烯酰胺和0.8 g甲叉双丙烯酰胺置于烧杯中,加入少量蒸馏水于通风橱中搅拌至完全溶解,然后把溶液倒入100 mL容量瓶定容,将制备好的溶液转入棕色瓶中,4℃条件避光保存。
b.100 mL SDS-分离胶缓冲液的配置(pH 8.8~8.9):称取18.2 g Tris和0.4 g SDS加入24 mL 1 mol/L的HCl中,完全溶解后加蒸馏水定容至100 mL。
c.100 mL SDS-浓缩胶缓冲液的配置(pH 6.8):称取6 g Tris和0.4 g SDS加入到48 mL 1 mol/L HCl中,完全溶解后加蒸馏水定容至100 mL。
1.2.3 YO的圆二色谱测试
YO样品的圆二色谱实验利用配备有Peltier温度控制器的Chirascan圆二色谱仪(Applied Photophysics,UK)进行检测。在pH 7.0,10 mmol/L磷酸盐缓冲液(PBS)条件下,制备浓度为2 mg/mL的YO样品。YO样品,4℃下的波长扫描范围为210~260 nm,每步间隔为1 nm,平均时间为5 s,每个样品重复扫描三次。通过测量YO样品在225 nm处的峰强度(从4℃升至50℃时,升温平均速率为1℃/min),确定YO样品的热稳定性。通过拟合YO三聚体到单体过程中的热变曲线,并对其进行一阶求导,极值的位置对应YO的热变温度(Tm)。
1.2.4 YO的酶解实验
通过SDS-PAGE,对YO的酶切实验进行表征。将所提取YO在85℃加热20 min得到完全变性的胶原蛋白。选择的YO和变性的YO,浓度都为3 mg/mL,按体积比1∶1加入3 mg/mL的胃蛋白酶,15℃对样品进行酶切实验,选取不同酶切时间(5 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h)的样品,进行SDS-PAGE表征。
1.2.5 荧光多肽探针对变性胶原蛋白的靶向结合实验
我们利用特异性结合变性胶原蛋白的荧光多肽探针FAM-(GPO)8来检测牦牛胶原蛋白的变性程度。YO溶解于0.5 mol/L乙酸中,配置浓度为100 μg/mL的胶原蛋白溶液。将胶原蛋白溶液于30、40、50和60℃水浴加热20 min,制备不同变性程度的牦牛骨胶原蛋白溶液。将胶原蛋白溶液于80℃水浴加热20 min,制备得到完全变性的牦牛骨胶原蛋白(D-collagen)。非变性和变性胶原蛋白溶液在10 mmol/L PBS(pH 7.4)中稀释至2μg/mL。将50μL上述蛋白溶液加入黑色96孔板中,4℃下孵育过夜。室温下,使用10 mmol/L磷酸盐缓冲液洗涤孔板五次,除去未结合的蛋白。在10 mmol/L PBS(pH 7.4)中配制5μmol/L FAM-(GPO)8多肽探针溶液,将50 μL FAM-(GPO)8多肽探针溶液加入孔板,4℃下孵育5 h。结合结束后,室温下使用10 mM PBS洗涤孔板五次,除去未结合的多肽探针。待孔板风干后,用Tecan Infinite F200/M200多功能酶标仪(Tecan,Männedorf,Switzerland)上测定读数,激发波长为497 nm,发射波长为530 nm,每组实验重复三组。
1.2.6 YO的细胞实验
1.2.6 .1 YO的细胞黏附实验
24孔板(组织未处理)分别用牛血清白蛋白(BSA)和非变性YO包被。加入成纤维细胞(HFF-1细胞)之前,用10 mmol/L PBS缓冲液(pH 7.2~7.4)洗涤24孔板三次。然后将HFF-1细胞悬液(细胞密度为1200个细胞/mm2)加到孔板中,并在37℃下孵育12 h。将粘附的HFF-1细胞用4.0%甲醛溶液固定10 min,用0.1%Triton X-100溶液通透HFF-1细胞5 min,并在室温下加入含有1%BSA的PBS缓冲液(10 mmol/L,pH 7.2~7.4)封闭0.5 h。将固定的HFF-1细胞与鬼笔环肽-四甲基罗丹明异硫氰酸酯(索莱宝,中国)10 mmol/L PBS(pH 7.2~7.4)避光共孵育1 h,然后加入Hoechst 33258(Sigma-Aldrich)(1 mL,5μg/mL在超纯水)在37℃下孵育10 min,分别染色细胞肌动蛋白和细胞核。成像的结果利用徕卡(Leica Microsystems Inc.,Wetzlar,Germany)荧光显微镜获得。
1.2.6 .2 YO的细胞增殖实验
HFF-1细胞(含有15%胎牛血清和1%双抗的DMEM培养基)在含有5%CO2的恒温培养箱(温度设定37℃)中培养。将体积为100μL的HFF-1细胞悬浮液(每孔5×103个细胞的密度),分别接种于三块96微孔板中,三块板分别命名为A,B,C,孵育24 h(37℃,5%CO2)以保证完全贴壁。然后在三块96微孔板中分别加入100μL质量浓度为0.1 mg/mL的非变性牦牛骨胶原DMEM稀释液,浓度为0.1 mg/mL的变性牦牛骨胶原DMEM稀释液,对照孔中加入100μL DMEM培养基,在37℃继续温育。1天后,取出A板,然后向各孔中加入100 uL 10%的Cell counting Kit-8(cck-8),置于细胞培养箱中培养,用Tecan Infinite F200/M200多功能酶标仪(Tecan,Männedorf,Switzerland)测量其在450 nm处的光密度(OD)值,摸索合适时间,当只有细胞不含材料的孔OD值达到1左右时,记录所需时间,停止培养。2天后,取出B板,采取同A板相同的操作,加cck-8后,培养时间同A板保持一致。4天后,取出C板,采取同A板相同的操作,加cck-8后,培养时间同A板保持一致。比较三块板的OD值,进行细胞增殖研究。HFF-1细胞的活性计算为每种条件三次测量的平均吸收值。
2 结果与讨论
2.1 YO的SDS-PAGE结果
对提取后的YO聚丙烯酰氨凝胶电泳分析如图1所示。在高于245 kDa处有β11,β12两条带,在约140 kDa处有α1,α2两条电泳条带,在小于100 kDa处没有其它条带,表明所提取的YO未发生降解。

图1 YO的SDS-PAGE图Fig.1 SDS-PAGE photos of YO collagen
2.2 YO的圆二色谱结果
天然胶原蛋白不能形成α螺旋或β折叠结构,目前已发现的29种胶原蛋白都呈现共同的结构元素,即三股螺旋结构[33]。它是由三条具有Polyproline II螺旋结构的肽链(简称α链),相互缠绕成绳状而形成的右手超螺旋结构[34]。通过圆二色谱对牦牛骨胶原蛋白的二级结构进行表征,结果如图2所示。YO在225 nm处具有正峰,在205 nm处具有负峰,该谱图符合胶原蛋白的特征性三股螺旋结构。热变实验表明,YO的解旋温度为37℃,与人的体温相似。圆二色谱结果表明,制备得到的YO整体上保留了胶原蛋白的三股螺旋结构。
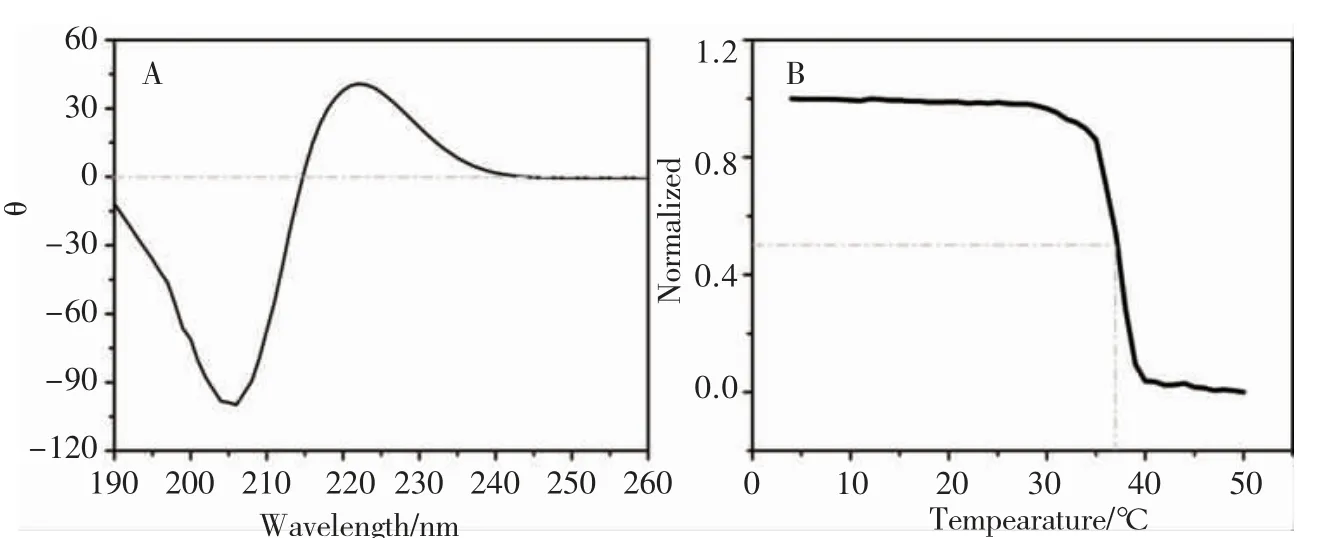
图2 YO的圆二色谱表征(A)CD全谱;(B)热变曲线Fig.2 CD spectra of YO(A)CD spectrum;(B)CD thermal unfolding
2.3 胃蛋白酶不能降解非变性YO
研究表明,具有三股螺旋结构的胶原蛋白可以抵抗胃蛋白酶等蛋白酶的酶解,而变性的胶原蛋白因为丧失三股螺旋结构的保护,而非常容易被蛋白酶降解为不同分子量的片段[35-37,24]。我们利用胃蛋白酶的酶切实验来检测提取的YO是否变性。我们将提取的牦牛骨胶原蛋白在85℃加热20 min制备得到完全变性的YO。YO和变性YO溶液样品在不同酶切时间下的SDS-PAGE实验结果,如图3所示。
酶切实验表明,提取的YO不同酶切时间下的电泳条带基本只有I型胶原蛋白的特征条带,表明YO保持三股螺旋结构,可以有效抵抗胃蛋白酶的降解(图3A)。相反,对于变性的YO,经过不同时间的酶切,出现大量降解片段的电泳条带,表明变性胶原蛋白丧失三股螺旋结构,因此被胃蛋白酶显著降解(图3B)。这些实验结果表明,我们所制备的YO为非变性胶原蛋白。

图3 YO的酶切实验A:非变性YO不同酶切时间的SDS-PAGE,从左到右依次为:5 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h,marker;B:变性YO不同酶切时间的SDS-PAGE,从左到右依次为:5 min、30 min、1 h、2 h、marker、3 h、6 h、12 h、24 hFig.3 Protease digestion of YO(A)SDS-PAGE of non-denatured YO with different digestion times,from left to right:5 min,30 min,1 h,2 h,3 h,6 h,12 h,24 h,marker;(B)Denatured yak bone SDS-PAGE of different digestion times of collagen,from left to right:5 min,30 min,1 h,2 h,marker,3 h,6 h,12 h,24 h
2.4 荧光多肽探针靶向结合变性YO
最新研究表明,荧光多肽探针FAM-(GPO)8可以高特异性识别变性胶原蛋白,而完全不结合三股螺旋结构完整的胶原蛋白[38]。我们利用该荧光多肽探针来检测YO的变性程度。我们通过靶向探针FAM-(GPO)8对不同热变性程度的胶原进行染色实验,实验结果如图4所示。图4A的结果表明,该靶向探针对提取的YO完全没有结合能力,而对完全变性的YO表现出极强的结合能力。图4B的结果表明,不同温度对YO具有不同程度的变性能力,随着温度的逐渐升高,靶向探针结合能力逐渐增强。实验结果表明,我们所制备的YO没有发生变性。

图4 变性胶原蛋白的靶向结合实验A:提取的YO和完全变性的YO的结合能力;B:不同温度处理的YO的结合能力Fig.4 The binding experiment of denatured collagenA:The binding ability of collagen and completely denatured collagen;B:The binding ability of collagen after heating at different temperatures
2.5 非变性YO促进细胞黏附
通过荧光显微镜观察成纤维细胞的粘附和伸展性质(图5)。用鬼笔环肽-四甲基罗丹明异硫氰酸盐和Hoechst 33258核染料分别对肌动蛋白应激纤维和细胞核染色。荧光显微镜图像表明,附着在BSA涂层上的人成纤维细胞(HFF-1)保持球形,其细胞骨架结构发育不佳(图5A)。相反地,附着在YO涂层上的HFF-1细胞具有发达的肌动蛋白细胞骨架结构(图5B-C)。广泛的细胞粘附和扩散表明,YO具有优良的生物活性。

图5 不同材料表面成纤维细胞的粘附:(A)BSA;(B)与(C)YOFig.5 Adhesion to fibroblasts on the surface of different materials:(A)BSA;(B)(C)YO
2.6 非变性YO促进细胞增殖
YO对成纤维细胞的增殖能力实验结果如图6所示。空白为未铺材料的空板,以空白板细胞的活力为100%对照。结果表明,YO在第一天就显著促进了细胞增殖,增殖率达到126%。第2天和第4天在未新加培养液的基础上,细胞依然保持高活力,表明制备的YO可促进成纤维细胞增殖。
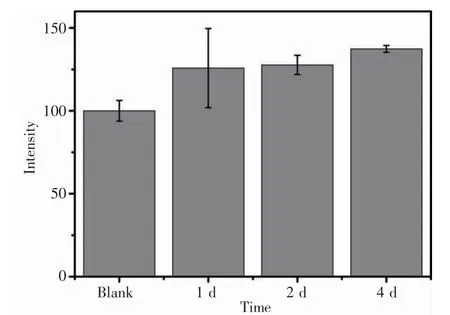
图6 YO促进成纤维细胞的增殖Fig.6 YO promotes fibroblast cell proliferation
3 结论
本文中,我们基于西北特有的牦牛资源,制备得到了YO。同时,我们采用了一系列的方法,系统地评估了我们所提取的YO的品质。
SDS-PAGE实验表明,提取得到的YO具有I型胶原蛋白的特征性条带,并且没有发生降解。CD结果表明,YO整体上保持三股螺旋结构,热变温度为37℃。进一步的酶切实验表明,提取的YO可以有效抵抗胃蛋白酶的降解,说明YO没有发生变性,它保持完整的三股螺旋结构。特别突出的是,我们建立变性胶原蛋白的靶向结合实验,利用高特异性的荧光多肽探针来检测YO的变性程度。该靶向探针对提取的YO完全没有结合能力,而对完全变性的YO表现出极强的结合能力,可用于检测表征不同变性程度的YO。细胞实验表明,YO对成纤维细胞有良好的粘附能力,并且可以显著促进成纤维细胞的增殖。我们成功制备未变性的YO,它具有完整的三股螺旋结构和良好的生物功能,可用于生物医用材料领域。

