生物渗透反应墙效能及微生物生态评估
贺安琪,马宏瑞*,姜勤勤,朱超,杨永林
(1.陕西科技大学环境科学与工程学院,陕西 西安 710021;2.安徽银河皮革有限公司,安徽 界首 236500;3.榆林学院化学与化工学院,陕西 榆林 719000)
引言
垃圾渗滤液是一种高浓度有机废水,水质及水量波动性大,COD、BOD、可生化性随填埋时间的增长而下降并逐渐维持较低水平[1],产生量受多种因素如降水量、蒸发量、地面流失等的影响[2],其中不仅含有致癌物,还含有多种有机污染物、重金属、高氨氮等[3]。目前国内外垃圾渗滤液中已查明包含200余种有机污染物,其中数十种危害人类健康和环境,进入地下水的污染物更是有上千种,污染物在地下迁移扩散,对人类的健康产生极大的威胁[4]。目前垃圾渗滤液的处理方法较多,B.G.Reis等人[5]研究了好氧膜生物反应器与纳滤(MBR-NF)的集成以及混合芬顿-微滤工艺(FMF-NF);Minimol Pieus Thanikkal等人[6]采用高级氧化法(AOP)和生物法相结合处理;Li Xiang等人[7]构建了反硝化(DN)-部分硝化(PN)-厌氧氨氧化(Anammox)系统,探讨了非控温条件下季节温度变化对垃圾渗滤液脱氮的影响。
近年来生物反应墙技术因其具有修复绿色、费用节省、长期运行、对低浓度污染可有效去除等优点受到重视。生物反应墙是PRB与强化生物修复方法的结合技术。其中PRB是填充有活性反应介质材料的被动反应区,污染物质通过渗透性反应墙时被降解或固定[8],介质可对溶解的有机物、金属、核素及其他污染物进行降解、吸附、沉淀或去除[9]。地下水环境的低温(12~14℃)、寡营养和污染物的毒性、复杂性,使得实际修复中往往需要向生物反应墙内导入具有特殊新陈代谢能力的微生物,通过微生物对污染物的降解和代谢达到净化含水层的目的[10]。营养物质[11]、电子受体[12]以及环境等因素均会影响修复过程中外源微生物种群和功能多样性的变化,进而影响生物修复效果[13]。因此,研究生物反应墙内微生物的数量及代谢功能多样性变化,对于检验外源微生物的功能稳定性以及生物反应墙构建的成败具有重要意义[14]。
垃圾渗滤液COD 8000~15 000 mg/L,氨氮浓度通常在1000 mg/L以上,含盐量一般高达10 000 mg/L以上[15,16],而制革废水作为复杂高负荷工业废水典型代表,含有大量的氯离子、胶原蛋白、脂质和表面活性剂等[17],CODCr约1000~2000 mg/L,氨氮浓度在100 mg/L以内,含盐量通常在2000 mg/L以内,同垃圾渗滤液相似属于高盐高有机物废水,但毒性和处理难度不及垃圾渗滤液。故渗透反应墙技术应适用于制革废水的处理或污染防控,同时渗透反应墙对重金属如铬的修复具有一定作用,湖南长沙原铬盐厂工程案例证明PRB可使重金属铬由50 mg/L降至0 mg/L[18],王兴润[19]等人研究表明包覆型零价铁材料作为PRB反应介质可有效治理铬渣堆放导致的铬污染。
本研究通过模拟生物反应墙的设计构建和运行,评估其出水COD,生物毒性,抗氧化性以及运行期间生物反应墙中功能微生物数量、代谢指纹图谱及群落多样性变化。对于处理与垃圾渗滤液类似的制革废水具有一定借鉴意义和价值。
1 材料与方法
1.1 材料
(1)供试垃圾渗滤液取自江村沟垃圾渗滤液处理厂,COD约为8000~15 000 mg/L。
(2)主要试剂:硫酸银(Ag2SO4)、硫酸汞(HgSO4)、重铬酸钾(K2Cr2O7)均购于嘉兴市化学试剂厂,LB肉汤购于杭州百思生物技术有限公司,总抗氧化能力试剂盒购于南京建成生物工程研究所,Ecoplate板购自美国BIOLOG公司。
(3)主要仪器:大型恒温振荡器(恒科学仪器有限公司上海中国),电热式压力蒸汽灭菌器(新丰医疗器械有限公司浙江中国),水质毒性测试仪(哈希水质分析仪器有限公司北京中国),XH-C旋涡混合器(金坛市白塔新宝仪器厂 江苏 中国),Multiskan FC型酶标仪(美国)。
1.2 方法
1.2.1 填料选择及生物反应墙模型的构建
根据Blowes等人[20]的研究,本实验构建了改良的渗透反应墙,选择石英砂(粗,细)做进出水处填料,陶粒、锰砂、沸石、活性炭做生物反应区填料。粒径大小活性炭<沸石<锰砂<陶粒,设置比例为1∶1∶1∶1、1∶1∶1∶2、1∶1∶2∶1、1∶2∶1∶1、2∶1∶1∶1,COD去除率最高为最优配比。
建立总长,宽,高分别为700 mm,50 mm,60 mm的生物反应墙,自左向右依次填充粗石英砂(进水导流区),细石英砂,混合填料(生物反应区),细石英砂(出水区)。
1.2.2 进水浓度及流量的确定

图1 生物反应墙设计图Fig.1 Bioreactor wall design drawing
取垃圾渗滤液:水(①1∶1,②1∶2,…,⑩1∶10)20 uL、土壤浸提液10 uL、LB培养基160 uL于96孔板,置于摇床,以70 r/min,27℃条件恒温培养,每24 h读数,至超过1/3吸光度>2;
蠕动泵转速1 r/min,水力停留时间约1.8 h,略短,故取0.1 r/min,出水100 mL用时约6 h,确定该流速。
1.2.3 生物反应墙的接种微生物培养及固定
微生物菌株为实验室培养,培养及固定方法参照解井坤[21]。取稀释5倍和10倍的垃圾渗滤液,加入10 g菌粉,以70 r/min,27℃条件恒温培养72 h,扩繁后固定在聚氨酯泡沫载体上,均匀安置在反应墙内。
1.2.4 水质参数、毒性及抗氧化性测定
(1)每隔6 h取样测COD,波动较大,则向生物反应区添加少量驯化菌种;
(2)根据GB/T15441-1995《发光细菌法》[22],采用发光细菌检测出水水质毒性,计算发光抑制率;抑制率实验,LB培养基+配制菌液+出水,70 r/min,27℃条件恒温培养至超过1/3(即32个孔)吸光度>2;
(3)采用血清总抗氧化能力测定法,选取9个出水样,从培养基用接种环(酒精灯灭菌)挑取少量特定菌落,接种入已灭菌的50 mL培养基,放置在摇床上以70 r/min,27℃条件恒温培养约36 h;依次加入水样、菌液1 mL,培养基18 mL,以70 r/min,27℃条件恒温培养约16 h;吸取上述液体3 mL,漩涡混合器震荡3 min,37℃恒温水浴20 min;读取吸光度(波长520 nm),计算抗氧化能力。
1.2.5 微生物群落功能多样性测定
模拟小范围无菌环境,采用Biolog-ECO法[23]对生物反应区前、中、后部的上、中、下层微生物数量进行测定。每孔加对应区段的混合液150 uL,空白孔加等量0.9%生理盐水,用酶标仪读取0 h数据后以70 r/min,27℃条件恒温培养,每24 h读取数据并观察记录颜色变化孔数至超过1/3个孔的吸光度>2。
1.2.6 微生物代谢指纹图谱分析(ECO板法)
BIOLOG微平板技术最初应用于临床,Garland等1991年首次将其应用于描述混合的微生物群体特征[24]。Simpson指数是反映群落中最常见物种优势度的衡量指标;Shannon多样性指数是研究群落物种丰富度和分布均匀程度的综合指标;McIntosh指数是群落物种均一性的度量指标。

Shannon多样性指数:

Simpson指数(用1/D表示):
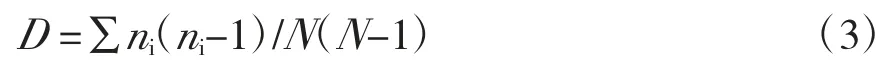
McIntosh指数:

式中,Ci为反应孔的吸光度,R为对照孔的吸光度;n为计算孔数;pi为每一孔吸光度除以所有孔吸光度的和以对变量进行标准化,消除在点样及培养过程中对吸光度变化带来的影响误差,相对吸光度n=Ci-R;N是相对吸光值总和。
1.2.7 CCA分析
利用Canon for windows 4.5软件绘图分析。样方间在种类组成上及环境因子组成上的相似性表现在排序图上样方较集中,群落间的界线比较模糊[25]。箭头表示环境因子,箭头所处的象限表示环境因子与排序轴之间的正负相关性,箭头连线的长度代表某个环境因子与群落分布和种类分布之间相关程度的大小,连线越长,相关性越大;箭头连线和排序轴的夹角代表着某个环境因子与排序轴的相关性大小,小于90度,角度越小越正相关,大于90度,角度越大越负相关。
2 结果与分析
2.1 生物反应墙进水生物毒性
如图2,垃圾渗滤液稀释倍数低(如①~③)时垃圾渗滤液色度较大,吸光度较高,稀释5倍,功能微生物生长状况良好且生物毒性维持在10%以内,说明该垃圾渗滤液毒性较强。

图2 不同浓度对微生物生长的抑制趋势Fig.2 The inhibitory trend of microbial growth at different influent concentrations
2.2 生物反应墙总体效果和运行参数分析
2.2.1 COD去除效果
原液COD为8500 mg·L-1,如图3所示,COD去除率基本稳定(除运行初期水样3存在小幅度波动),去除率均大于92%,整个装置在处理期5天内运行状况良好且COD去除效果良好。装置运行初期进水流速略大(泵转速1 r/min),造成水量波动,导致出水水质波动。

图3 COD去除率Fig.3 COD removal rate
2.2.2 出水生物毒性测定
如图4所示:0号为进水样,其发光抑制率为92%,出水发光细菌抑制率基本都在30%以下(除12号样抑制率为32.3%),毒性下降60%以上。

图4 发光菌抑制率Fig.4 Inhibition rate of luminescent bacteria
2.2.3 总抗氧化能力实验
如图5所示:总抗氧化能力总体呈上升趋势,说明水质毒性降低对微生物的抗氧化活性影响小。6 h时总抗氧化能力是0 h的22倍,是微生物对外界环境变化的应激反应,且前端营养富集,故微生物总抗氧化力高,微生物逐渐适应该环境,总抗氧化力降至正常水平,随着时间推移逐渐升高。后期营养物质减少,代谢降低,总抗氧化力下降。
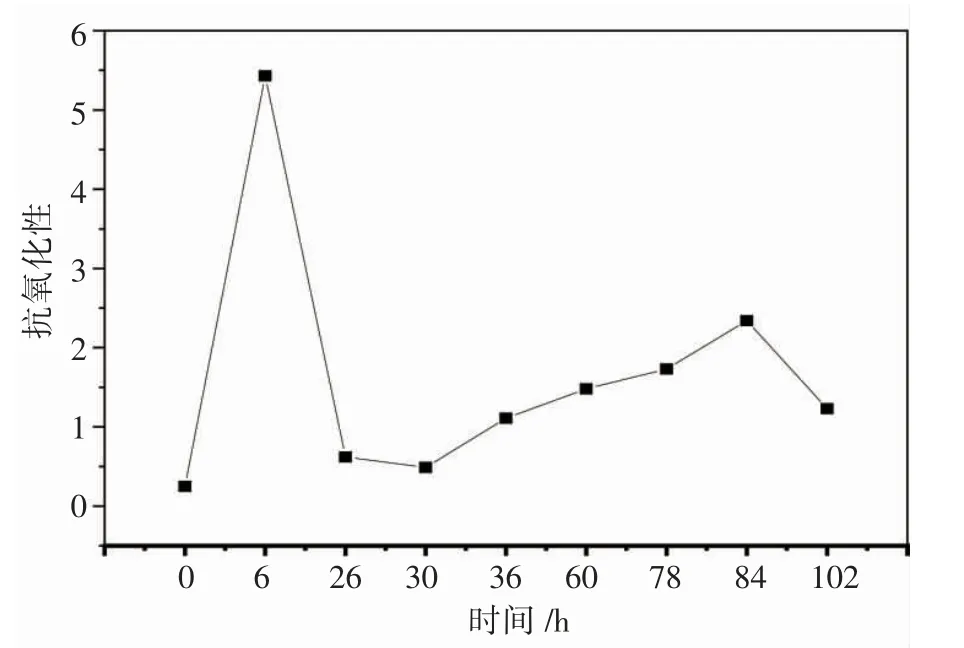
图5 出水总抗氧化能力变化趋势Fig.5 Variation trend of total antioxidant capacity of effluent(对应的样品依次为进水,出水1,2,3,4,7,9,10,12)
2.3 微生物群落代谢活性
如图6所示,反应墙内微生物墙体各部位AWCD变化曲线的斜率相差甚微,说明反应墙中微生物对Biolog生态板中单一碳源的利用能力和代谢活性相似。从前端到后端,生物代谢活性逐渐降低,因反应墙墙体前端微生物抗冲击力最强,随着横向位移逐渐降低;根据前、中、后段AWCD曲线知,反应墙墙体前端中层和中端中层生物活性最好,后端略差,因中层环境较上层的好氧和下层的缺氧为微含氧,利于驯化菌种生长代谢,后端因寡营养态达不到功能微生物生长要求,故偏低,72 h时后端比前端降低了23.6%。

图6 微生物代谢活性随时间变化情况Fig.6 Changes in microbial metabolic activities with time
2.4 微生物群落对不同碳源的代谢能力分析
如图7所示,微生物对各类碳源代谢能力前段>中段>后段,AWCD值显示脂类降低17.6%、糖类降低14.3%、醇类降低34.5%、胺类降低13.7%、酸类降低27.1%、氨基酸类降低35.8%,因为生物反应区前段进水浓度较高,生物数量较其他段多,且生物反应墙对这些碳源有消耗作用,故生物反应区前段碳源利用情况整体最好,后段代谢能力下降;对于前段而言,碳源利用程度由高到低为:糖类,氨基酸类,酸类,酯类,醇类,胺类;对于中段和后段而言,碳源利用程度由高到低为:糖类,氨基酸类,酸类,酯类,胺类,醇类。对糖类和氨基酸类利用较高,因为进水中含较多小分子多糖和氨基酸类物质,被优先利用。前段与中、后段的碳源利用差异仅表现在胺类和醇类的利用趋向程度方面,前者偏好于利用醇类,后者则偏好于胺类的利用[26],可在后端添加胺类碳源,提升反应墙生物活性和处理效果。

图7 培养72 h的6种碳源利用情况Fig.7 Utilization of six carbon sources during 72h cultivation
2.5 位点下代谢类型相似度分析
如图8所示:不同碳源对不同采样点微生物代谢相似度分布的贡献度差异,其中酸类、氨基酸类与不同采样点微生物代谢相似度分布关系最为密切,其次是、胺类、醇类、脂类、糖类。所有碳源均与第一排序轴的相关性较高。从左至右表示碳源量的增加,反应不同位点微生物对不同碳源的利用情况。中段上层、中段下层、后段中层三点距离相近,说明碳源利用情况相似,均对氨基酸、酸类、糖类的利用情况较差,因为反应墙对该类碳源消耗较大,使中后段这三类碳源量减少,可在中后段补充氨基酸、酸类、糖类,提高微生物代谢活性。
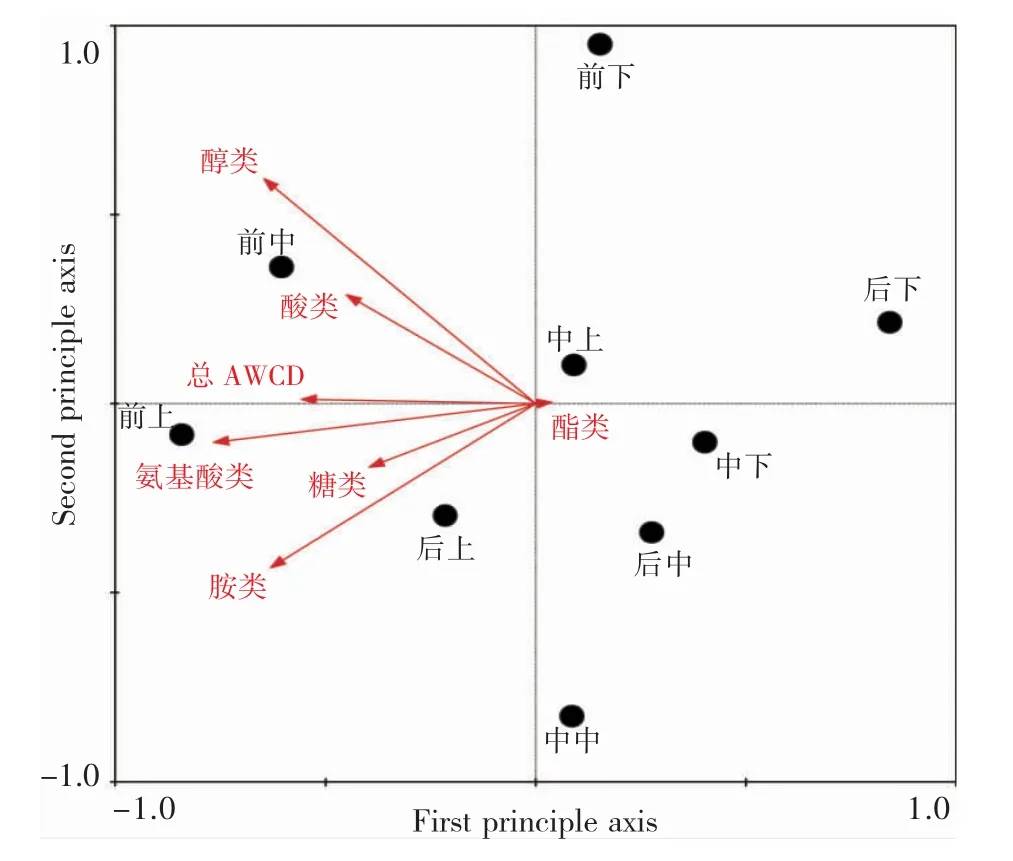
图8 培养72 h不同位点相关性分析Fig.8 Correlation analysis of different sites in 72 h cultivation
2.6 微生物群落功能多样性
如表1所示,反应墙前端至后端,功能微生物群落Simpson指数上升113.4%,即微生物多样性和均一性降低;Shannon指数下降4.9%,即微生物丰富度降低;McIntosh指数下降25.2%,即微生物均匀度降低。原因是前端营养高,后端营养贫瘠,环境单一。

表1 反应墙中微生物群落代谢功能多样性评价Tab.1 Evaluation of the Metabolic Function Diversity of Microbial Communities in the Reaction Wall
2.7 经济核算
近年来海藻酸钙固定化零价铁应用于零价铁渗透式反应墙[27],以构建长、宽、高为21、1.5、1.8 m的渗透反应墙为例,对比本实验与该零价铁渗透反应墙,进行经济核算。
如表2所示,构建同等规模反应墙,本实验费用总计31 819元,海藻酸钙固定化零价铁渗透式反应墙107 512元。可见构建生物渗透反应墙成本远低于零价铁渗透反应墙,具有较大经济优势。

表2 经济核算Tab.2 Economic accounting
3 结论
(1)模拟生物反应墙处理垃圾渗滤液的效果较理想,COD去除率均在92%以上,生物毒性试验中发光细菌抑制率基本都在30%以下,总抗氧化能力整体随着时间推移而逐渐增高;
(2)生物反应区内微生物群落代谢活性随着水流方向逐渐降低,主要由于前端微生物受冲击较大,可通过减缓进水流速提高前端微生物活性。
(3)反应墙中后段微生物碳代谢指纹图谱类似,均对氨基酸、酸类、糖类的利用情况较差,因为反应墙对该类消耗较大,使中后段这三类碳源量减少,可在中后段补充氨基酸、酸类、糖类,提高微生物代谢活性。

