胃肠耐受阶梯化进食用于胰腺癌术后对胃肠功能恢复的影响
董珈妤,王艳南,刘晶晶
胰腺癌作为一种恶性程度较高的消化系统恶性肿瘤,近年来流行病学调查显示全球总发病人数呈逐年上升趋势,我国国家癌症中心最新统计报告发现,在所有恶性肿瘤中胰腺癌发病率位居第10位,而死亡率位居第6位[1-2]。根治性手术是目前胰腺癌首选的治疗方案,据报道显示胰腺癌患者R0切除后结合辅助化疗,5年生存率可达40%[3]。但根治性切除手术创伤较大,不仅会导致应激反应,还会影响术后胃肠道蠕动功能及机体营养状况[4]。既往研究表明,消化道手术后早期进行营养干预不仅能有效调节胃肠激素分泌,改善机体营养状态,还能够促进胃肠蠕动功能恢复,保护肠黏膜屏障功能,减轻应激反应[5]。胃肠耐受阶梯化进食方案是作为根据苏醒和吞咽评估、消化道症状评估结果并结合患者意愿制定胃肠耐受的阶梯化进食方案[6]。本研究旨在深入探讨胃肠耐受阶梯化进食方案对胰腺癌术后患者胃肠功能、应激激素、免疫功能的影响。
1 对象与方法
1.1 对象 选取北京同仁医院2019年1月~2021年1月收治的行手术治疗的胰腺癌患者100例作为研究对象。纳入标准:所有患者均符合《胰腺癌诊疗规范(2018年版)》中胰腺癌诊断标准,均确诊为胰腺导管腺癌[7];患者均行胰腺癌根治性手术(手术方式选择胰十二指肠切除术);年龄>18岁;意识清楚,具备正常的思维及交流沟通能力;临床资料及随访资料齐全。排除标准:其他病理类型的胰腺癌患者,如胰腺囊性肿瘤、胰腺鳞癌等;合并严重心、肝、肾等重要脏器疾病;伴有其他恶性肿瘤病史及精神病史;严重消化道溃疡、急性感染;有消化道手术史、糖尿病病史;严重凝血功能障碍及自身免疫性疾病;术前发生远处淋巴结转移或其他脏器转移者;术前行放疗、化疗、生物免疫治疗或其他抗肿瘤辅助治疗;肿瘤分期较晚行姑息性手术者;围术期死亡及非肿瘤性死亡者。按照随机数表法分为观察组和对照组各50例,两组患者一般资料比较差异无统计学意义(P>0.05,表1)。研究经医院医学伦理委员会批准,患者签署知情同意书。
表1 两组胰腺癌患者一般资料比较[例(%),±s]

表1 两组胰腺癌患者一般资料比较[例(%),±s]
TNM分期 病理分化男 女 Ⅰ期 Ⅱ期 Ⅲ期 高分化观察组 50 58.70±6.40 34 16 21.30±2.25 3.86±1.82 17(34.00) 24(48.00) 9(18.00) 28(56.00)对照组 50 60.12±8.14 30 20 21.48±1.56 3.54±1.13 15(30.00) 23(46.00) 12(24.00) 30(60.00)t/χ2值 0.970 0.694 0.465 1.056 0.575 0.164 P值 0.335 0.405 0.643 0.294 0.750 0.685组别 例数 年龄(岁)性别 体质量指数(kg/m2)肿瘤直径(cm)低/中分化22(44.00)20(40.00)手术时长(h)5.66±0.64 5.58±0.59 0.650 0.517
1.2 方法 对照组患者术前常规禁食禁饮,术后24~48 h后生命体征平稳无异常者,可协助患者抬高床头15°~20°后常规进食进饮。观察组患者术前常规禁食禁饮,术后根据苏醒和吞咽评估、消化道症状评估结果并结合患者意愿制定胃肠耐受的阶梯化进食方案。(1)术后评估:①Steward苏醒评分:该量表包括3个条目,即呼吸通畅程度、清醒程度、肢体活动程度,每个条目有3个等级,计0~2分,总分即为3项分值之和,其中总分≥4分视为苏醒,4<分视为仍未苏醒[8]。自患者返回加护病房起15 min进行1次评估,直至Steward苏醒评分≥4分,后即行吞咽评估。②洼田饮水试验:患者仰卧位,尽可能一次性咽下30 ml温开水,观察此过程中是否出现呛咳,并记录饮水次数及时间[9]。③胃肠道症状评估:采用一对一、面对面询问的方式记录患者腹胀、恶心、呕吐等胃肠道症状发生情况。④主观意愿评估:采用一对一、面对面询问的方式记录患者有无主观进食进饮意愿。Steward苏醒评分≥4分,且洼田饮水试验呈阴性,未出现恶心、呕吐、腹胀,视为患者评估合格标准。(2)协助患者进食进饮:患者返回加护病房且生命体征平稳、上述评估全部合格后给予胃肠耐受阶梯化进食方案。先协助患者抬高床头15°~20°,10 ml温开水饮用完后观察30 min,无异常情况则30 min后继续饮用50 ml温开水,60 min后进食米汤10 ml;继续观察60 min,无异常状况即进食米汤50 ml;继续观察60 min,无异常状况即进食稀饭10 ml;继续观察60 min,无异常状况即进食稀饭50 ml;继续观察60 min,无异常状况即进食稀饭100 ml;后继续观察60 min,无异常状况即进食平时食量的一半。观察进食期间患者有无误吸、呛咳情况,若出现中度及中度以上的恶心、呕吐、腹胀,须即刻停止进食,告知医生及时给予对症处理。患者若再次有进食意愿且上述评估全部合格,即可自饮用温水10 ml开始重新给予胃肠耐受阶梯化进食方案。
1.3 观察指标
1.3.1 恶心呕吐及腹胀程度 患者返回加护病房后72 h内,由责任护士通过询问或观察方式评估患者恶心呕吐及腹胀情况并做好记录。参考世界卫生组织(WHO)推荐的恶心呕吐评级标准[10]。
1.3.2 临床指标 包括术后首次肛门排气时间、术后首次排便时间、术后肠鸣音恢复时间及术后并发症发生率。
1.3.3 应激激素指标 分别于患者术前及术后7 d,采集清晨空腹外周静脉血5 ml,室温放置30 min后以离心半径13.5 cm、3 000 r/min离心10 min,提取血清后置入-80℃冰箱内保存备测。采用酶联免疫吸附法检测促肾上腺皮质激素(ACTH)、皮质醇(COR)、血管紧张素-Ⅱ(AT-Ⅱ)、醛固酮(aALD)含量,试剂盒均购自于杭州昊鑫生物科技股份有限公司。
1.3.4 相关实验室指标检测 空腹采集肘静脉血5 ml,离心半径13.5 cm、3 000 r/min离心10 min,分离上清液,-40℃下保存待检,采用日本Olympus AU 640型全自动生化分析仪检测谷丙转氨酶 (ALT)、谷草转氨酶 (AST)、总胆红素(TBIL)、血清淀粉酶(S-AMY)及脂肪酶(LPS)水平。
1.4 统计学处理 采用SPSS 23.0统计学软件进行数据分析,采用(%)表示计数资料,采用χ2检验,等级资料比较采用秩和检验;采用(±s)表示正态分布的计量资料,组间比较采用独立样本t检验,组内比较采用配对样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后72 h内恶心呕吐及腹胀程度比较 两组患者术后72 h内恶心呕吐及腹胀程度比较,差异无统计学意义(P>0.05)。
2.2 两组临床指标比较 观察组术后首次肛门排气时间、术后首次排便时间、术后肠鸣音恢复时间均显著短于对照组(P<0.05,表2)。
表2 两组胰腺癌患者临床指标比较(d,±s)
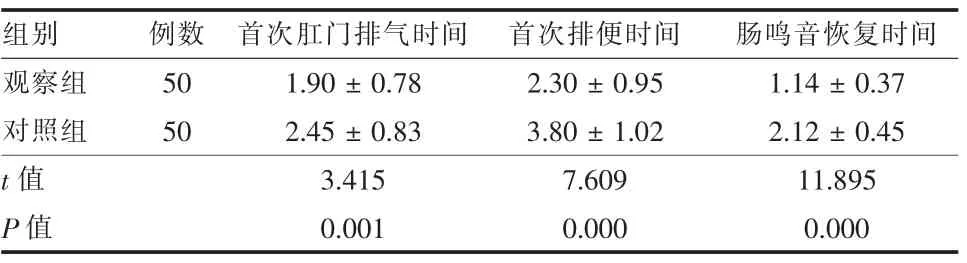
表2 两组胰腺癌患者临床指标比较(d,±s)
组别 例数 首次肛门排气时间 首次排便时间 肠鸣音恢复时间观察组 50 1.90±0.78 2.30±0.95 1.14±0.37对照组 50 2.45±0.83 3.80±1.02 2.12±0.45 t值 3.415 7.609 11.895 P值 0.001 0.000 0.000
2.3 两组应激激素指标比较 术前,两组血清ACTH、COR、AT-Ⅱ、ALD水平比较,差异无统计学意义(P>0.05);术后7 d,两组血清ACTH、COR、AT-Ⅱ、ALD水平均较术前显著升高,但观察组上述指标均显著低于对照组,差异有统计学意义(P<0.05,表3)。
表3 两组胰腺癌患者应激激素指标比较(±s)
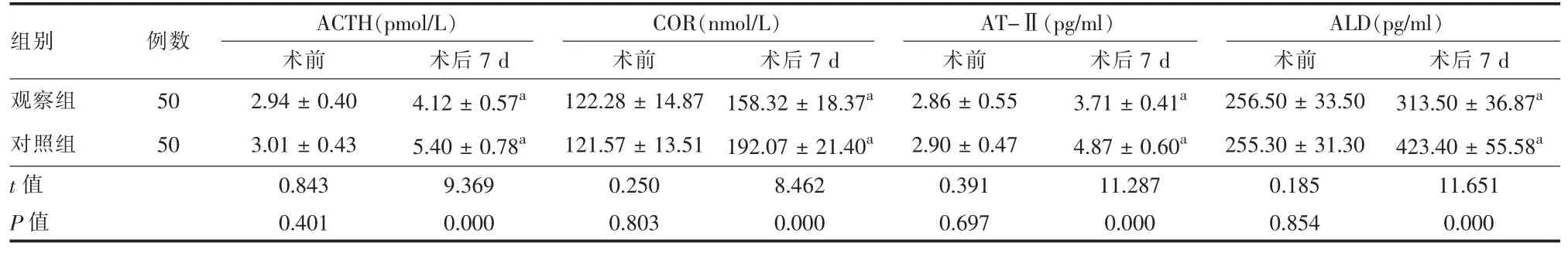
表3 两组胰腺癌患者应激激素指标比较(±s)
注:与本组术前比较,aP<0.05
组别 例数 ACTH(pmol/L)术前 术后7 d观察组 50 2.94±0.40 4.12±0.57a对照组 50 3.01±0.43 5.40±0.78a t值 0.843 9.369 P值 0.401 0.000 COR(nmol/L)术前122.28±14.87 121.57±13.51 0.250 0.803 AT-Ⅱ(pg/ml) ALD(pg/ml)术后7 d 术前 术后7 d 术前 术后7 d 158.32±18.37a 2.86±0.55 3.71±0.41a 256.50±33.50 313.50±36.87a 192.07±21.40a 2.90±0.47 4.87±0.60a 255.30±31.30 423.40±55.58a 8.462 0.391 11.287 0.185 11.651 0.000 0.697 0.000 0.854 0.000
2.4 两组相关实验室指标比较 两组术前ALT、AST、TBil、S-AMY、LPS比较差异无统计学意义(P>0.05),术后7 d两组ALT、AST、S-AMY、LPS均显著低于术前,差异有统计学意义(P<0.05),组间比较差异无统计学意义(P>0.05,表4)。

表4 两组胰腺癌患者相关实验室指标比较
2.5 两组术后并发症发生率比较 对照组术后均未见胃肠道瘘、腹腔感染等并发症,观察组1例胃肠道瘘,两组术后并发症发生率比较差异无统计学意义(χ2=0.000,P=1.000)。
3 讨论
胰腺癌属临床常见的消化系统肿瘤,具有早期诊断困难、恶性程度高、发病率及死亡率高、预后极差等特点。胰十二指肠切除术仍是目前治疗该病的主要手术方式,但因该术式手术时间长,组织创伤大,改变了患者正常的胃肠胆胰解剖结构,导致患者术后营养摄入困难、免疫功能低下,易出现感染、胰瘘、胆瘘、胃瘫等并发症,故胰腺癌患者胰十二指肠切除术后早期进食,对维持患者营养状态、促进胃肠道功能恢复尤为重要[11]。胃肠耐受阶梯化进食方案是根据患者胃肠耐受度而制定的阶梯化进食方案,该方案遵循循序渐进的原则,以胃肠耐受和营养成分为术后进食方案的主要参考指标,符合患者饮食习惯,有利于降低胃肠不耐受发生风险,并在一定程度上强化了患者术后早期营养支持,能有效缩短术后首次肛门排气时间、术后首次排便时间、术后肠鸣音恢复时间,促进患者胃肠道功能恢复。
本研究结果显示,两组患者术后72 h内恶心呕吐及腹胀程度比较无明显差异,但观察组术后首次肛门排气时间、术后首次排便时间、术后肠鸣音恢复时间均显著短于对照组,证实对胰腺癌术后患者实施胃肠耐受阶梯化进食方案,可在不加重患者恶心呕吐及腹胀程度的前提下促进胃肠功能恢复。
本研究结果显示,两组术后7 d血清ACTH、COR、AT-Ⅱ、ALD水平均较术前显著升高,且观察组术后7 d上述指标均明显低于对照组,提示胰腺癌术后患者接受胃肠耐受阶梯化进食方案能够抑制应激反应。蒋莎莎等[12]报道胰腺癌手术创伤会导致术后应激反应被激活,促使应激激素分泌增多,而术后早期肠内免疫营养干预能有效改善应激激素分泌,抑制应激反应程度。胃肠耐受阶梯化进食方案可在不加重胰腺癌术后患者恶心呕吐及腹胀程度的前提下促进胃肠功能恢复,调控机体物质代谢及细胞因子的产生、释放,抑制免疫炎症反应,缓解机体应激反应。
手术创伤会引发的一系列生理变化,特别是全身系统性炎症以及免疫、代谢异常引发的营养不良,其中肝功能也会受到一定影响,本次研究中两组术前术后肝功能及S-AMY、LPS均高于正常值范围,提示合并一定程度的肝损伤,术后随时间推移呈降低趋势,总体恢复情况良好,两组未见明显差异考虑与样本量大小等因素有关,还需后续完善研究。
综上所述,胰腺癌术后患者接受胃肠耐受阶梯化进食方案,并不会加重患者恶心呕吐及腹胀程度,有利于促进胃肠功能恢复并减轻应激反应。但本次研究纳入样本量偏少,且未对长期效果进行观察,故今后仍有待进一步研究。

