microRNA-21、PTEN、RASA1及caspase-3在肾上腺醛固酮瘤中的表达及相关作用机制
书星,赵洋,孙敏,南玉奎,王慧琴,齐飞波
新疆维吾尔自治区人民医院,a 泌尿中心,b 科教中心,乌鲁木齐 830002
原发性醛固酮增多症(PA)简称原醛症,是由于肾上腺皮质球状袋分泌过多的醛固酮所致。血浆中超出常规含量的醛固酮对肾脏、心脏、脑等器官有独立于高血压的损害作用[1]。PA的主要类型包括:双侧肾上腺增生(BAH)、醛固酮瘤(APA)、家族性醛固酮增多症(FH)及肾上腺皮质癌[2-4],发病机制尚不清楚。
microRNAs(miRNAs)是短链非编码RNA的一种,其长度为18~27个核苷酸,在超过30%的人类基因中,与靶mRNA的3‘非翻译区(3‘UTR)相结合,在转录后水平进行调节[5]。miRNAs参与了体内诸多的生物学进程[6]。miRNA功能异常会导致正常细胞过度增殖或癌变。在诸多致瘤miRNA中较为关键的是miR-21,其在多种肿瘤组织中均有高表达[7]。本研究通过对48例APA患者手术样本进行分子生物学研究并构建细胞模型,探讨miR-21在该疾病发生中的潜在分子生物学机制。
1 对象与方法
1.1 研究对象 收集新疆维吾尔自治区人民医院2016年1月至2018年6月就诊的48例肾上腺醛固酮瘤患者的肿瘤与瘤旁组织,并保存于液氮中;其中女性31例,男性17例;年龄范围21~58岁,年龄(42.0±10.2)岁。肿瘤大小1.2~3.9 cm,平均2.26 cm。本研究方案经新疆维吾尔自治区人民医院伦理委员会批准。
1.2 试剂与材料 所有标本均经术后病理确诊,从距离肿瘤手术阴性切缘1 cm以外的肾上腺中切取瘤旁组织。miR-21、U6引物(上海生工生物工程股份有限公司);人肾上腺皮质细胞(HACC)259细胞(中国科学院上海生命科学研究院);miR Neasy Mini kit试剂盒、QIAGE miScript Ⅱ RT Kit反转录试剂盒、QIAGE miScript Ⅱ RT Kit反转录试剂盒及QIAGEN miScript SYBR Green PCR Kit试剂盒购自德国QIAGEN公司;无血清培养基(Opti-MEMI)、转染试剂脂质体2000(Lipofectamine 2000)均购自美国Invitrogen公司;10%胎牛血清购自Gibco;miR-21抑制物(miR-21·INH载体)及对照空载体(INH-NC)购自上海Gene公司;RAS、PTEN活性检测试剂盒(生工生物)、caspase-3检测试剂盒;免疫组织化学相关试剂及材料有我院病理科提供。
1.3 实验方法
1.3.1 miR-21相对表达量检测
1.3.1.1 提取总RNA 通过Trizol法抽提总RNA,取冻存组织块30~50 mg研磨,按照德国QIAGEN有限公司产品miR Neasy Mini Kit试剂盒说明书进行样本总RNA提取。最后用超微量核酸蛋白检测仪(Thermo 美国)测定提取样本的总RNA浓度及纯度,保存样本备用。
1.3.1.2 逆转录合成cDNA 在逆转录合成cDNA时,参照德国QIAGE miScript Ⅱ RT Kit反转录试剂盒的说明书进行操作,反应体系为20 μL:5×HIFlex Buffer 4 μL,10×Nucleics Mix 2 μL,RT Enzyme Mix 2 μL,Total RNA(浓度约为25 ng/μL)+RNase-Free H2O2共12 μL。反应条件:37 ℃,60 min;95 ℃,5 min。
1.3.1.3 实时荧光定量PCR反应 采用QIAGEN miScript SYBR Green PCR Kit试剂盒,反应体系20 μL:2×Quantitect SYBR Green PCR Master Mix 10 μL,10×miScript Primer Assay 2 μL,10×miScript Universal Primer 2 μL,RNase-Free H2O25 μL,模板cDNA 1 μL。MiR-21特异性引物及U6内参引物见表1。反应条件:95 ℃,15 min,1个循环。94 ℃,15 s;55 ℃,30 s;70 ℃,30 s;40个循环。分别计算miR-21及U6基因的Ct值,ΔCt值代表基因的相对定量,ΔCt值=目的基因Ct值-同组内参Ct值,ΔΔCt值=各样本ΔCt值-最小ΔCt值,其表达的差异倍数用2-ΔΔCt值表示,实验重复3次。

表1 miRNA-21及U6引物序列
1.3.2 免疫组织化学检测PTEN、RASA1及caspase-3表达 采用SP法行免疫组织化学染色,PTEN细胞浆内黄染为阳性,RASA1细胞桨和胞核内黄染为阳性,caspase-3细胞核内黄染为阳性。随机取5个高倍镜(10×40)下视野,0分≤10%,1分为11%~25%,2分为26%~50%,3分为51%~75%,4分为≥76%。染色强度0分无染色,1分淡染色,2分棕染色,3分棕褐色。阳性为两项积分和≥3分,阴性<3分。
1.3.3 Western Blot法检测RASA1、PTEN及caspase-3表达 采用Western Blot凝胶成像法对组织及细胞模型中的蛋白表达情况进行半定量分析。称取相同质量组织样本或吸取相同数量对数期培养细胞,对组织或细胞进行裂解并抽提获得总蛋白,采用BCA法对蛋白进行定量,配平蛋白浓度,GAPDH为已知浓度标准蛋白对照,按照20 μL蛋白+5 μL蛋白上样缓冲液混匀后置于金属加热器中100 ℃变性5 min。配置5%浓缩胶及12%分离胶,点样后90 V电压下电泳30 min,130 V电压下电泳90 min,转膜90 min,5%封闭液封闭2 h,孵育相应一抗于4 ℃过夜,TBST洗3次,每次洗10 min,加二抗孵育2 h,TBST洗3次,每次洗10 min,随即使用凝胶成像仪拍照和分析结果,以GAPDH作为阳性对照,选用PTEN/GAPDH、RASA1/GAPDH及caspase-3/GAPDH的灰度比值来代表肾上腺醛固酮瘤患者的肿瘤组织与瘤旁组织或HACC细胞模型中的相应蛋白的相对含量。
1.3.4 HACC micR-21表达细胞系构建 (1)细胞培养:人肾上腺皮质细胞(HACC)细胞株HACC 259(购自北纳生物),细胞常规培养在10%新胎牛血清、青霉素100 IU/mL和链霉素100 IU/mL的RPMI1640培养液中置于5%二氧化碳、37 ℃饱和温度的培养箱中。每48小时更换1次新鲜培养基并在倒置显微镜下观察细胞生长情况。48~72 h用0.25%的胰蛋白酶消化传代细胞1次,取对数生长期的细胞用于实验。(2)细胞转染:参照Lipofactamine 2000转染试剂说明书,采用瞬时转染法分别将miR-21高表达载体、miR-21抑制载体及空载体转染入HACC细胞,建立稳定表达细胞系,转染后6 h换含10%小牛血清的培养液继续培养,以用于后续实验。
1.3.5 HACC模型细胞生长曲线绘制 采用MTT法观察细胞生长情况,并绘制细胞生长曲线,具体如下:(1)制备1 mL细胞悬液,空白对照以1 mL培养基代替细胞悬液,加入0.1 mL MTT于37 ℃孵育4 h;(2)加1 mLDTW脱色液,37 ℃至少静置30 min,时甲质颗粒充分溶解;(3)吸取200 μL上述溶解液至96孔板中,在酶标仪上读取光密度(OD)值,检测波长570 nm,参考波长630 nm;(4)每隔48 h测量1个点,每个点平行测量3次取平均值;(5)按照OD值随时间的变化情况绘制细胞生长曲线。
2 结果
2.1 miRNA-21在肾上腺醛固酮瘤组织与瘤旁组织中的表达
2.1.1 miRNA-21实时荧光定量PCR检测结果 使用U6基因作为内参基因,肾上腺醛固酮瘤患者的肿瘤组织与瘤旁组织样本中miR-21的荧光定量扩增曲线呈现为典型的S型平滑曲线,该结果说明此次荧光定量试验反应的扩增效率良好;溶解曲线呈现为单峰,说明此次荧光定量实验反应的特异性扩增良好。
2.1.2 miR-21的相对表达水平 通过2-ΔΔCt法计算肾上腺醛固酮瘤患者的瘤旁组织与肿瘤组织样本中miR-21相对内参U6的相对表达量。miR-21在肾上腺醛固酮瘤患者的肿瘤组织(0.109±0.050)中的表达量高于瘤旁组织(0.040±0.019),差异有统计学意义(t=9.184,P<0.001)。
2.2 PTEN蛋白、RASA1蛋白及caspase-3蛋白在肾上腺醛固酮瘤癌组织与癌旁组织中的表达
2.2.1 RASA1 在肾上腺醛固酮瘤旁组织中阳性表达率为60.41%(29/48),主要肾上腺细胞浆中;肾上腺瘤患者组阳性表达率为8.33%(4/48),主要在细胞浆中。两组比较,差异有统计学意义(χ2=28.860,P<0.001)(图1)。
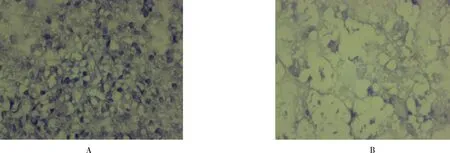
图1 肾上腺醛固酮瘤组织与瘤旁组织RASA1免疫组织化学结果:A为RASA1阳性表达(IHC×100);B为RASA1阴性表达(IHC×100)
2.2.2 caspase-3 caspase-3在两组中均有阳性表达,阳性表达定位于细胞核。在肾上腺醛固酮瘤旁组织中阳性表达率为89.58%(43/48);肾上腺醛固酮瘤组织中的阳性表达率为25.00%(12/48),两组比较,差异有统计学意义(χ2=18.447,P<0.001)(图2)。

图2 肾上腺醛固酮瘤组织与瘤旁组织caspase-3免疫组织化学结果:A为caspase-3阳性表达(IHC×100);B为caspase-3阴性表达(IHC×100)
2.2.3 PTEN PTEN在肾上腺醛固酮瘤组织与肾上腺醛固酮瘤旁组织中均有阳性表达,阳性表达定位于细胞浆;在肾上腺醛固酮瘤旁组织中阳性表达率为85.42%(41/48);肾上腺醛固酮瘤组织阳性表达率为22.92%(11/48)(图3)。两组间差异有统计学意义(χ2=37.762,P=0.001)。

图3 肾上腺醛固酮瘤组织与瘤旁组织PTEN免疫组织化学结果:A为PTEN阳性表达(IHC×200);B为PTEN阴性表达(IHC×200)
2.3 HACC细胞培养结果 转染HACC细胞后,Western Blot表达量检测结果显示,通过LSD法进行组间比较可知:转染细胞使miR-21过表达时caspase-3蛋白表达量(0.531±0.008)与转染细胞miR-21抑制表达时caspase-3蛋白表达量(0.279±0.003)与阴性对照组(0.422±0.006)比较,差异有统计学意义(P=0.001);miR-21抑制表达组与miR-21过表达组caspase-3蛋白表达量差异有统计学意义(P=0.001)。
转染后的HACC进行细胞生长分析,结果显示:与阴性对照相比,miR-21抑制表达组细胞生长缓慢,生长受到抑制;miR-21过表达组细胞生长迅速,细胞呈现过度增殖趋势(图4)。
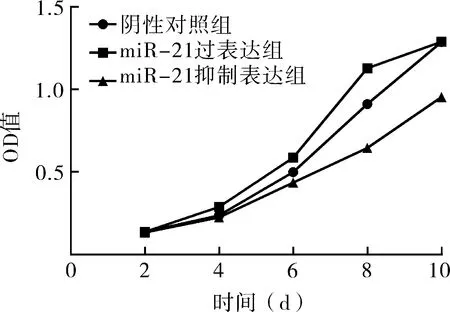
图4 HACC生长曲线
3 讨论
miR-21是在多种人类肿瘤中表达呈上调趋势的一个公认的非常重要的致癌基因[8]。目前已知miR-21的调控靶基因包括:PTEN[9]、RASA1[10]、caspase-3[11]等。
PTEN基因编码的蛋白可以使三磷酸肌醇去磷酸化而负调节PI3K/AKT/mTOR通路[12],引起细胞异常增殖[13]。PTEN的表达下调或突变失活间接激活mTORM通路诱导肿瘤的发生及进展,而PTEN是miR-21的靶基因,可通过对PTEN的调节诱发肿瘤或导致肿瘤进展[14]。Ras基因是保守的抑癌基因,RASA1是最早被发现的RAS GAPs之一。caspase-3是caspase家族中最为重要的成员,调控细胞的凋亡。caspase-3的低表达会导致细胞产生抗凋亡特性而导致肿瘤的发生[15]。研究[16]表明,miR-21在多种肿瘤中的表达中呈现上调趋势,其可同时对多种蛋白进行调控,造成细胞增殖代谢紊乱,PTEN、RASA1及caspase-3是其重要的靶向基因。
本研究发现:(1)miR-21在肾上腺醛固酮瘤组织中的表达明显高于瘤旁组织,通过免疫组织化学试验显示,瘤组织中的PTEN、RASA1及caspase-3蛋白的表达均较瘤旁组织呈现下调趋势,表明瘤组织中miR-21的上调可能与PTEN、RASA1及caspase-3表达存在负向调节关系。(2)miR-21抑制及过表达的HACC细胞模型,研究结果显示,miR-21过表达组中caspase-3蛋白表达量与miR-21抑制组比较,差异有统计学意义;miR-21抑制组细胞生长受到抑制,而miR-21过表达组细胞呈现过度增长态势,表明miR-21可能通过调控caspase-3蛋白的表达来降低细胞凋亡,导致肿瘤发生。
综上所述,肾上腺醛固酮瘤中miR-21呈现高表达,通过下调RASA1、PTEN及caspase-3,从而抑制细胞凋亡参与肿瘤进展。

