草鱼鳗弧菌的分离鉴定与耐药性分析
王惠 ,王书建 ,卞汉中 ,谢国兴 ,周阳 *
(1.盐城市大丰区水产技术推广站,江苏 盐城 224100;2.盐城市大丰区刘庄镇农业农村局,江苏 盐城 224100;3.盐城市大丰区苇鱼养殖场,江苏 盐城 224100)
草鱼(Ctenopharyngodon idellus)是我国淡水鱼类中的四大家鱼之一,2017 年产量超过580 万t,是世界水产养殖行业中产量较大的鱼类[1],对我国的养殖经济有卓越的贡献。在养殖生产中,细菌性出血病对草鱼的危害较为严重。目前引起草鱼出血病的细菌有嗜水气单胞菌[2]、维氏气单胞菌[3]、鲁氏耶尔森菌[4]等,而创伤弧菌感染草鱼的案例曾于2019 年在天津养殖场被首次报道[5]。这些细菌均容易感染草鱼,引起暴发性出血病,导致死亡,给草鱼养殖者带来严重的经济损失。
2020 年4 月中旬,盐城市大丰区某养殖场出现草鱼大量死亡现象,该研究对养殖场内的具有典型症状的发病草鱼进行了鱼体解剖和实验室诊断,从濒临死亡的草鱼体内分离纯化出一株优势菌株,通过16S rDNA 分析进行菌种鉴定和系统进化树分析,结果显示为鳗弧菌,这在草鱼的细菌性疾病研究中鲜有报道。同时对该菌株进行了药敏试验。
1 试验材料与方法
1.1 病理样本
发病草鱼取自大丰某塘口,体质量为412 g,体长25.2 cm。典型症状为眼球突出,眼眶周围充血,尾鳍发白,头部、鳍肢末梢和鳞片体表有大量的血,见图 1(a)(b)(c)(d)。其中细菌分离部位为肝脏和脾脏组织。

图1 发病草鱼
1.2 主要试剂
营养肉汤、营养琼脂、琼脂粉购于青岛海博生物技术有限公司,细菌基因提取试剂盒、PCR 产物回收试剂盒购于生工生物工程(上海)股份有限公司,药敏分析试剂板购于南京菲恩医疗科技有限公司。
1.3 细菌的分离纯化
对有出血症状濒临死亡的草鱼体表用酒精消毒,在无菌条件下解剖后,用灭菌的接种环取肝脏和脾脏的少许组织样,划线接种于普通营养琼脂培养基上,置于28 ℃恒温培养箱中培养24 h。观察菌落的形态和颜色,再挑取优势单菌落于普通营养肉汤培养液培养24 h。
1.4 细菌基因组提取和16S rDNA PCR 扩增
在无菌条件下,取500 μL 菌悬液,按照细菌DNA 提取试剂盒的说明方法进行提取操作。以菌悬液提取的DNA 为模板,用扩增16S rDNA 基因序列的通用引物 27F(5’-AGAGTTT GATCCTGGCTCAG-3’)和 1429R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR 扩增。扩增条件是:94 ℃预变性4 min,94 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸 45 s,35个循环;最后72 ℃延伸10 min。PCR 产物用1.2 %琼脂糖凝胶(含有GoldView 核酸染色剂)进行电泳检测。电泳条件是:恒压电压120 V,时间20 min。电泳结束后用凝胶成像仪拍照。PCR 产物用试剂盒回收后,委托生工生物工程(上海)股份有限公司进行测序分析。
1.5 序列比对与进化树构建
测序结果通过NCBI 网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线程序进行Blastn 比对,并利用MEGA 软件构建系统发育树。
1.6 药敏试验
挑取纯化后的单个菌落于5 mL 生理盐水中,配制0.5 MCF 的菌悬液制成A 管;取2 支10 mL的无菌生理盐水,打开任意一瓶,以无菌的方式向阴性对照孔分别加入200 μL 的无菌生理盐水;从A 管中吸取200 μL 菌悬液加至打开的10 mL 无菌生理盐水中制成B 管。将B 管所有菌液倒入经灭菌的V 形槽中,再将另一支10 mL 无菌生理盐水倒入V 形槽中。混匀后,利用微量移液器吸取V形槽中的菌液加至所有微孔中(阴性对照除外)200 μL;将药敏分析试剂板放入28 ℃的恒温培养箱中培养24 h,经肉眼观察证实无细菌生长试管中的最低药物浓度,孔内液体浑浊为阳性(+),孔内液体澄清为阴性(-),最低药物浓度即药物的最小抑菌浓度(minimal inhibitory concentration, MIC)。
2 结果与分析
2.1 病理样本的症状
春季末,塘口鱼浮头较多,游行缓慢,采集的病鱼体表有明显出血症状,尾鳍发白,解剖后发现鱼鳔有树枝状出血症状。
2.2 菌落形态
分离出的w7 菌在琼脂培养基中长势良好,颜色呈乳白色,圆润、微凸,边缘整齐,见图 2(a)(b)。

图2 分离菌株w7 的菌落形态
2.3 分离菌株w7 的药敏结果
药敏试验结果见表1。由表1 可见,从草鱼肝脏和脾脏中分离得到的w7 对恩诺沙星、硫酸新霉素、氟苯尼考、盐酸多西环素、磺胺甲唑+甲氧苄啶敏感,对甲砜霉素、磺胺间甲氧嘧啶钠中度敏感,对氟甲喹耐药。

表1 8 种抗菌药物对分离菌株的最小抑菌浓度(MIC)对照①
2.4 16S rDNA 序列分析
用16S rDNA 引物可从分离菌的基因组中扩增出一条分子质量约为1 400 bp 特异性的条带(图3)。基于16S rDNA 序列所构建的系统发育树见图4。由图4 可见,分离菌株与鳗弧菌775 株的亲缘关系最近。PCR 产物回收后直接进行PCR 产物测序,序列长度1 239 bp,序列比对结果如图5,根据比对结果将该分离菌株分类至鳗弧菌(Vibrio anguillarum),并将该菌株命名为w7 株。
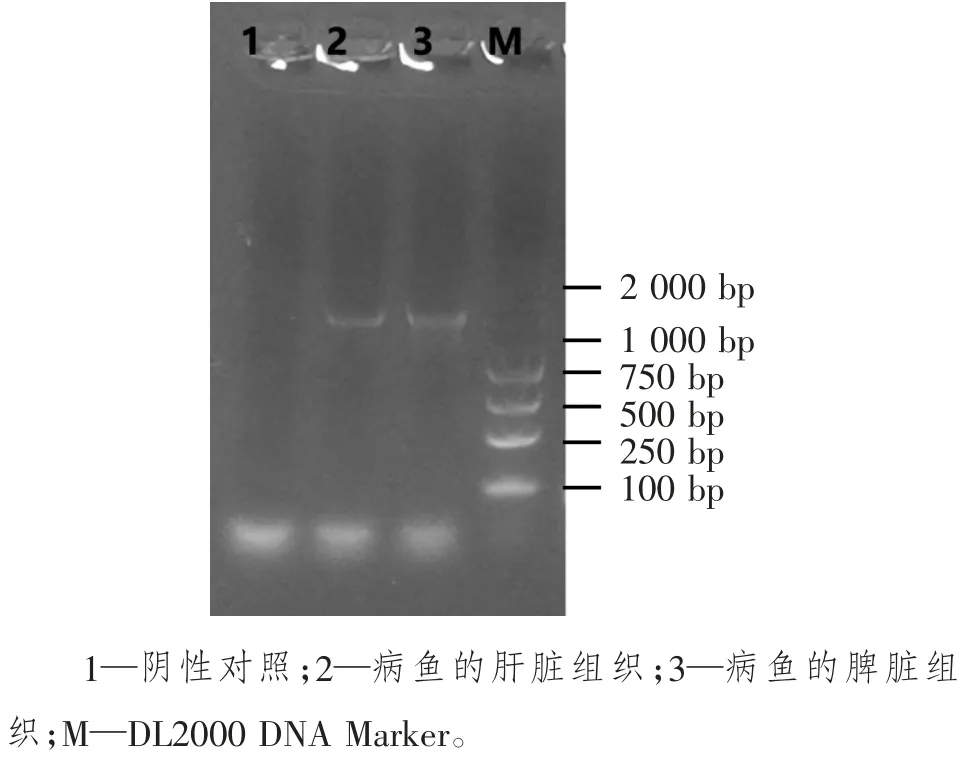
图3 分离菌株w7 的PCR 检测结果

图4 基于16S rDNA 序列所构建的系统发育树

图5 分离菌株w7 的BLAST 比对结果
3 讨论
鳗弧菌是危害鱼类的主要的条件致病菌之一,能使世界范围内的多种海水、淡水养殖鱼类及其他养殖动物患弧菌病,通常在鲈、牙鲆、大菱鲆等海水养殖动物中发现较多[6-7],而引起草鱼发病的案例鲜有报道。有研究表明,鳗弧菌是水环境微生物区系中的正常菌群,当水温较高、营养较丰富时菌群数量急剧增加[8],特别是在养殖密度、盐度和有机物含量较高的环境下易诱发鳗弧菌病。推测春季气温变化较大,尤其是陡然出现高温天气,可能导致水体营养丰富、盐度升高,从而造成疾病突发。根据相关研究报道[5,9],部分感染鳗弧菌的鱼体表会出现局部褪色,鳍条、鳍基部及鳃骨下部充血发红,肛门红肿,继而肌肉组织有弥散性或点状出血,体表发黑,鳍部出现溃烂等症状,这与该研究中的发病草鱼样本的症状有诸多相似。因此在草鱼的养殖生产中,注意细菌疾病的防范显得尤为关键。值得注意的是,目前关于草鱼感染弧菌导致生理病变甚至死亡的报道比较少见,仅在2019 年报道过天津的养殖场内出现过创伤弧菌感染草鱼的案例[5]。
在渔业养殖中,抗生素的频繁使用会增强病原体的耐药性,且抗生素的残留会影响鱼类尤其是一些食用鱼的安全。该研究中,鳗弧菌对恩诺沙星、盐酸多西环素、硫酸新霉素、氟苯尼考和磺胺甲唑+甲氧苄啶5 种抗菌药敏感,抑菌效果较好;而对氟甲喹产生了耐药性,几乎没有抑菌效果。因此,药物敏感性试验可以高效地筛选出抑菌效果明显的抗生素,对症下药,从而避免了抗生素的滥用和鱼类死亡加剧,在一定程度上能显著地减少养殖户的损失。

