创设问题情境 提升核心素养
——以“盐类的水解”为例
李秀凤
(福建省莆田华侨中学,福建莆田 351115)
引 言
新课程改革背景下,培养学生的学科核心素养成为教学的重点。“盐类的水解”教学中,教师应挖掘教学内容与核心素养培养的结合点,从而优化化学课堂教学设计,创设有效的问题情境,帮助学生掌握化学知识,实现课堂教学目标。
一、创设问题情境,提升宏观辨识与微观探析素养
“盐类的水解”的宏观变化可通过溶液的pH值体现,而理解并掌握其原理则需要从微观角度分析。在高中化学教学中,教师应创设相关的问题情境,有针对性地引导学生从宏观与微观相结合的角度分析、解决问题,加深学生对“盐类的水解”的本质的认识与理解,从而更好地提升学生的宏观辨识及微观探析素养。
在化学教学中,教师向学生分别提供NH4Cl溶液、NaCl溶液及CH3COONa溶液,引导学生判断这些物质属于酸、碱、盐中的哪一类。学生通过观察和思考,判断这些物质均属于盐。在此基础上,教师引导学生思考上述溶液的酸碱性。在课堂活动中,教师让学生使用pH试纸分别测定上述溶液的pH值,结果发现NH4Cl溶液的pH<7,NaCl溶液的pH=7,而CH3COONa溶液的pH>7。结合测出的pH值,引导学生深入思考,得出相应的结论。根据实验结果,学生很容易得出盐溶液并不一定呈中性,可能呈酸性,也可能呈碱性的结论。同时,在课堂活动中,为了帮助学生深入理解上述结论,教师可以NH4Cl、CH3COONa溶液为例,创设以下问题情境,要求学生思考:(1)NH4Cl、CH3COONa溶液中有哪些微粒?(2)溶液中的微粒能相互反应吗?(3)你能够从中得出什么结论?
学生经过思考与讨论得知,NH4Cl、CH3COONa溶液中电离出的NH4+、CH3COO-分别和水电离出的OH-、H+相结合,生成了NH3·H2O和CH3COOH,使溶液中存在较多的H+、OH-。教师如此开展教学活动,能够引导学生从宏观的pH值入手,探寻其内在原因,这样,学生能够在加深印象的同时,更好地理解盐类水解的本质,即盐生成的弱电解质破坏了水的电离平衡,同时很好地提升学生的宏观辨识与微观探析素养。
二、创设问题情境,提升变化观念与平衡思想素养
“盐类的水解”教学中,教师应使学生认识到化学变化遵循一定的规律,并能动态地运用化学反应原理解决简单的问题。为了调动学生思考问题的积极性,教师应围绕重难点知识创设问题情境,引导学生思考。
为了加深学生对盐类水解知识的理解,教师可以使用试管取适量的FeCl3溶液,要求学生根据所学的盐类的水解本质写出水解离子方程式。结合水解离子方程式,教师可以创设以下问题情境,要求学生思考下述几种情况下,水解平衡怎样移动,试管中会出现哪些现象:(1)向FeCl3溶液中加水;(2)升高溶液温度;(3)通入HCl气体;(4)加入Na2CO3固体。
经过思考,学生很快写出FeCl3溶液中存在的水解离子方程式:Fe3++3H2O⇌Fe(OH)3+3H+。在课堂教学中,教师要求学生结合勒夏特列原理进行分析、回答,让学生展开相应的猜想。在学生回答问题后,教师可以进行相关实验,结合实验现象验证学生的猜想。之后,教师追问学生:影响水解的外界因素有哪些?这些外界因素影响盐类的水解时遵循哪些规律?通过实验,学生很容易得出影响盐类水解的因素有浓度、温度、外加酸或碱物质、外加水解的盐。
三、创设问题情境,提升证据推理与模型认知素养
证据推理与模型认知素养在高中化学核心素养中占有重要地位。因此,在高中化学教学中,教师应帮助学生掌握“盐类的水解”的基本概念、基本原理等知识,通过例题的讲解,使学生在头脑中形成分析问题的清晰模型,从而高效解决问题[1]。
在课堂活动中,教师需要引导和启发学生深入理解盐类的水解规律,掌握化学知识。在解题过程中,为了引导学生灵活运用盐类的水解规律,寻找相关证据,进行正确的推理,教师应创设问题情境,要求学生思考:(1)相同的条件下,若NaOH、NaClO、CH3COONa、NaHCO3溶液的pH值相同,则其物质的量浓度大小关系是怎样的?(2)若上述四种溶液的物质的量浓度相同,则其pH值的大小关系是怎样的?(3)在NaHCO3溶液中,各种离子浓度之间的大小关系是怎样的?上述三个问题从不同的角度检验学生对盐类的水解规律的认识及灵活应用程度。教师需要引导学生透过现象看本质,结合所学的盐类的水解规律,进行合理推断。例如,若NaOH、NaClO、CH3COONa、NaHCO3溶液的pH值相同,其中浓度最小的应为NaOH溶液,在NaClO、CH3COONa、NaHCO3三种溶液pH值的比较中,需要比较其水解后生成酸的酸性大小,越弱越容易水解,对应的物质的量浓度越小,因为酸性强弱关系是醋酸>碳酸>次氯酸。所以,pH值相等时对应的物质的量浓度的大小关系为:c(CH3COONa)>c(NaHCO3)>c(NaClO)>c(NaOH)。
四、创设问题情境,提升科学探究与创新意识素养
在“盐类的水解”教学中,为了培养学生科学探究与创新意识素养,教师应结合实验,培养学生实事求是、科学探究的精神,鼓励学生开展合作学习活动,共同寻找问题的答案。同时,教师应结合学生的学习情况,创设问题情境,帮助学生巩固所学知识。
教师可以创设如下问题情境:使用图1实验器材,结合2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3制备NaNO2。同时,以NaNO2溶液为对象,按照表1内容探究NO2-的性质。已知[Fe(NO)]2+在溶液中呈棕色。
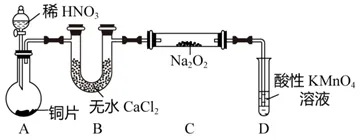
图1

表1
要求学生思考:(1)写出A中发生的离子方程式;(2)装置D可将剩余的NO氧化成NO3-,写出对应的离子方程式;(3)实验①为什么会出现“微热后红色加深”的现象?(4)将实验④中的少量棕色溶液加入试管中,加热,逸出无色气体,试管口呈现红棕色,溶液中产生红褐色沉淀,出现上述现象的原因是什么?探究时,教师先要求学生思考:探究过程中应注意哪些操作细节,需应用哪些探究方法?在解答过程中,教师可以带领学生回顾所学的实验知识,利用控制变量法开展探究。教师可以将学生分成若干小组开展合作探究活动,培养学生的探究意识和实践能力。在实验探究后,教师指导学生总结实验结论,引导学生得出结论的依据,培养学生实事求是的科学态度。
结 语
“盐类的水解”是高中化学的重难点知识,是高考必考的知识点。在高中化学教学中,教师既要做好相关理论知识的讲解,又要结合学生的实际情况创设相关问题情境,并预留一定的课堂空白时间,鼓励学生进行思考、讨论,加深学生对所学知识的理解,有针对性地提升学生的核心素养。

