结合基因工程的生物电子鼻用于气味检测的研究
朱 平,田玉兰,陈雅婷,陈 炜,杜立萍,吴春生
(西安交通大学 基础医学院 生物物理学系 医学工程研究所,陕西 西安 710061)
自然界和日常生活中包含难以计数的气味,这些气味富含多种有用的信息。例如,食品的气味可以反映其质量,可应用于食品安全检测;不同生长阶段或储存状态的农作物、植物或水果具有不同的气味,这有助于实现对农业生长过程的监控;在某些特殊的工业制造过程中,气味是即将到来危险的一种预警。另外,通过分析人的呼出气体或伤口的气味,可以在早期为一些疾病提供有用的诊断信息,这增加了疾病治愈的可能性。因此,气味检测及其响应机理的研究具有重要意义,在这些研究中,需要对气味进行高灵敏、准确、快速和客观的测量。目前气体检测已在食品安全、缉毒防爆、疾病诊断、环境监测等领域获得广泛应用[1-4]。气体检测的手段主要包括光学传感系统[5]、质谱分析[6]、气相色谱分析[7]、离子淌度谱分析[8]等,上述几类仪器检测灵敏度高、结果准确,但同时存在操作复杂、分析时间长、仪器昂贵和尺寸大等局限性。
生物嗅觉的机理研究极大地推动了相关领域的快速发展,模仿天然嗅觉系统的生物电子鼻研究已经进行了几十年[9-10]。其基本原理是利用生物嗅觉受体或表达嗅觉受体的细胞作为识别元件,并与传感器件相结合,通过检测气味分子与受体之间的相互作用信号,实现对气味分子特异性检测。在有机化合物与气味配体的特异性识别方面,将生物嗅觉元件作为生物电子鼻的敏感材料,如嗅觉受体(Olfactory Receptors,ORs)[11]、嗅感觉神经元(Olfactory Sensory Neurons,OSNs)[12]和气味结合蛋白(Odorant-Binding Proteins,OBPs)[13],实现了对有机化合物和气味配体的特异性识别。这些生物敏感材料与微电极阵列(MicroelEctrode Array,MEA)、石英晶体微天平(Quartz Crystal Microbalance,QCM)、表面等离子体共振(Surface Plasmon Resonance,SPR)、光寻址电位传感器(Light-Addressable Potentiometric Sensor,LAPS)、场效应晶体管(Field-Effect Transistor,FET)等二级换能器相结合,可以开发不同类型的气味分子检测传感器[14-20]。与传统电子鼻相比,生物电子鼻在检测挥发性有机化合物(Volatile Organic Compounds,VOCs)方面具有独特的优点,比如常温工作、高灵敏度和高选择性等。在各种生物电子鼻中,采用整个生物体作为敏感元件比采用其他生物材料作为敏感元件具有更稳定的性能和更完整的信息处理系统,这使得它们在开发可靠和便携的检测设备方面具有很大的优势和潜力。
生物嗅觉系统主要由主嗅觉上皮(Main Olfactory Epithelium,MOE)、嗅球(Olfactory Bulb,OB)和嗅皮层(Olfactory Cortex,OC)组成。1991年,Richard Axel和Linda Buck首次发现哺乳动物ORs基因超家族,揭示了OR基因在嗅觉信号处理中的重要作用。哺乳动物基因组含有约250~1200个功能性OR基因,主要分布于MOE的OSN。每个OSN仅表示一种类型的OR。一个OR可以识别多个气味配体,并且一个气味可以被多个OR识别。气味的标识是由OR的组合编码的,这一组合受体编码方案是具有有限数量ORs的生物嗅觉系统能够区分大量气味的原因之一。一旦气味与OR特异性结合,OSN会产生响应信号,并通过轴突的投射将信息传递到OB的丝球小体。气味信息被整合并编码在OB中,然后传输到大脑的OC进行进一步处理。
天然生物嗅觉系统具有相当广泛的气味响应谱。在笔者团队前期的研究中,通过将异源ORs转染到OSNs中并检测OSNs的响应,可以获得特异性的反应,证实通过调节ORs的表达可以调节对气味的特异性响应。考虑到气味信息可以主要在MOE中编码,并在OB中进一步处理,由此推测表达特定ORs的生物工程化MOE有可能提高嗅觉系统对气味配体的特异性响应。因此,在本研究中,提出通过对大鼠嗅觉系统进行生物工程化改造,并检测来自OB的编码信号来开发在体生物电子鼻。本研究在构建该生物工程仿生电子鼻的过程中,综合考虑了其特异性、灵敏度、稳定性、便携性、工作条件以及操作时间等多方面的特性,旨在提供一种新型气味检测途径,为其在不同领域的广泛应用提供可能。
1 材料与方法
1.1 材料与仪器
西安交通大学实验动物中心提供Sprague-Dawley大鼠;由OBiO技术公司(上海)使用腺病毒相关病毒(AAV)对大鼠进行基因工程改造,包括pAAV-CMV-EGFP-2A-Olfr15-3FLAG载体和 pAAV-CMV-EGFP-2A-MCS-3FLAG.Urethane;牙科用水泥(Luxatemp,Dental Milestones Guaranteed);脑立体定位仪(RWD Life Science);自制16通道微丝阵列用于电生理记录;镍铬微丝电极(AM系统,WA;#761500)的直径为38 μm,每条微丝之间的间隔距离约为200 μm;气味包括壬酸、辛酸和庚酸;抗β微管蛋白抗体和抗FLAG标签多克隆抗体;所有与Western Blotting有关的试剂均购自Beyotime(中国)。
1.2 腺病毒载体的制备与递送
OR3(Olfr15)基因包装成9型AAV载体,制成pAAV-CMV-EGFP-2A-olfr15-3FLAG载体,借助2A自切多肽实现了靶蛋白(OR3)过表达,并用FLAG-Tag进一步验证了过表达。用滴鼻的方式递送病毒载体。大鼠在用氨基甲酸乙酯(25%,5 mL/kg)麻醉后,两个月大时鼻内注射AAV-EGFP-Olfr15载体。将载体在PBS中稀释至适当浓度,然后通过用微量移液器将10滴2.5 μL滴剂滴加到每只大鼠的鼻腔中,在左右鼻孔之间交替,每只鼻孔之间间隔1 min,用微量移液器给药25 μL。
用Western Blotting方法检测过表达目标蛋白OR3。首先,进行标准的SDS-AGE,并将所得的凝胶转移至PVDF支链中。封闭后,将β微管蛋白抗体用于内部对照,并先用FLAG标签兔多克隆抗体印迹膜,再用HRP偶联的山羊抗兔IgG印迹。使用HRP的EZ-ECL化学发光检测试剂盒可以观察到OR3的表达。
1.3 微电极植入
将微丝电极阵列植入大鼠嗅球内。开颅手术暴露OB及相关脑区利用立体定位仪实现嗅球的精准定位。在递送AAV后的第二周,将微丝电极阵列植入大鼠的嗅球中。用氨基甲酸乙酯(25%,5 mL/kg)麻醉后,将大鼠固定在脑立体定位仪上。进行了开颅手术以暴露OB和相关的大脑区域。将电极植入大鼠的OB(坐标前位(AP):+ 8.2 mm,内侧-外侧(ML):-1.0 mm,背侧-背侧(DV):+ 0.8 mm),植入深度为600~800 μm,最后用牙科水泥长期固定在大鼠的头部(西安交通大学医学伦理委员会批准使用动物)。
1.4 气味刺激和信号记录
在载体注射3周后进行信号记录。在气味刺激之前,微电极阵列以25 kHz的采样率连接到多通道系统的前台。在麻醉状态下进行嗅觉刺激,测试大鼠的嗅觉反应。将一定浓度的气味物质注入大鼠鼻内5 s。
1.5 数据分析
记录的电生理数据在Matlab中进行离线分析。利用三阶巴特沃斯带通滤波器对原始信号进行滤波,提取峰值电位(尖峰,300~5000 Hz)信号。设置尖峰阈值从峰值电位信号中检测尖峰,并计算平均放电率。检测波形进行神经元分类。通过信号的互相关和自相关来分析两个时间序列之间的相关程度和同一时间序列在任意两个不同时刻的值。采用主成分分析(Principle Component Analysis,PCA)方法,以最小的信息损失从多通道信号中提取气味响应模式,实现数据的降维。在进行PCA时,将每个通道的特征变量设置为气味分子刺激之前和之后每个通道的神经元放电速率的差。假设有m个刺激,则每个刺激记录n个特征值(n> 3),形成一个m×n阶数据矩阵。通过线性变换和正交化数据矩阵获得3个方差最大的主成分,并将其用作3个特征值替换原始的n个特征量以实现数据的降维。
2 结果与讨论
2.1 OR3在大鼠嗅黏膜的过表达
重组AAV载体(pAAV-CMV-EGFP-2A-Olfr15-3FLAG)在大鼠MOE中过表达目标嗅觉受体OR3,滴度分别为7.06×1012基因组/mL。本研究选择AAV9血清型进行嗅觉神经元转导,鼻腔注射AAV9载体使靶基因在鼻上皮细胞成功表达。在AAV-EGFP-Olfr15给药后3周,表达达到峰值。进行蛋白质印迹分析以测试OR3的表达。从Western Blotting结果可以看出(图2),OR3在AAV接种3周后在大鼠嗅黏膜中有较高水平的表达,证明OR3成功过表达。
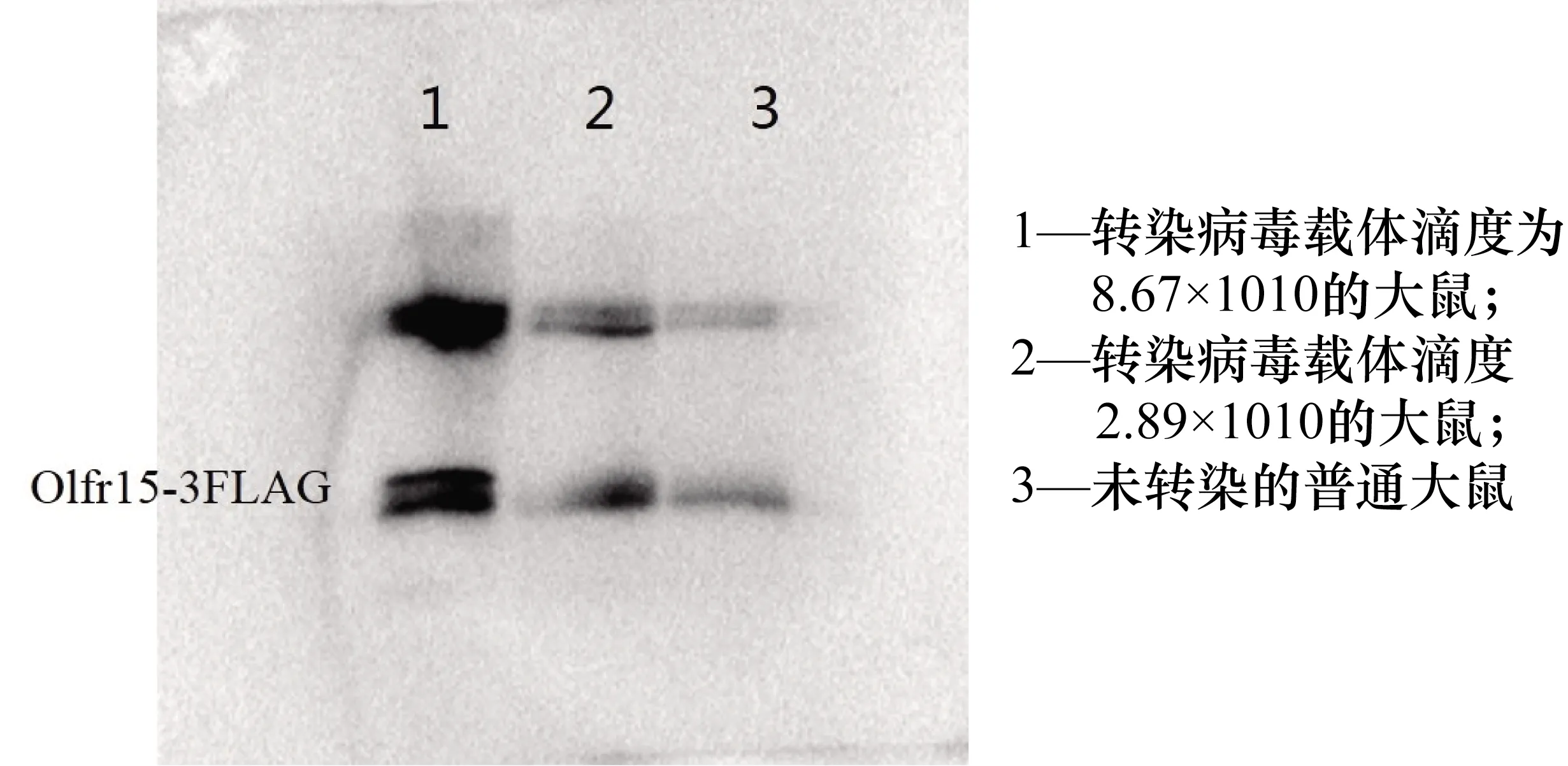
图1 OR3蛋白表达的Western Blot结果

图2 麻醉状态下没有气味刺激的生物工程化大鼠的自发神经元活动
2.2 嗅球信号的多通道采集
通过多通道微电极从OB的僧帽/从状(Mitral/Tufted,M/T)细胞记录电生理信号。M/T细胞层距OB表面的深度约为600~800 μm。在插入微电极阵列期间,同时监测神经元放电,并在观察到重要信号时选择位置,成功记录高质量信号是检测和区分气味的先决条件。在这项研究中,可以成功记录高质量的多通道信号。大约50%的通道的信噪比(Singnal-Noise Ratio,SNR)大于8,甚至高达13。图2(a)显示了来自生物工程大鼠的一个特征性自发放电信号,其SNR为9.5,神经元在不同的激发状态下自发活跃。为了进一步分析信号,执行了尖峰排序,图2(a)中显示了通道的尖峰。应用三阶巴特沃斯带通滤波器提取峰值电位(尖峰,300~5000 Hz)信号,然后从峰值电势信号中检测到尖峰。将基线噪声级别设置为信号的标准偏差(Standard Deviation,SD)值,并将尖峰检测阈值设置为3×SD。检测到尖峰时,将生成一个时间戳以进一步计算尖峰脉冲的发放率。具有相同形状的尖峰由相同的神经元产生。有时,可以从一个单个通道中分出两种类型的尖峰,如图2(b)所示,从图2(a)中分出了两种尖峰波形,表明单个微电极可以记录多个神经元活动。
多通道记录系统已广泛用于神经元放电记录。通过绘制自相关曲线和互相关曲线来分析不同通道信号之间的相关性。此外,相关系数由Matlab系统的内置“xcorr”函数计算得出,以专门分析通道之间的相关性。两个相关性较低的渠道反映了渠道之间的相似性较低。图2(c)示出了记录的自发发射的通道之间的自相关系数和互相关系数。由于相关的交换性质,相关矩阵关于其主对角线对称。78.6%的互相关系数小于0.7,表明不同的通道同时记录了丰富的信息,不同动物的情况并不完全相同,但所有信号均具有较高的SNR和相对独立的信息。
2.3 在体生物电子鼻对目标气味的特异性识别
在气味分子作用下,神经元的放电速率会发生不同程度的变化。计算平均放电率(Mean Firing Rates,MFR)以评估对不同气味的响应。MFR定义为每秒检测到的尖峰数。如预期的那样,记录的神经元在气味浓度为10×10-3mol时,对辛酸和壬酸有显著的响应。相反,如图3(a)所示的麻醉状态下OR3大鼠对不同气味刺激反应的结果表明,神经元对庚酸的反应较低,这是由于庚酸不是OR3的配体,尽管庚酸与辛酸和壬酸的化学结构类似。与非配体气味剂(庚酸)相比,由OR3的配体气味(辛酸和壬酸)引起的MFR变化显著增高(图3(b))。这进一步印证了之前的研究报道,即基因标记的鼠M72嗅觉感觉神经元对目标气味具有高敏感性反应。当气味浓度调整为10-4mol甚至10-5mol时,神经元响应变低(与气味浓度为10×10-3mol相比,同一神经元平均放电频率分别下降1.6 Hz,3.0 Hz)。
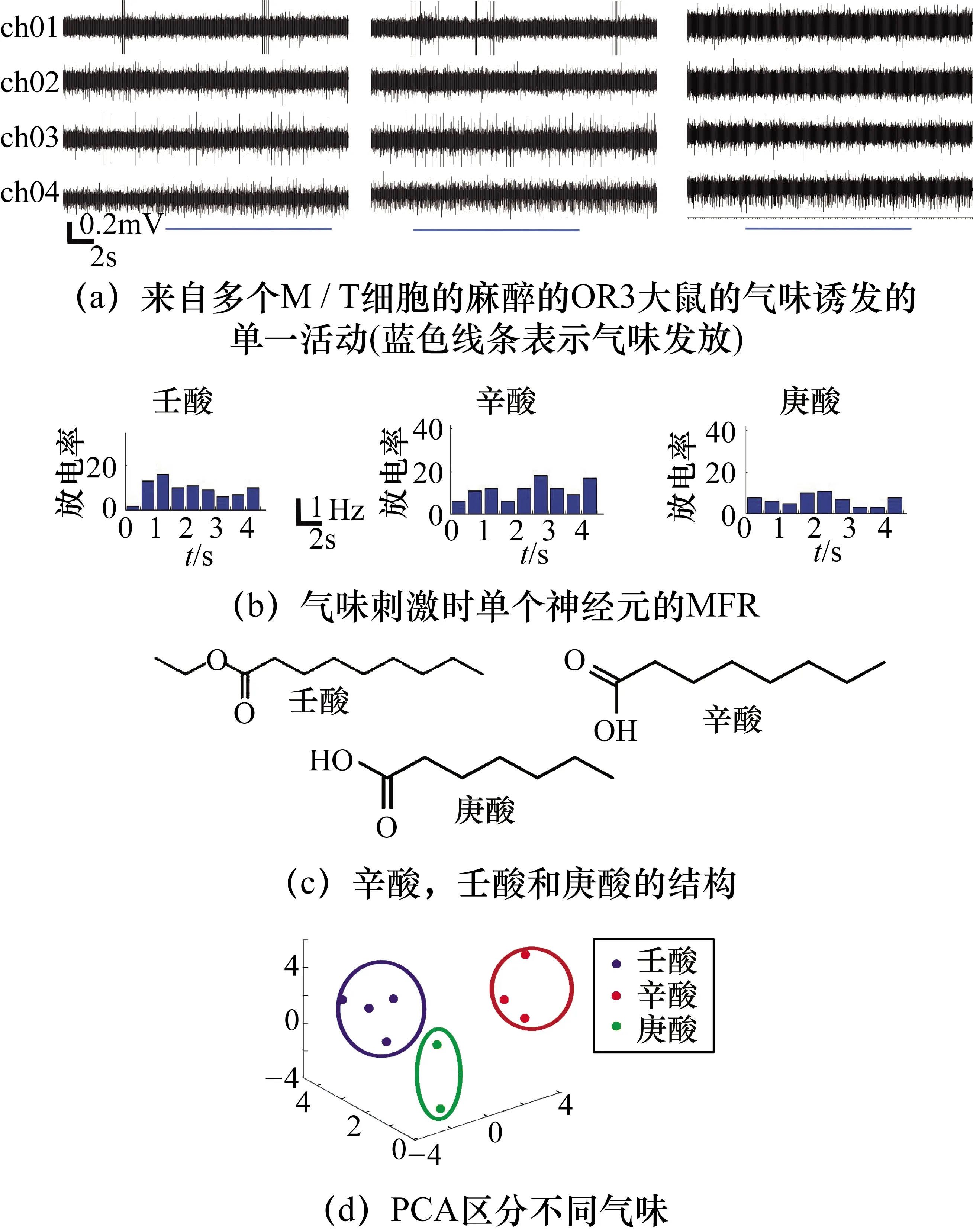
图3 麻醉状态下OR3大鼠对不同气味刺激反应的高频信号分析
结合生物工程的仿生电子鼻能够特异性地识别目标配体气味,但还需要一种更有效的方法来区分这些气味分子。PCA可以将数据的维数减少到几个主要成分[11]。在该研究中,利用PCA从多通道信号中提取了气味响应模式,并以最少的信息损失来区分气味分子。选择了前3个主要成分来代表所有响应数据,占检测总方差的90%以上,可以很好地代替原始特征量。将气味刺激视为一个样本集,将5个通道的响应视为5维。一个通道的响应是通过刺激后3 s内的发射速率减去刺激前3 s内的发射速率来评估的。样品组在3个主要成分上的投影如图3(d)所示。PCA的结果确定了两个配体气味(壬酸和辛酸)的清晰分离。尽管有微小的重叠,但可以成功区分不同化学类别的化合物,甚至是同一化学家族的相似化合物。这表明该体内生物传感系统具有很高的再现性和选择性。
3 结束语
本文通过将大鼠的生物工程化嗅觉系统与可植入微电极相结合,开发了一种在体生物电子鼻用于特异性目标气味的检测。结果表明,该系统具有很高的特异性和稳定性,是一种用于气味检测和识别的新技术。该生物电子鼻成功地记录了多通道高质量的大鼠嗅球M/T细胞信号,并且每个通道高度独立,因此可以提供丰富的嗅觉信息。通过 PCA评估了针对不同气味的独特响应模式。此外,通过Western Blotting的结果验证了OR3在嗅觉黏膜上的过表达,通过不同的气味测试探索了基因工程化大鼠对目标气味的特异性,结果表明该生物电子鼻系统提供了一种新型的特异性目标气味检测方法,在相关领域具有广泛的潜在应用,例如环境监测和爆炸物检测等。

