超声内镜联合Ki-67、DOG1 表达对胃肠道间质瘤诊断、危险性分级的评估价值
陈丽萍,余志金,陈惠新
(惠州市中心人民医院消化内科,惠州 516001)
胃肠道间质瘤(GIST)是最常见的起源于消化道的间质瘤,每年的发病率为百万分之7.8[1]。GIST 在所有年龄组均有报道,然而,不到10%的患者年龄小于40岁[2]。在成人胃肠道间质瘤中,最常见的原发部位是胃和小肠;在极少数情况下,它们也发生在内脏外的部位,如肠系膜、网膜、骨盆和腹膜后[3]。不幸的是,GIST具有潜在恶性,预后较差,在根治性切除后,肿瘤复发仍然很常见,特别是在高危患者中,超过50%的患者在根治性切除后5 年内复发[4]。寻找合适的方法对GIST尽早进行有效诊断和危险性分级对改善预后有积极作用。超声内镜是GIST 常用的检测手段;Ki67 是一种核蛋白,可指示细胞增殖的程度;DOG1 是GIST 中特异表达的蛋白[5]。因此,本研究探讨超声内镜联合Ki-67、DOG1 表达对胃肠道间质瘤诊断、危险性分级的评估价值,现报告如下。
1 资料与方法
1.1 一般资料 选取2015 年1 月~2020 年12 月收治GIST 患者98 例作为GIST 组,男54 例,女44 例;年龄32~71 岁,平均(51.54±4.82)岁;肿瘤部位:胃79 例,小肠12 例,结直肠7 例;肿瘤直径2~18cm,平均(6.25±2.34)cm;组织学类型:梭形细胞型73 例,上皮细胞型15 例,混合型10 例;核分裂数:≤5 个/50 高倍视野(Highpowerfield,HPF)66 例,6~10 个/50HPF 18 例,>10个/50HPF 14 例;危险度分级(NIH)[6]:极低危12 例,低危28 例,中危36 例,高危22 例。选取同期非GIST 患者(均为内镜诊断黏膜下肿物)30 例作为对照组,男18 例,女12 例;年龄36~68 岁,平均(53.61±3.78)岁;病理类型:胃肠道平滑肌瘤19 例,胃肠道神经鞘瘤11 例。两组患者性别、年龄比较差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:①GIST 符合《中国胃肠道间质瘤诊断治疗共识》[7]中相关诊断标准,且经术后病理学确诊;②初次确诊为GIST;③均行内镜下或外科手术切除治疗,术前未进行辅助治疗;④术前均行超声内镜检查;⑤具有完整病历资料。排除标准:①合并其他胃肠道疾病患者;②未进行超声内镜检查患者;③合并其他恶性肿瘤患者。
1.3 方法
1.3.1 超声内镜检查 患者于检查前禁食禁水8h,静脉全麻或表面麻醉,使用FUJINON -7000 超声内镜配合5-20MHz 可调探头采用充盈法和水囊法进行检查。观察并记录病变部位、大小、形状、回声等情况。
1.3.2 Ki-67、DOG1 表达检测 取患者肿瘤组织标本,甲醛固定,石蜡包埋,连续切片,厚度4μm。使用Ki67、DOG1 免疫组化试剂盒(上海谷研实业有限公司)采用过氧化物酶标记的链霉亲和素(SP)法检测Ki-67、DOG1 表达情况。切片常规脱蜡水化,细胞通透液浸润玻片30min,PBS 清洗3 次;将玻片放入0.01M 柠檬酸钠缓冲液(PH6.0)中微波修复抗原,PBS 清洗3 次;加入3%H2O2溶液孵育30min 以阻断内源性过氧化酶,PBS 清洗3 次;加入50μL 适当比例稀释Ki67、DOG1 一抗,4℃孵育过夜,PBS 清洗5 次;加入二抗室温孵育30min~1h,PBS 清洗5 次;滴加过氧化物酶标记的链霉亲和素(SP)室温孵育30min~1h,PBS 清洗5 次;滤纸吸干水分,加入50~100μL DAB,室温反应10min,PBS 清洗3 次;加入苏木素复染,几秒后流水充分冲洗,脱水、透明、封片。
1.4 结果判定
1.4.1 超声内镜量化标准[8]在同一频率下(9 Hz)采集两组患者超声图像,并以JPEG 格式保存。由同一人(不知病理结果)对选取的超声图像利用 Photoshop CS6 13.0 软件中沿病灶轮廓选定测定区间,测定其灰度平均值(回声强度)及灰度标准偏差(回声均匀度)。每张选定图片各测定5 次,取平均值。
1.4.2 Ki-67、DOG1 阳性表达判读 Ki-67 阳性为细胞核有棕黄色颗粒,DOG1 阳性为细胞质或细胞膜着色,每切片随机取400 倍显微镜视野5 个,分别对阳性细胞及总细胞进行计数,计算阳性细胞率。阳性细胞率=(阳性细胞数/总细胞数)×100%。
1.5 统计学方法 使用SPSS 20.0 统计学软件进行统计处理。计量资料以mean±SD 表示,两组间比较采用t 检验,多组间比较采用F 检验。绘制受试者工作特征曲线(Receiver Operating Characteristic,ROC),计算曲线下面积(Area Under the Cure,AUC),评估超声内镜、Ki-67 和DOG1 表达水平对诊断GIST 和危险度分级的效能,AUC 比较采用Z 检验。P<0.05 则认为差异具有统计学意义。
2 结果
2.1 两组患者超声内镜、Ki-67、DOG1 表达比较GIST 组超声内镜图像的灰度平均值及灰度标准偏差、Ki-67 和DOG1 表达阳性细胞率均高于对照组(P>0.05),见表1。

表1 两组患者超声内镜、Ki-67、DOG1表达比较
2.2 超声内镜、Ki-67、DOG1 表达对GIST 的诊断价值 分别绘制超声内镜(灰度平均值、灰度标准偏差)、Ki-67、DOG1 表达及其联合诊断GIST 的ROC 曲线,将GIST 作为阳性结果,对照组作为阴性结果。超声内镜图像的灰度平均值诊断GIST 截点为62.83,AUC 为0.841;超声内镜图像的灰度标准偏差诊断GIST 截点为11.56,AUC 为0.743;Ki-67 表达阳性细胞率诊断GIST截点为7.34%,AUC 为0.785;DOG1 表达阳性细胞率诊断GIST 截点为10.69%,AUC 为0.835;联合诊断GIST的AUC 为0.954,高于单独诊断AUC 值(P<0.05)。见图1,见表2。
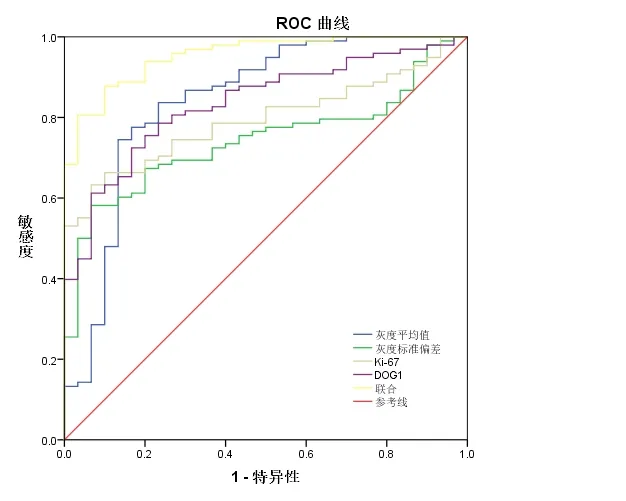
图1 超声内镜、Ki-67、DOG1表达对诊断GIST的ROC曲线
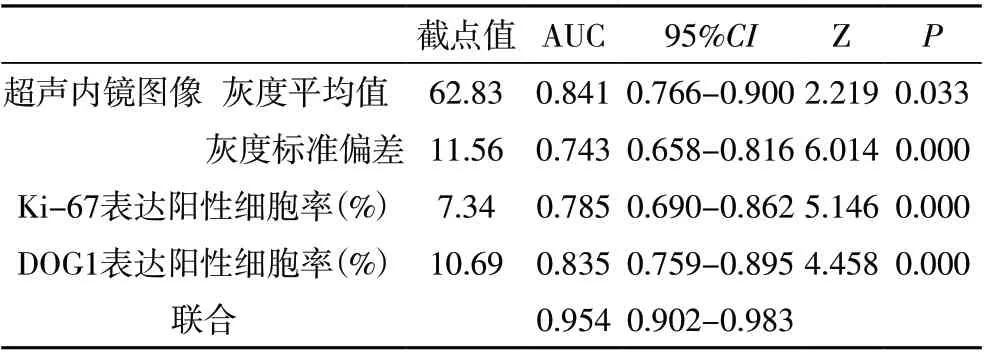
表2 超声内镜、Ki-67、DOG1表达对诊断GIST的ROC曲线分析各数值
2.3 超声内镜、Ki-67、DOG1 表达与GIST 患者临床特征的关系 GIST 患者肿瘤直径、核分裂数、危险度分级与超声内镜(灰度平均值、灰度标准偏差)、Ki-67 表达阳性细胞率有关(P<0.05),与DOG1 表达阳性细胞率无关(P>0.05);GIST 患者性别、年龄、肿瘤部位、组织学类型与超声内镜(灰度平均值、灰度标准偏差)、Ki-67、DOG1 表达阳性细胞率无关(P>0.05)。见表3。
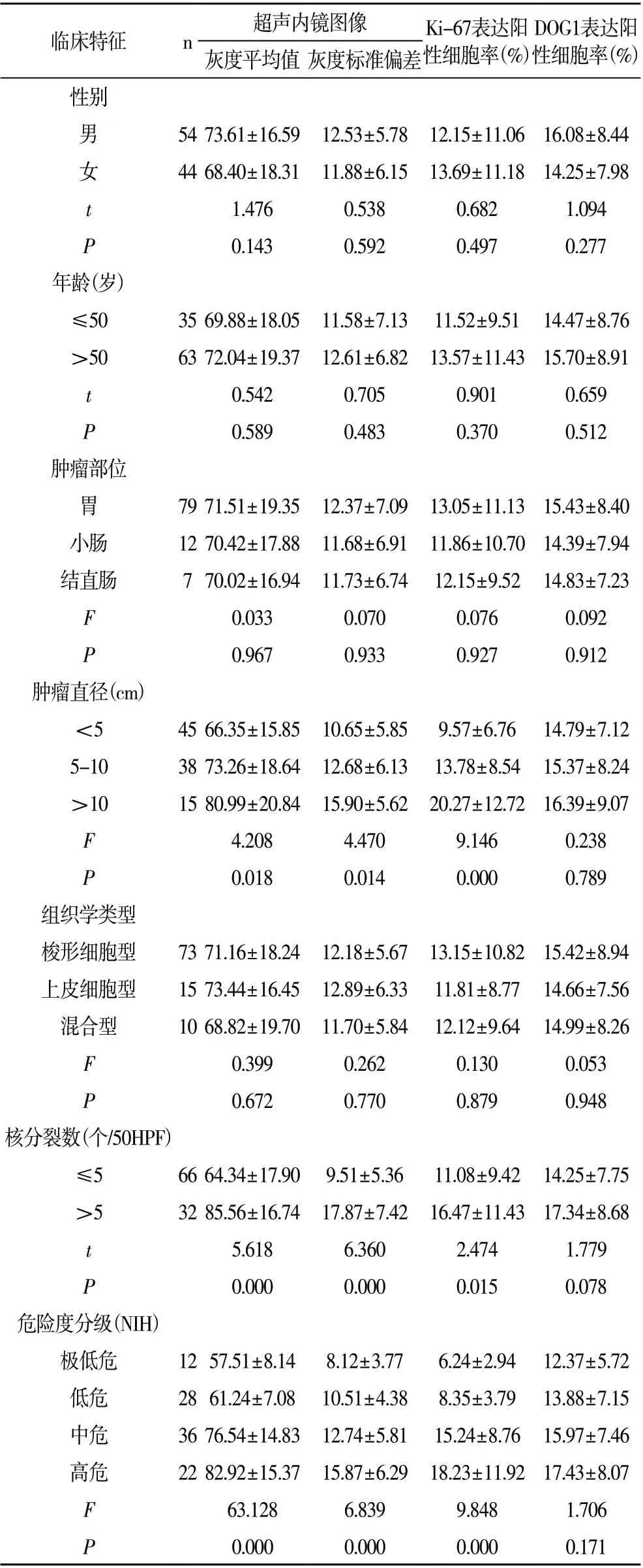
表3 超声内镜、Ki-67、DOG1表达与GIST患者临床特征的关系
2.4 超声内镜、Ki-67、DOG1 表达对GIST 危险度分级的诊断价值 分别绘制超声内镜(灰度平均值、灰度标准偏差)、Ki-67、DOG1 表达及其联合诊断GIST 的ROC 曲线,将中危和高危GIST 作为阳性结果,低危和极低危GIST 作为阴性结果。超声内镜图像的灰度平均值诊断GIST 危险度分级截点为67.34,AUC 为0.822;超声内镜图像的灰度标准偏差诊断GIST 危险度分级截点为13.05,AUC 为0.746;Ki-67 表达阳性细胞率诊断GIST 危险度分级截点为8.90%,AUC 为0.794;DOG1表达阳性细胞率诊断GIST 危险度分级截点为14.85%,AUC 为0.687;联合诊断GIST 危险度分级的AUC 为0.900,高于单独诊断AUC 值(P>0.05)。见图2,见表4。
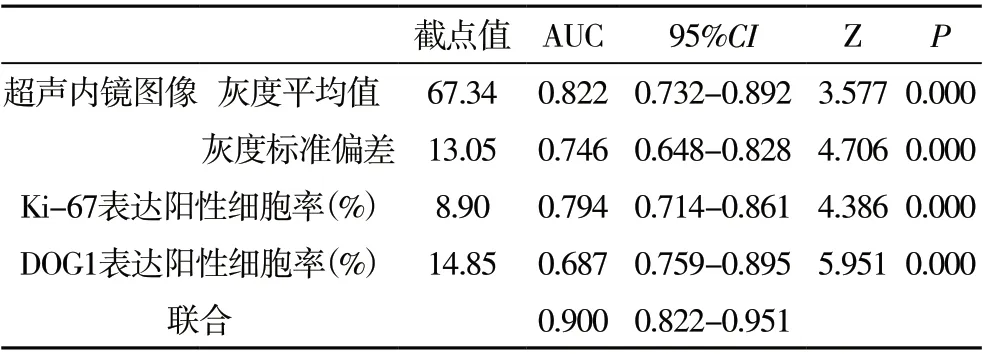
表4 超声内镜、Ki-67、DOG1表达对GIST危险度分级的ROC曲线分析各数值
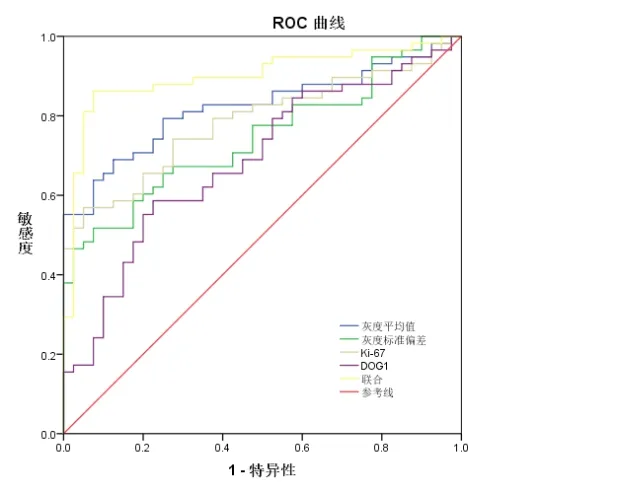
图2 超声内镜、Ki-67、DOG1表达对GIST危险度分级的ROC曲线
3 讨论
GIST 是临床中最常见的胃肠道恶性上皮下病变(SEL)[9]。GIST 被认为起源于Cajal 的间质细胞[10],Cajal 是胃肠道运动的起搏器细胞。GIST 主要是由酪氨酸激酶受体KIT 和血小板来源的生长因子受体-α的致癌突变引起的[11]。约10% ~ 30%的GIST 具有恶性临床病程[12]。此外,有报道称不仅具有高核分裂指数的大型GIST 经常表现出恶性临床病程,具有低核分裂指数的小型GIST 也会表现出恶性转移病程[13]。因此,GIST 被认为是一种潜在的恶性肿瘤。GIST 不分为良性或恶性,而是根据其恶性肿瘤的临床风险进行分层:极低、低、中或高。外科切除是治疗局限性GIST 的主要方法。然而即使肿瘤完全切除,仍有至少一半的胃肠道间质瘤患者术后会复发。尽管已证明酪氨酸激酶抑制剂可为转移患者提供持续的疾病管理[14],但无转移的小GIST 外科切除术是永久治愈的唯一有希望的治疗方法。早期诊断、早期切除是治疗GIST 的最佳策略。然而,在内窥镜检查中,GIST 经常被检测为SEL。SEL 的鉴别诊断范围很广,可以包括胃肠道外压迫、静脉曲张、异位胰腺和各种肿瘤,包括GIST、SEL 样癌、平滑肌瘤、神经鞘瘤和脂肪瘤[15]。因此,探寻可用于诊断GIST 及危险性分级的有效指标具有重要意义。
超声内镜是评估GIST 的有价值的成像工具,因为它可以显示与正常胃壁的第四低回声层(固有肌层)相邻的低回声病变。目前已经有一些关于使用EUS 鉴别GIST 和良性间质肿瘤的研究[16],但是,由于主观解释EUS 图像是观察者之间的一致性较差,在分析此类肿瘤的特征方面存在局限性。数字图像由像素组成,像素是构成二维图片的基本元素。在数字图像分析中,使用纹理分析来计算像素的分布和空间变化以提取有用的数据,因此,数字图像分析可提供有关EUS 图像的客观信息,从而可以减少在观察者之间和观察者内部主观性误差。本研究通过Photoshop 将超声内镜图像量化,以灰度平均值表示回声强度,灰度标准偏差表示回声均匀度,结果表明,GIST 组灰度平均值和灰度标准偏差显著高于对照组,并且与患者肿瘤直径、核分裂数、危险度分级相关,同时灰度平均值和灰度标准偏差对GIST 诊断和危险性分级的AUC 值分别为0.841、0.743和0.822、0.746,提示灰度平均值和灰度标准偏差能有效代表超声内镜结果,且能较好的对GIST 进行诊断和分级,与前人研究结果相似[8]。
Ki67 是一种核增殖相关抗原,存在于活跃增殖的细胞中。它在细胞周期的生长和合成阶段表达,但不在G0 阶段(静止阶段)表达。Ki67 的预后价值已经在许多研究中被研究,它作为一个可靠的标志物已经在乳腺癌、肺癌、前列腺癌、宫颈癌和结直肠癌中被证实[17-19]。因此,肿瘤细胞增殖标志物Ki67 可能是GIST 中有用的预后因素。到目前为止,已有多项研究报道了Ki67表达与GIST 恶性风险之间的相关性。LiH 等[20]报道Ki67 指数与GIST 危险分层和核分裂数呈正相关,并与CT 成像的肿瘤大小、轮廓、边缘相关;Zhou Y 等[21]报道中、高危GIST 患者中Ki67 高表达率多于低危GIST患者,Ki67 高表达可能是恶性GIST 转化风险的有用标志;Segales-Rojas P 等[22]报道Ki67 指数与GIST 复发无关。由于研究结果相互矛盾,样本量有限,Ki67 在预测GIST 恶性肿瘤风险方面的意义仍有争议。在本研究中,GIST 组Ki-67 阳性细胞率显著高于对照组,并且与患者肿瘤直径、核分裂数、危险度分级相关,对GIST诊断和危险性分级的AUC 值分别为0.785、0.794,表明GIST 患者肿瘤恶化程度高于对照组,与现有认知一致,Ki-67 表达情况可作为对GIST 进行诊断和分级的有效指标。
DOG1 属于钙离子激活的氯离子通道(CaCC)蛋白,由于其在大部分GIST 中表达而被证明是重要的诊断标记。CaCCs 在多种组织中表达,并且是正常生理功能的必要调节剂,包括神经元兴奋性、平滑肌细胞收缩、上皮液分泌和胃肠蠕动[23]。具体而言,DOG1 已显示为电压敏感且被配体激活的离子通道,可被增加的细胞内游离Ca2+激活[24]。越来越多的证据表明,DOG1 与肿瘤发生、癌症进展、转移和细胞存活[25-27]。在GIST 中,DOG1 高表达与预后不良有关,其在循环肿瘤细胞中的高水平可预示复发[28]。在本研究中,GIST 组DOG1 阳性细胞率显著高于对照组,但与患者肿瘤直径、核分裂数、危险度分级无关,对GIST 诊断和危险性分级的AUC 值分别为0.835、0.687,表明DOG1 表达检测在诊断GIST 的效能高于诊断GIST 危险性分级,与艾力·赛丁等[29]研究一致。
在本研究中,ROC 曲线分析表明,超声内镜联合Ki-67、DOG1 表达对GIST 诊断和危险性分级的AUC值高于单独诊断,效能更高。提示临床中可检测三者指标以综合评估患者病情,尽早进行干预。本研究也存在一定的局限性,研究样本量较少,需要进一步扩大样本进行研究分析;同时本研究缺乏长期随访,未对患者预后进行分析。
综上所述,GIST 患者超声图像显示回升强、不均匀程度高,Ki-67、DOG1 表达阳性细胞率高,对患者进行超声内镜、Ki-67 和DOG1 表达检测有助于预测病情严重程度。

